姜黄素对结肠炎动物模型炎症反应及VCAM-1表达的影响*
2020-08-04刘纯宝周俊芬程小杰陆涤宇
刘纯宝, 周 俊, 夏 亮, 周俊芬, 程小杰, 苏 航, 陆涤宇
华中科技大学同济医学院附属武汉中心医院核医学科,武汉 430014
姜黄素是从姜科植物中提取的二芳基庚烷类活性物质,具有抗炎、抗氧化、抗肿瘤、促进免疫调节等作用[1]。作为中药活性成分,姜黄素对炎症的抑制作用已被诸多实验证实,且已应用于炎症性肠病、心血管病、类风湿性关节炎、阿尔茨海默病、创伤愈合等多种疾病的治疗[2]。姜黄素的抗炎机制目前尚不完全明确,可能与抑制转录因子核因子κB(nuclear factor kappa-B,NF-κB)的激活,抑制环氧化酶(cyclooxygenase,Cox)的表达,以及抑制其他炎症因子如肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素(interleukin,IL)、转化生长因子β(transforming growth factor-β,TGF-β)等的表达有关[3]。已有研究表明姜黄素可对众多靶点产生作用[4],涉及转录因子、细胞周期、血管生成、粘附分子、自噬等方面。血管细胞粘附分子-1(vascular cell adhesion molecule-1,VCAM-1)表达于活化的血管内皮细胞,可介导炎性细胞粘附并促进其向内皮下迁移,是重要的炎症募集分子[5]。本课题组的前期研究已证实VCAM-1在结肠炎病变部位的表达量与炎症程度相关[6]。VCAM-1可能是姜黄素的抗炎靶点之一[4],但姜黄素通过其发挥抗炎作用的机制仍有待证实。本研究以结肠炎模型兔为研究对象,探究姜黄素对结肠炎的治疗作用以及对VCAM-1表达的影响,为明确姜黄素的抗炎效果和机制提供证据。
1 材料与方法
1.1 主要材料与仪器
新西兰兔[许可证号:SCXK(鄂)2015-0018,华中科技大学同济医学院实验动物中心,兔龄4个月,体质量2.0~2.5 kg,清洁级]、兔维持饲料、硫酸葡聚糖钠(dextran sulfate sodium,DSS;美国Sigma-Aldrich公司)、三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS;上海百灵威公司)、姜黄素(上海碧云天生物技术公司)、HF-3800血细胞分析仪(山东海力孚公司)、苏木精-伊红(hematoxylin-eosin,HE)染色及免疫组化(immunohistochemistry,IHC)染色试剂(武汉百奥斯生物科技公司)、小鼠抗兔VCAM-1单克隆抗体及小鼠抗兔分化簇68(cluster of differentiation 68,CD68)单克隆抗体(美国Abcam公司;货号:ab98954,ab213096)、Image-Pro Plus软件(美国Media Cybernetics公司)。
1.2 结肠炎动物模型复制与鉴定
本研究动物实验已获华中科技大学同济医学院动物伦理委员会批准,动物伦理审批号:[2019]伦审字(S1807)号。以TNBS联合DSS的方法进行结肠炎动物模型复制[7]。取TNBS粉末溶于50%乙醇,制备成浓度为15 mg/mL的溶液。取DSS粉末,按1 g/100 mL比例溶于纯净水中,作为动物饮用水。雄性新西兰兔经耳缘静脉缓慢注射3%戊巴比妥钠进行麻醉,将导管插入麻醉好的动物肛门内15 cm,以TNBS溶液10 mL灌肠。将兔饲养于清洁级动物房,自由饲喂普通兔维持饲料和DSS饮水,持续5 d。造模结束后将模型兔于耳缘静脉注射空气处死,解剖取结肠组织,以4%多聚甲醛固定,经石蜡包埋、切片、苏木精-伊红(HE)染色等过程制备病理切片。取同龄雄性未造模兔,处死后解剖取结肠组织制备HE切片。在显微镜下对比观察模型动物和未造模动物的肠黏膜形态。
1.3 姜黄素给药及动物体质量、血液指标监测
取结肠炎模型兔20只,随机分为给药组和对照组,每组各10只。给药组动物饲料中加入质量分数为0.2%的姜黄素,对照组饲喂普通兔维持饲料,两组均以纯净水作为饮水,持续饲养10 d。每日称量动物体质量,并每隔1 d于动物耳缘静脉取血,检测血液中白细胞、红细胞、血红蛋白含量,观察各数据的增减变化。
1.4 结肠病理检测及定量分析
于姜黄素给药观察的第11天将给药组和对照组动物处死后解剖取结肠组织,观察黏膜病变情况,并经4%多聚甲醛固定、石蜡包埋、切片后分别进行HE染色和免疫组织化学(IHC)染色。IHC染色过程分别以小鼠抗兔VCAM-1单克隆抗体和小鼠抗兔CD68单克隆抗体为一抗,以羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG)为二抗,孵育后加入底物显色,在显微镜下观察结肠组织VCAM-1和CD68表达情况。
解剖获得的结肠组织洗净后观察其黏膜形态,其HE切片依据简化的Geboes评分标准进行评分[8]。具体评分标准为:各组织结构形态正常为0分;黏膜下层水肿,无炎性细胞浸润为1分;黏膜下层及黏膜层有明显炎性细胞浸润为2分;组织结构破坏,黏膜脱落变薄为3分。结肠组织的IHC切片经图像分析软件Image-Pro Plus定量分析其VCAM-1和CD68表达情况,所获结果以单位面积的积分光密度(integrated optical density,IOD)表示。
1.5 统计学分析
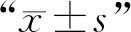
2 结果
2.1 动物模型鉴定
雄性新西兰兔经TNBS灌肠和DSS饮水造模后出现明显腹泻症状。肉眼可见结肠组织黏膜形态消失,肠壁多发溃疡和出血点;HE切片见肠壁结构破坏,黏膜出血,黏膜下层水肿,大量炎性细胞浸润(图1)。未造模组动物结肠黏膜形态光整,镜下结构清晰,无炎性细胞浸润。证实结肠炎动物模型复制成功。
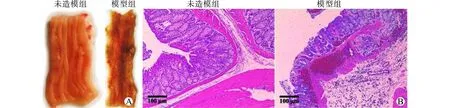
图1 结肠炎模型兔肠黏膜大体形态(A)及苏木精-伊红切片图(B)Fig.1 Gross appearance of the colon and HE slices of colon tissue in colitis rabbits and controls
2.2 体质量及血液指标改变
以姜黄素给药第0天的数据为参照,计算所获血液学指标(白细胞、红细胞、血红蛋白)和体质量的增减变化情况,生成随时间变化曲线(图2)。给药组和对照组的数据采用重复测量设计的方差分析进行比较,结果显示:两组动物的外周血白细胞变化差异有统计学意义(F=22.09,P<0.01),体质量变化差异有统计学意义(F=22.56,P<0.01),而红细胞变化差异(F=0.54,P=0.473)及血红蛋白变化差异(F=0.13,P=0.722)均无统计学意义。
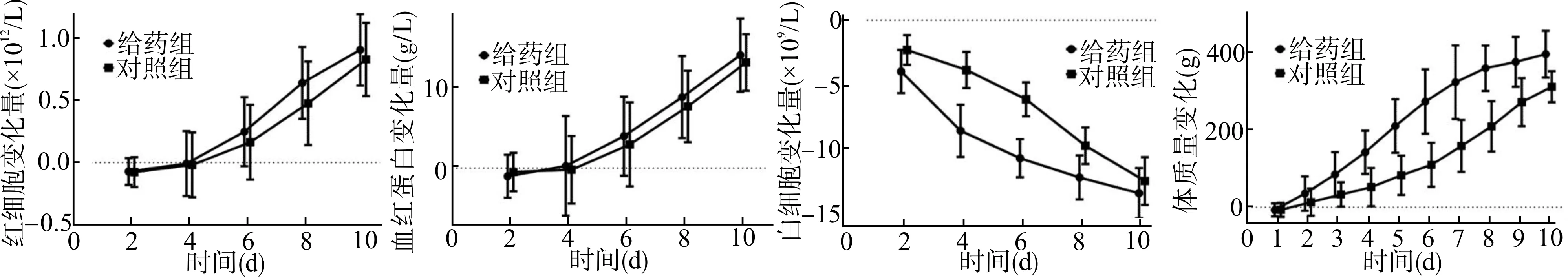
图2 给药组及对照组模型兔血液学指标及体质量变化曲线(n=10)Fig.2 The blood parameter and weight variation curves of colitis rabbits between curcumin therapy group and control group(n=10)
2.3 结肠组织病理结果
结肠炎模型兔经姜黄素饲料治疗后,肉眼可见结肠黏膜溃疡变浅、愈合,对照组肠黏膜存在较多溃疡及污秽附着(图3)。结肠HE切片病理评分依次为0~3分的例数,在给药组分别为3、4、2、1例,在对照组分别为0、2、6、2例,Wilcoxon秩和检验显示给药组和对照组间的差异有统计学意义(Z=-2.146,P=0.032)。
2.4 结肠内炎症因子表达情况
IHC染色可见给药组VCAM-1及CD68表达减少,而对照组表达量较高,提示姜黄素治疗后病变部位炎症减轻(图4)。对IHC图像定量分析获得单位面积IOD,其中VCAM-1表达量在给药组为(0.057±0.017),对照组为(0.135±0.026),二者差异有统计学意义(t=7.87,P<0.01);CD68表达量在给药组为(0.034±0.013),对照组为(0.085±0.033),二者差异有统计学意义(t=4.57,P<0.01)。

图4 结肠黏膜IHC示姜黄素给药组及对照组VCAM-1及CD68表达情况Fig.4 VCAM-1 and CD68 expression in colon of curcumin therapy group and control group

A1:给药组结肠大体形态;A2:对照组结肠大体形态;B1~B3:结肠病理评分为1~3分的代表性HE切片,标尺为100 μm图3 姜黄素治疗后结肠炎模型兔肠黏膜形态及HE切片图Fig.3 Gross appearance of the colon and HE slices of colon tissues of colitis rabbits after curcumin therapy
3 讨论
炎症是活体组织对损伤因子所产生的防御反应,可清除致病因子,协助组织修复和再生[9]。炎症病理过程引起局部增殖、水肿和血管生成,长期免疫细胞浸润和细胞因子刺激则形成慢性炎症,影响组织修复过程,造成病变迁延不愈[10]。炎症性肠病(inflammatory bowel disease,IBD)为肠道的慢性非特异性炎症,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),其发病机制与基因、环境、免疫介导及肠道菌群有关[11]。本研究在新西兰兔复制结肠炎模型,动物造模后出现肠黏膜水肿、破坏和出血,为急性炎症反应,部分黏膜下层长期大量炎性细胞浸润并出现新生血管,病灶转为慢性炎症。临床上炎症性肠病的治疗以抑制炎症反应为主,因此对炎症病理过程的理解有助于疾病控制。
姜黄素的抗炎效果在诸多疾病的治疗中均有体现。姜黄素的抗氧化作用可清除氧自由基,降低化学性肝损伤所致的肝酶升高,对肝脏具有保护作用[12]。姜黄素可降低糖尿病动物模型中巨噬细胞相关的细胞因子释放,减轻氧化应激,改善组织对胰岛素敏感性[13]。在脑缺血损伤病变中,姜黄素能抑制IL-6、TNF-α等炎性因子释放并阻止中性粒细胞粘附,降低内质网应激,保护线粒体,减轻缺血再灌注损伤[14]。本研究中模型动物给予姜黄素饲喂后体质量上升速度和白细胞下降速度均较对照组快,证实了姜黄素对结肠炎的治疗效果。CD68是巨噬细胞的可靠标记物,姜黄素给药后结肠病理切片VCAM-1和CD68表达减少,提示病灶内炎症减轻。已有研究在肿瘤、慢性炎症性疾病、心血管疾病、糖尿病、自身免疫疾病等患者中开展了姜黄素临床实验,结果提示其可能具有广阔的应用前景[15]。
VCAM-1在活化的血管内皮细胞高表达,其与免疫细胞表面的α4β1整合素结合可介导免疫细胞与靶部位内皮细胞粘附并促进免疫细胞向内皮下浸润,发挥免疫募集作用[16]。有研究指出姜黄素可通过抑制转录因子NF-κB的激活而降低VCAM-1表达[17],并抑制TNF-α介导的粘附分子表达和促炎细胞因子释放[18],最终减少炎性细胞募集。有其他研究也观察了姜黄素对结肠炎的治疗作用[19-20],但未见探讨姜黄素对VCAM-1表达和炎症细胞募集的影响。文献表明姜黄素对环氧合酶、基质金属蛋白酶、白细胞介素、TGF-β等的表达影响也与其抗炎机制相关[21],其详细抗炎机制还需进一步明确。
本研究的不足在于姜黄素给药时未控制剂量,致使不同个体之间药物摄入量存在差别。动物造模后存在腹泻症状,病情严重时的拒食可能造成姜黄素摄入量不足,对治疗效果造成一定影响。采用灌胃或腹腔注射给药则可避免姜黄素摄入剂量的差别,增强其治疗效果的说服力。总之,本研究成功制备了结肠炎动物模型,并观察到姜黄素抑制其炎症病变的效果,研究结果提示姜黄素可降低结肠炎动物外周血白细胞水平,降低病变部位VCAM-1表达和炎性细胞募集,并可能促进结肠炎溃疡愈合。本研究证实了姜黄素对结肠炎模型兔的治疗效果和对VCAM-1表达的影响,为姜黄素的进一步临床应用提供了依据。
