程序性死亡受体 1和程序性死亡受体配体 1在非小细胞肺癌组织中的表达情况及临床意义
2020-08-01门桐林李雪袁秀敏张璐
门桐林,李雪,袁秀敏,张璐
沈阳市第十人民医院肿瘤科,沈阳110044
肺癌是目前世界上发病率和病死率均较高的 恶性肿瘤之一,其中非小细胞肺癌(non‐small cell lung cancer,NSCLC)约占全部肺癌的85%,是一种最常见的肺癌类型[1]。NSCLC早期症状不明显,大多数患者就诊时已为晚期,失去了手术治疗的最佳时机。目前放疗、化疗等治疗方法对晚期NSCLC患者的治疗效果不佳,随着对肿瘤免疫逃逸机制的不断探索,研究者发现一些免疫检查点的负性调节在NSCLC的发生发展过程中发挥着重要作用[2‐3]。 程序性死亡受体 1(programmed cell death 1,PDCD1,也称PD‐1)和程序性死亡受体配体 1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD‐L1)可以通过负性调节,降低过度免疫,保护周围的正常组织免受损伤,从而增强肿瘤微环境对机体正常免疫的抵抗作用[4‐6]。PD‐1/PD‐L1 信号通路在微环境中能够诱导NSCLC免疫逃逸机制的产生,导致肿瘤细胞逃避机体的杀伤作用,并在机体其他组织器官中创造肿瘤微环境,为肿瘤的扩散提供条件[7‐8]。目前PD‐1/PD‐L1信号通路成为研究的热点问题之一,PD‐1/PD‐L1信号通路阻滞剂抗PD‐1和抗PD‐L1抗体能够逆转NSCLC免疫逃逸,杀死肿瘤细胞。本研究主要探讨PD‐1和PD‐L1在NSCLC组织中的表达情况及临床意义,现报道如下。
1 对象与方法
1.1 研究对象
选择2015年1月至2017年1月沈阳市第十人民医院收治的150例NSCLC患者。纳入标准:①经病理检查确诊为NSCLC;②首次诊断并接受外科手术治疗;③未接受过放疗、化疗及其他免疫治疗。排除标准:①合并其他恶性肿瘤及免疫系统疾病;②合并严重的心血管疾病或心肾功能不全;③合并感染等并发症;④不配合治疗。150例NSCLC患者中,男80例,女70;年龄26~67岁,平均(49.41±2.83)岁;病理类型:鳞状细胞癌30例,腺癌88例,腺鳞癌32例。收集患者的NSCLC组织及其癌旁组织(距肿瘤边缘3 cm内)各150例,所有标本取得后立刻放入液氮罐中,储存于-80℃冰箱中保存。本研究经医院伦理委员会审批通过,所有研究对象均对本研究知情并签署知情同意书。
1.2 实时荧光定量聚合酶链反应检测PD- 1和PD-L 1的相对表达量
分别取储存于-80℃冰箱的NSCLC组织及癌旁组织100 mg,利用Trizol法提取RNA,应用紫外分光光度计测定RNA的质量与浓度,应用1%的核酸胶检测RNA的完整性。应用Takara逆转录试剂盒将质量较好的RNA反转录成cDNA,储存于-20℃冰箱中备用。采用TransStart Top Green qPCR Su‐perMix荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒检测两种组织中PD‐1、PD‐L1的表达情况。PD-1上游引物为5'‐AGGTGCTGAT‐GGAGAAGGA‐3',下游引物为5'‐GTGATTG‐CAGCCACGAAC‐3';PD-L1上游引物为 5'‐AGGT‐GCTGATGGAGAAGGA‐3',下游引物为 5'‐GT‐GATTGCAGCCACGAAC‐3'。以甘油醛‐3‐磷酸脱氢 酶(glyceraldehyde‐3‐phosphate dehydrogenase,GAPDH)为内参,其上游引物为 5'‐ACTTCAA‐CAGCGACACCCACT‐3',下 游引 物 为5'‐GC‐CAAATTCGTTGTCATACCAG‐3'。PCR 反应体系(20 µl):10µmol/L的上下游引物各 0.4µl,模板0.5µl,STBR Premix Ex Taq Mix 10µl,ddH2O 8.7 µl。反应条件:95 ℃ 3 min,95 ℃ 30 s,60 ℃30 s(每次循环后采集荧光),72℃1 min,进行40个循环。采用Bio‐Rad CFX Manager软件进行数据分析,根据溶解曲线判断PCR产物的特异性,采用2-△△Ct法计算PD-1mRNA和PD-L1mRNA的相对表达量。实验重复3次。
1.3 免疫组织化学染色方法及结果判定
收集NSCLC组织及癌旁组织,应用10%的甲醛固定24 h,石蜡包埋,采用免疫组织化学染色法进行染色。应用冷冻切片机将制作的石蜡标本切割成厚度约为4 μm的切片,将切片置于含多聚赖氨酸的载玻片上进行熔蜡,然后将石蜡切片置于60℃烘箱中烘烤120 min进行固定。将切片浸泡于二甲苯中10 min,更换二甲苯再浸泡10 min;应用无水乙醇进行梯度脱水:无水乙醇浸泡10 min,重复操作1次,95%乙醇浸泡5 min,85%乙醇浸泡5 min,无菌水浸泡5 min,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3次。加入9%的柠檬酸钠,高压加热10 min进行抗原修复,降至室温后应用PBS清洗3次,每次5 min。应用3% H2O2甲醇溶液室温孵育10 min,灭活内源性过氧化物酶,孵育后PBS冲洗3次,每次5 min。切片上滴加10%的山羊血清,37℃封闭20 min。倾倒山羊血清,按照1∶500的比例将PD‐1和PD‐L1抗体稀释,分别加入组织切片中,4℃恒温摇床上孵育过夜,然后应用PBS清洗3次,每次5 min。甩干切片,加入1∶1000比例稀释的羊抗鼠、羊抗兔二抗,37℃孵育30 min,PBS清洗3次,每次5 min。应用0.04%二氨基联苯胺进行染色,反应部位呈黄褐色时停止染色,清水冲洗多次,再应用苏木素复染30 s,清水冲洗3次。经85%、95%及100%乙醇进行梯度脱水,每次5 min,再应用二甲苯脱水2次,每次5 min,中性树脂进行封片,显微镜下观察。每次染色均应用山羊血清为一抗作为阴性对照。由2名病理科医师采用双盲法进行阅片。400倍显微镜下随机选择5个视野进行观察。染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞所占比例评分:阳性细胞所占比例<1%为0分,1%~30%为1分,31%~60%为2分,>60%为3分。染色强度评分与阳性细胞所占比例评分相加,0~3分为低表达,4~9分为高表达。
1.4 流式细胞术检测CD 4+-PD- 1、CD 8+-PD- 1、CD14+-PD-L 1、CD68+-PD-L 1的表达水平
应用PBS将收集的NSCLC组织和癌旁组织清洗干净,将组织剪碎,溶解于Ⅳ型胶原酶中,37℃反应1 h。加入1 ml无血清RPMI‐1640培养基停止组织的溶解,充分研磨。应用PBS冲洗,离心取下层沉淀细胞,应用5 ml PBS重悬细胞,缓慢注入5 ml Ficoll淋巴细胞分离液,保证重悬的细胞沉淀与Fi‐coll的比例为1.5∶1,采用Ficoll密度梯度离心法,常温下1800 r/min离心30 min。离心后取中间白膜层,再应用PBS冲洗沉淀3次,经分离得到外周血单核细胞,分别加入CD4‐异硫氰酸荧光素(fluo‐rescein isothiocyanate,FITC)、CD8‐FITC、CD14‐FITC、CD68‐FITC、PD‐1‐PE、PD‐L1‐PE抗体,4 ℃恒温摇床避光孵育30 min,PBS洗涤3次,每次5 min,上机检测前加入500 μl鞘液。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用配对t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PD- 1、PD-L 1 mRNA表达情况的比较
实时荧光定量PCR结果显示,NSCLC组织中PD-1mRNA和PD-L1mRNA的相对表达量分别为(5.03±1.92)和(4.95±1.09),分别高于癌旁组织的(1.72±0.81)和(1.25±0.24),差异均有统计学意义(t=19.454、40.601,P<0.05)。
2.2 不同临床特征NSCLC患者NSCLC组织中PD- 1、PD-L 1表达情况的比较
不同年龄、性别、病理类型、肿瘤直径的NSCLC患者NSCLC组织中PD‐1和PD‐L1的表达情况比较,差异均无统计学意义(P>0.05)。TNM分期为Ⅲ~Ⅳ期、低分化、有淋巴结转移、有远处转移的NSCLC患者NSCLC组织中PD‐1的高表达率均明显高于TNM分期为I~Ⅱ期、高+中分化、无淋巴结转移、无远处转移的患者,差异均有统计学意义(χ2=9.513、10.390、11.918、9.040,P<0.01);TNM分期为Ⅲ~Ⅳ期、低分化、有淋巴结转移、有远处转移的NSCLC患者NSCLC组织中PD‐L1的高表达率均明显高于TNM分期为I~Ⅱ期、高+中分化、无淋巴结转移、无远处转移的患者,差异均有统计学意义(χ2=8.266、11.310、28.043、32.344,P<0.01)。(表1)
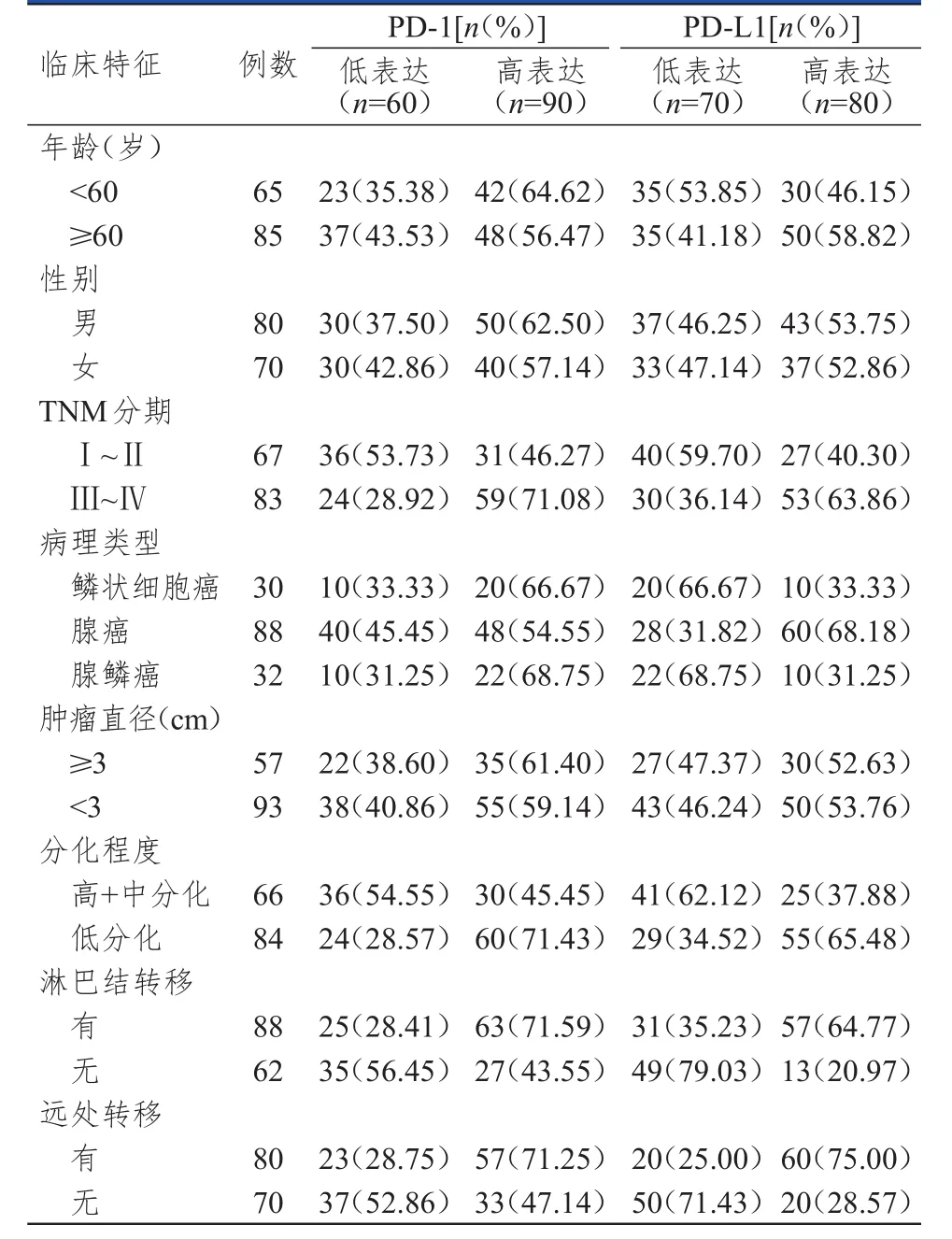
表1 不同临床特征NSCLC患者NSCLC组织中PD‐ 1、PD‐L 1的表达情况( n=150)
2.3CD 4+-PD- 1、CD 8+-PD- 1、CD14+-PD-L 1、CD68+-PD-L 1表达水平的比较
NSCLC 组织中 CD4+‐PD‐1、CD8+‐PD‐1、CD14+‐PD‐L1、CD68+‐PD‐L1的表达水平均明显高于癌旁组织,差异均有统计学意义(P<0.01)。(表2)
表2 NSCLC组织和癌旁组织中CD 4+‐PD‐ 1、CD 8+‐PD‐ 1、CD14+‐PD‐L 1、CD68+‐PD‐L 1表达水平的比较(%,± s)

表2 NSCLC组织和癌旁组织中CD 4+‐PD‐ 1、CD 8+‐PD‐ 1、CD14+‐PD‐L 1、CD68+‐PD‐L 1表达水平的比较(%,± s)
组织类型N S C L C组织(n=1 5 0)癌旁组织(n=1 5 0)t值C D 4+‐P D‐1 5 8.3 1±2 8.9 1 4 2.9 3±2 7.5 1 1 3 3.5 9 3 C D 8+‐P D‐1 5 5.9 1±2 7.9 4 4 3.7 2±2 8.9 1 1 8 8.9 8 3 C D 1 4+‐P D‐L 1 5 9.1 5±2 8.7 4 4 4.8 1±3 0.8 1 2 5.6 7 8 C D 6 8+‐P D‐L 1 5 3.7 1±2 5.5 8 4 3.8 2±2 6.9 2 9 0.3 9 3 P值0.0 0 0 0.0 0 0 0.0 0 0 0.0 0 1
3 讨论
NSCLC是世界上最常见的恶性肿瘤之一,其发病率与病死率均居全部恶性肿瘤的第1位,预后较差,已成为威胁人类健康的杀手。早期NSCLC的临床症状不明显,大部分患者确诊时已为中晚期,失去了最佳治疗时机,放疗、化疗是中晚期NSCLC患者的主要治疗手段。然而放化疗具有有效率低、不良反应较大等缺点,在机体免疫应答过程中,肿瘤可以通过逃避各种免疫监视系统完成免疫逃逸,使肿瘤细胞在机体内不断生长增殖,随着临床研究的不断深入,研究者发现肿瘤免疫逃逸可以作为治疗NSCLC的重要靶点[9‐11],其在NSCLC的发生、发展过程中发挥重要作用,该逃逸机制可为肿瘤的防治提供新方向、新思路。T淋巴细胞介导的细胞免疫应答反应在机体抗肿瘤免疫过程中扮演着重要的角色[12‐13]。T淋巴细胞的活化、增殖需要两重信号的作用,一方面需要主要组织相容性复合体(major histocompatibility complex,MHC)抗原肽复合物与抗原特异性T细胞表面受体结合,另一方面需要协同刺激分子受体与其配体相互结合提供正性、负性信号作为第二信号,进而精确参与调节免疫应答[14‐15]。PD‐1是一种常见的负性协同刺激分子,主要表达于活化的T淋巴细胞、B淋巴细胞以及巨噬细胞表面,通过与PD‐L1结合提供负性信号,抑制淋巴细胞的增殖,导致肿瘤细胞发生免疫逃逸[16‐17]。
PD‐1(CD279)作为CD28家族成员,属于I型跨膜蛋白,其细胞质区含有该家族特有的酪氨酸残基,N端序列含有VDYGEL,存在于免疫受体酪氨酸抑制基序(immunoreceptor tyrosine‐based inhibito‐ry motif,ITIM)中,可以募集SH‐2区域;C端含有TEYATI序列,该序列可以形成免疫受体酪氨酸转化基序(immunoreceptor tyrosine‐based switch motif,ITSM)[18‐19]。作为PD‐1配体的PD‐L1(CD274)属于B7家族成员,亦为I型跨膜蛋白,该蛋白由290个氨基酸组成,含有跨膜疏水区、IgC样区、IgV样区以及由30个氨基酸组成的胞内区,PD‐L1可以在活化的T淋巴细胞、B淋巴细胞及巨噬细胞表面以及心脏、胸腺等组织中表达[20‐22]。PD‐1与PD‐L1结合后,能够磷酸化ITSM结构域中的酪氨酸,聚集蛋白酪氨酸磷酸酶SHP‐2,进而导致下游磷脂酰肌醇 3‐羟激酶(phosphatidylinositol 3‐hydroxy kinase,PI3K)与Sky发生去磷酸化,经此信号通路传递抑制性信号[23]。抑制信号传递后免疫细胞的增殖、分化受到抑制,免疫反应强度降低。PD‐1与PD‐L1结合后可以产生多种生理功能,如抑制炎性因子扩散与释放、维持T淋巴细胞的稳定性,抑制淋巴细胞的增殖与分化,参与器官移植排斥与自身免疫疾病等,这些生理功能具有免疫负调控作用[24]。机体正常状态下,PD‐1和PD‐L1的结合能够维持自身的免疫耐性,防止自身免疫疾病的发生。然而机体中存在肿瘤细胞时,PD‐1与PD‐L1的结合能够抑制淋巴细胞,导致肿瘤发生免疫逃逸。
本研究结果显示,NSCLC组织中PD-1mRNA和PD-L1mRNA的相对表达量均高于癌旁组织,差异均有统计学意义(P<0.05)。提示PD‐1和PD‐L1在NSCLC组织中高表达,PD‐1和PD‐L1可能参与NSCLC的发生发展。本研究结果表明,PD‐1和PD‐L1的表达情况与NSCLC患者的TNM分期、分化程度、淋巴结转移情况和远处转移情况可能有关,预测PD‐1/PD‐L1信号通路可能通过抑制T淋巴细胞的增殖与分化,使T淋巴细胞走向衰竭,导使肿瘤细胞发生免疫逃逸,促进肿瘤细胞在其他组织器官中生长。PD‐1和PD‐L1表达升高后可减少第二信号分子的来源,使T淋巴细胞的活化受到抑制,效应T淋巴细胞经诱导后失去原有功能或者凋亡,肿瘤细胞可以成功避开机体的免疫监控,在其他部位不断增殖。肿瘤中PD‐1、PD‐L1高表达会导致机体对PD‐1和PD‐L1抗体的敏感性增加,因此其表达状态的检测具有重要意义[25]。本研究的流式细胞术结果显示,NSCLC组织中CD4+‐PD‐1、CD8+‐PD‐1、CD14+‐PD‐L1、CD68+‐PD‐L1的表达水平均明显高于癌旁组织。这可能是因为PD‐1/PD‐L1信号通路对T淋巴细胞的功能起到负性调节作用,可抑制T淋巴细胞的增殖、分化,抑制白细胞介素‐2(interleukin‐2,IL‐2)和γ干扰素(interferon‐γ,IFN‐γ)的分泌,抑制CD8+T淋巴细胞的溶解活性,诱导T淋巴细胞、B淋巴细胞以及巨噬细胞凋亡,使T淋巴细胞变成死亡或无能状态;同时其还可以诱导Treg细胞的产生,维持该细胞特有的生物学功能,进而抑制 T 淋巴细胞的活性[26‐27]。
综述所述,PD‐1和PD‐L1在NSCLC组织中高表达,PD‐1/PD‐L1信号通路可能在NSCLC免疫逃逸中发挥着重要作用,该通路的高表达抑制了T淋巴细胞的免疫应答,促进了肿瘤细胞的免疫逃逸,研究PD‐1/PD‐L1信号通路在NSCLC免疫逃逸中的作用可以为临床治疗NSCLC提供新的方法。
