丁烯酸内酯二萜衍生物的制备及抗肿瘤活性研究
2020-07-29左笑菲张晓梅陈凌云
左笑菲,杨 帆,张晓梅,陈凌云,赵 庆
云南中医药大学中药学院,昆明 650500
二萜成分在姜科姜花属植物中广泛存在,其中部分二萜具有显著的细胞毒、抗肿瘤等生物活性[1-3]。本课题组对该属植物二萜进行了系统的研究,从滇姜花、圆瓣姜花和毛姜花[4-7]中分离得到一些对多种肿瘤细胞具有显著体外细胞毒活性的二萜成分。对滇姜花的粗提物、二萜成分滇姜花素A和hedychenone进行了小鼠体内抗肿瘤活性测试,结果表明它们均能显著性抑制小鼠体内移植性肿瘤H22的生长,其中滇姜花素A对H22肿瘤生长抑制率较高,为54.27%[4]。进一步的研究表明,化合物滇姜花素C、7-hydroxy-hedychenone对小鼠体内移植性肿瘤H22的生长也具有显著的抑制作用[8]。前期工作还表明,具有丁烯酸内酯结构的二萜成分对多种肿瘤细胞大多具有较高的体外细胞毒活性。例如呋喃二萜coronarin E没有细胞毒活性;但如果将coronarin E氧化,得到的一个具有γ-羟基丁烯酸内酯结构单元的二萜(4,图1)对五种肿瘤细胞株具有不同程度的细胞毒活性[6]。据此初步推测:具有呋喃型二萜成分呋喃环转化为具有丁烯酸内酯结构的衍生物,有可能提高其细胞毒活性。虽然呋喃二萜转化为丁烯酸内酯型二萜通常可以提高其体外细胞毒活性,但其体内抗肿瘤活性是否也同时提高,需要进一步探讨。因此,我们的后续工作以二萜coronarin E、hedychenone和滇姜花素A[9]为原料进行结构改造,制备了三个具有γ-羟基丁烯酸内酯结构的衍生物,并对这三个产物进行了对小鼠体内移植性肿瘤H22和S180的抗肿瘤活性测试。
1 材料与方法
1.1 材料
核磁共振氢谱、碳谱由BrukerAM-400超导型核磁共振仪测定。柱色谱硅胶(300~400目)和硅胶H(青岛海洋化工厂)。薄层色谱硅胶G板(青岛海洋化工厂),薄层显色的常规方法为:5%硫酸-乙醇溶液在150 ℃下烘烤显色明显。
二萜成分coronarin E(1)、hedychenone(2)、滇姜花素A(3)均由云南中医药大学赵庆课题组提供。
H22细胞株(江阴齐式生物科技有限公司)。S180细胞株(昆明动物研究所细胞库)。清洁级ICR小鼠共100只,雌雄各半,体重18~21 g,由昆明医科大学实验动物中心提供(编号SCXK(滇)K2015-0002)。白血病细胞株HL-60、肝癌细胞株SMMC-7721、肺癌细胞株A-549、乳腺癌细胞株MCF-7和结肠癌细胞株SW480均由中国科学院昆明植物研究所分析测试中心提供。
1.2 三个二萜成分的结构改造
1.2.1 Coronarin E(1)的光敏氧化反应制备化合物4
Coronarin E(1)光敏氧化制备化合物4参见文献[10]:取1.00 g coronarin E(1),溶于250 mL干燥的二氯甲烷中,加入5 mLN,N-二异丙基乙胺,加入20 mg四苯基卟啉(TPP),通入氧气并搅拌,在-45 ℃及LED灯照射下反应6 h,TLC检测原料反应完全。蒸干溶剂,残余物经硅胶柱色谱分离,石油醚-乙酸乙酯(4∶1)洗脱,得到化合物4[10](0.81 g,白色粉末,产率73%),其化学结构如图1所示。
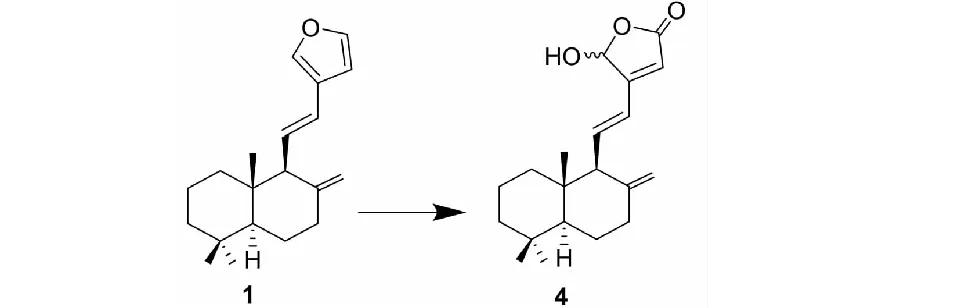
图1 化合物1的光敏氧化
1.2.2 Hedychenone(2)的光敏氧化反应制备化合物5
取hedychenone(2)1.00 g,溶于250 mL干燥的二氯甲烷中,加入5 mLN,N-二异丙基乙胺,加入20 mg四苯基卟啉(TPP),通入氧气并搅拌,在-45 ℃及LED灯照射下反应6 h,TLC检测原料反应完全。蒸干溶剂,残余物经硅胶柱色谱分离,石油醚-乙酸乙酯2∶1洗脱,得到化合物5(0.74 g,白色粉末,产率为67%)。化合物5的1H NMR和13C NMR数据与姜科植物草果药(Hedychiumspicatum)中发现的二萜成分spicatanol[11]一致,由此确定化合物5为spicatanol。
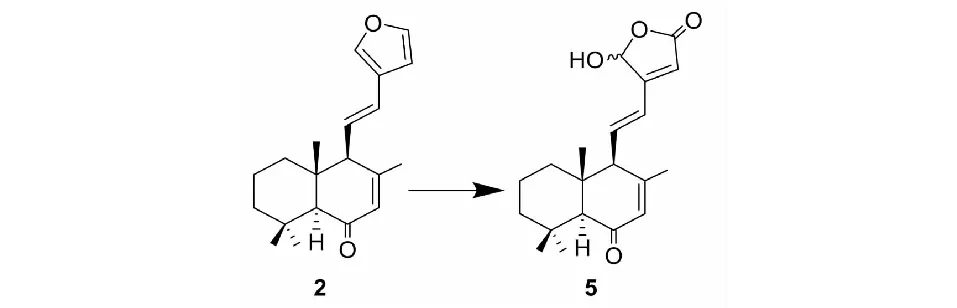
图2 化合物2的光敏氧化
1.2.3 滇姜花素A(3)的酰化与光敏氧化反应制备化合物7
称取滇姜花素A(3)2.30 g,溶解于15 g吡啶,缓慢加入苯甲酰氯10 g,在100 ℃下加热3 h,在常温下再静置两天。将反应液倾入200 mL 5%碳酸钠溶液中,搅拌2 h。用乙酸乙酯萃取两次(200 mL×2),萃取液合并后,用10 %磷酸二氢钠水溶液洗涤三次(50 mL×3)。乙酸乙酯层用无水Na2SO4干燥24 h,浓缩回收。用硅胶柱色谱分离,石油醚:乙酸乙酯(60∶1→10∶1)洗脱。得化合物6(1.40 g,产率40%)。
称取化合物61.00 g,溶于250 mL无水二氯甲烷中,加入5 mLN,N-二异丙基乙胺,10 mg四苯基卟啉(TPP),通入氧气并搅拌。在-45 ℃及LED灯照射下反应7 h,TLC检测原料反应完全。反应液浓缩回收,残余物用二氯甲烷溶解,经硅胶柱色谱分离,石油醚-乙酸乙酯(2∶1)洗脱,得到化合物7(0.47 g,产率31.5%)。7为白色无定形粉末,无明确熔点。根据反应机理,7的结构式应如图3所示,该结构与高分辩质谱确定的分子式C27H32O5相吻合,也与NMR数据相符。7与文献报道的二萜滇姜花素C[12]结构相似,差别仅在于:7的C-6位为β-羟基取代,而滇姜花素C的C-6位为β-苯甲酰氧基取代。因此,7的二萜结构单元1H NMR、13C NMR数据与滇姜花素C很相似,将二者的NMR数据对比,即可对7的二萜结构单元的NMR数据进行归宿。再采用软件Chemdraw对7的苯甲酰氧基部分的1H NMR和13C NMR进行预测,根据预测的结果与实测结果对照,可对分子中的甲酰氧基结构单元的NMR数据进行归属。
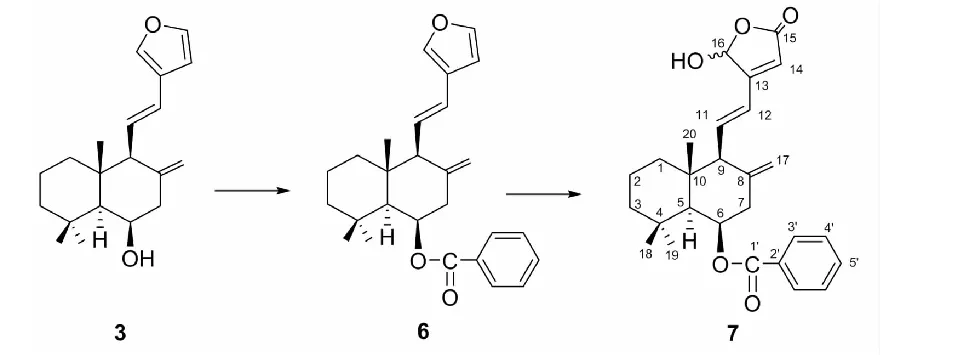
图3 化合物7的制备
1.3 化合物1、2、5、6和7的体外细胞毒活性测试
采用MTT法[13,14],测定化合物1、2、5、6和7对五个肿瘤细胞株的体外细胞毒活性。阳性对照采用顺铂。
1.4 小鼠体内抗肿瘤实验
清洁级ICR小鼠共100只,雌雄各半,体重18~21 g。每次实验采用50只小鼠,将小鼠随机分为5组,分别为阴性对照组、阳性对照组、化合物4组、化合物5组和化合物7组,每组10只小鼠,雌雄各半。小鼠在适应性喂养2天后,于左前肢皮下接种新鲜的H22(或者S180)肿瘤细胞悬液(0.1 mL/鼠,1×106细胞)。在接种肿瘤细胞后的第2日开始按分组给药。阴性对照组腹腔注射给予DMSO,阳性对照组给予异环磷酰胺,其它各组给予相应的待测物。每天给药1次,于给药的第7天将动物脱臼处死,完整剥离肿瘤并在电子称称肿瘤重量及肿瘤剥离后的动物体重。比较分析各组肿瘤重量及瘤重抑制率。
瘤重抑制率=(阴性对照组肿瘤平均重量(g)-样品组肿瘤平均重量(g))/阴性对照组平均肿瘤重量(g)×100%
2 结果与分析
2.1 新化合物的波谱数据
化合物7HR-ESI-MS:m/z475.188 4[M+K]+(calcd for C27H32O5K+,475.188 7);1H NMR(400 MHz,CDCl3)δ:1.04(3H,s,H-18),1.25(3H,s,H-19),1.38(3H,s,H-20),4.60/4.69(1H,H-17a),5.77(1H,s,H-17b),4.62(1H,s,H-6),5.88(1H,s,H-16),6.29/6.68(1H,s,H-14),6.36(1H,d,J= 15.9 Hz,H-12),6.68~6.74(1H,m,H-11),7.43~7.47(2H,m,H-4′),7.55~7.58(1H,m,H-5′),8.02~8.05(2H,m,H-3′);13C NMR(100 MHz,CDCl3)δ:42.2(t,C-1),19.1(t,C-2),43.3/43.4(t,C-3),34.4(s,C-4),55.8(d,C-5),71.1(d,C-6),44.0(t,C-7),144.2(s,C-8),62.3(d,C-9),40.5/40.4(s,C-10),142.9(d,C-11),115.9(d,C-12),144.0(s,C-13),142.8(d,C-14),171.2(s,C-15),97.6/97.7(d,C-16),111.7/112.1(t,C-17),33.4(q,C-18),23.6(q,C-19),18.1/18.2(q,C-20),166.2(s,C-1′),130.5(s,C-2′),129.6(d,C-3′),128.5(d,C-4′),133.0(d,C-5′)。
2.2 化合物1、2、5、6和7对五种肿瘤细胞株的细胞毒活性
采用MTT法[13,14]测定化合物1、2、5、6和7对五种人肿瘤细胞株的细胞毒活性,测试结果见表1。化合物5和7对五种肿瘤细胞株均具有显著的细胞毒活性,这两个化合物对肝癌细胞株SMMC-7721、肺癌细胞株A-549、乳腺癌细胞株MCF-7和结肠癌细胞株SW480的抑制活性均超过阳性对照顺铂。此外,我们的前期研究工作已表明,化合物4对五种肿瘤细胞株亦具有不同程度的细胞毒活性[6]。
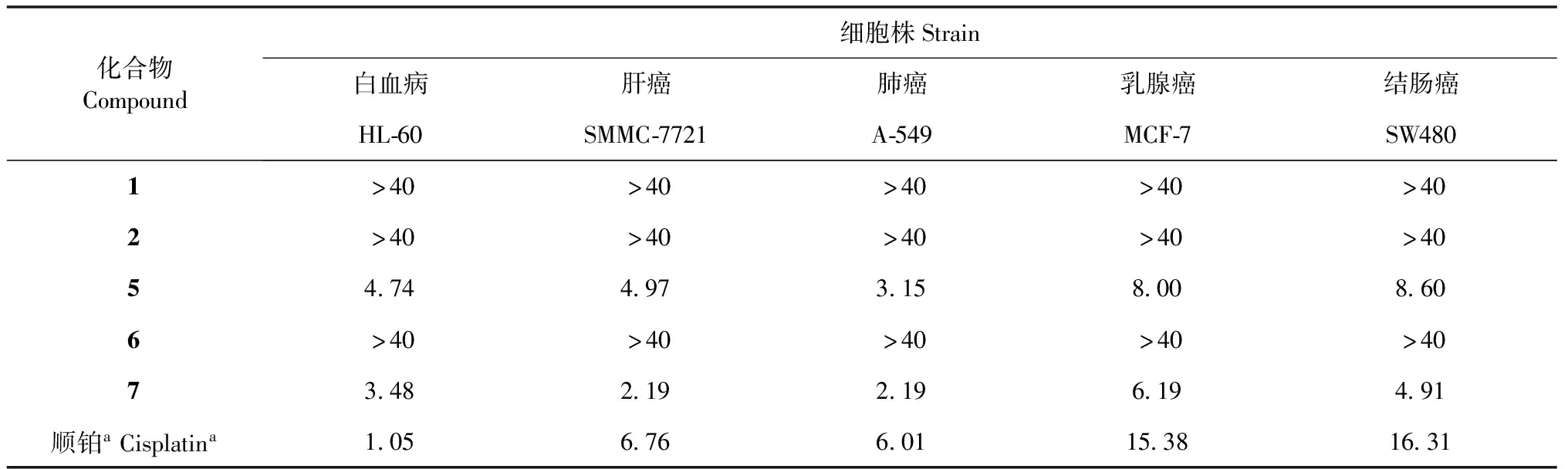
表1 化合物1、2、5、6和7对五种人肿瘤细胞的半抑制浓度IC50
2.3 化合物4、5及7对小鼠体内H22肿瘤细胞生长的抑制活性
体内抗肿瘤实验结果见表2和图4。小鼠的体重,瘤重均数采用t检验进行统计分析。

图4 化合物4、5、7和异环磷酰胺对H22荷瘤鼠肿瘤的影响
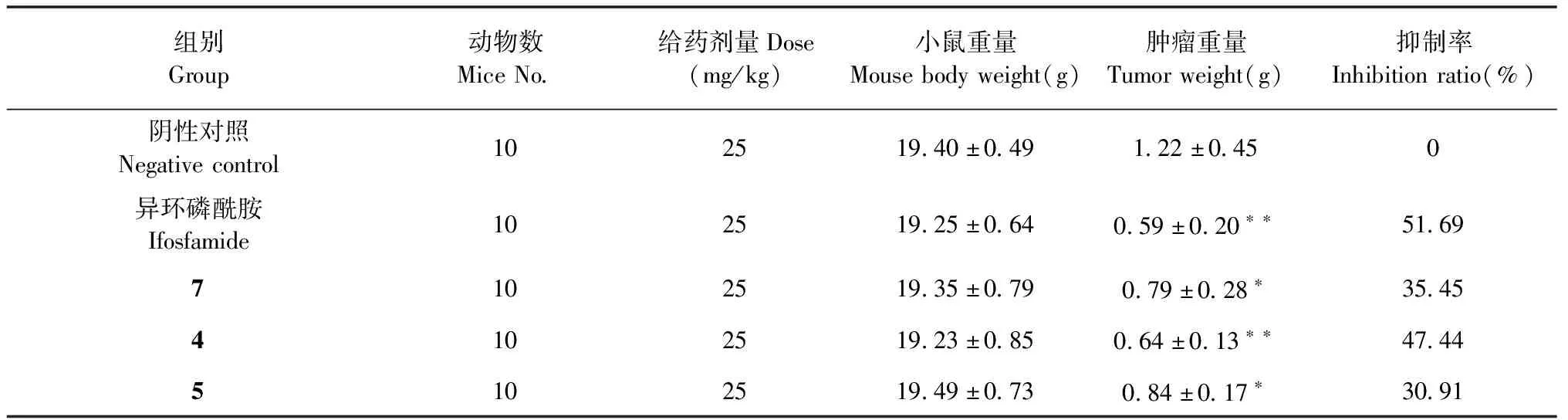
表2 小鼠体内抗H22肿瘤实验研究结果
2.4 化合物4、5及7对小鼠体内S180肿瘤细胞生长的抑制活性
体内抗肿瘤实验研究结果见表3和图5。小鼠的体重,瘤重均数采用t检验进行统计分析。

图5 化合物4、5、7和异环磷酰胺对S180荷瘤鼠肿瘤的影响
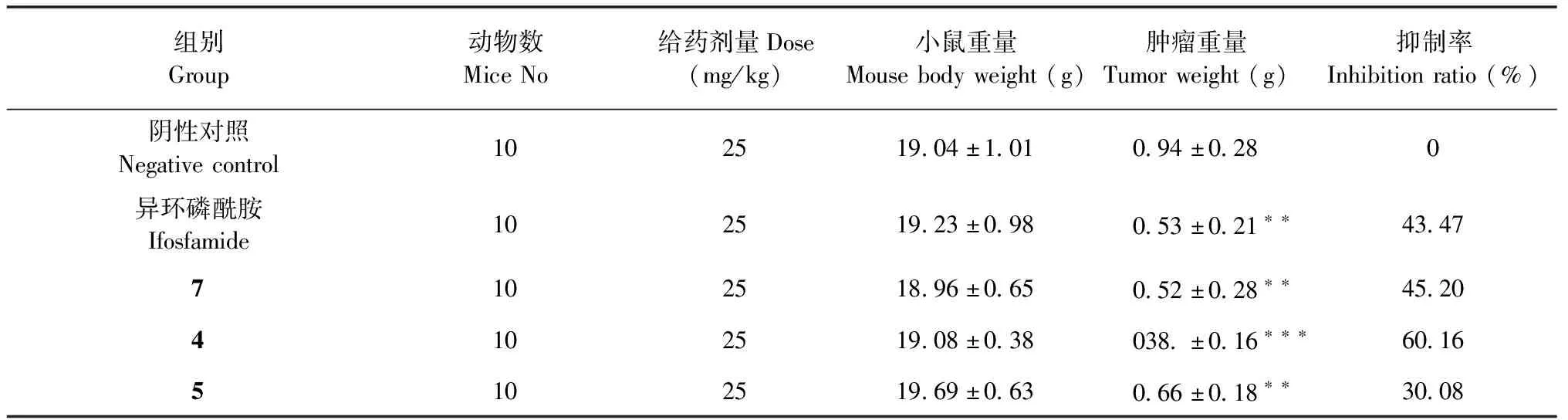
表3 小鼠体内抗S180肿瘤实验研究结果
对小鼠体内移植性肿瘤H22和S180抑制活性研究结果表明,化合物4、5及7均显示了明显的体内抑瘤活性,其中4对H22体内抑瘤活性较强,抑制率接近阳性对照药物异环磷酰胺。化合物4、7对小鼠肉瘤细胞S180的体内抑瘤活性较强,抑制率均超过阳性对照药物异环磷酰胺。
3 讨论
采用三个姜科二萜成分1、2和3经结构改造,得到的三个具有γ-羟基丁烯酸内酯结构的衍生物4、5和7,它们不仅对五种人类肿瘤细胞株有很好的体外细胞毒活性,而且对小鼠体内移植性肿瘤H22和S180的生长均具有显著的抑制作用。呋喃型二萜1和2均未显示细胞毒活性,而它们在氧化后得到的γ-羟基丁烯酸内酯型二萜4[6]和5均具有显著的细胞毒活性。在前期工作中,二萜coronarin E(1)对小鼠体内移植性肿瘤H22未显示抗肿瘤活性[8];但是其氧化后得到的化合物4,对小鼠体内移植性肿瘤H22和S180生长的抑制作用较强。化合物5和7的抗肿瘤活性也较强。这说明,将姜科的二萜类成分改造为具有γ-羟基丁烯酸内酯结构的衍生物,有可能提高其抗肿瘤活性。从具有丁烯酸内酯结构单元的二萜成分中寻找有苗头的抗肿瘤活性成分或先导化合物,可作为未来抗肿瘤药物的一个研究方向。
