紫薇花器官发育调控基因LiFUL1的分离与表达分析
2020-07-28黄小珍乔中全曾慧杰李永欣王晓明
黄小珍,乔中全,曾慧杰,李永欣,3,何 钢,王晓明
(1.湖南省林业科学院 林木无性系育种湖南省重点实验室,湖南 长沙410004; 2.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004; 3.长沙市木本花卉工程技术研究中心,湖南 长沙410004)
紫薇(LagerstroemiaindicaL.)为千屈菜科、紫薇属落叶灌木或小乔木,又名紫金花、百日红等[1],其树姿优美,花繁色艳,且在盛夏开花,是我国重要的夏季观赏树种,深受人们的青睐。目前国内外对紫薇的研究主要集中在种质资源、繁殖技术、新品种选育、花色叶色、病虫害防治、分子标记等方面[2-8],对紫薇花器官发育相关基因研究较少。被子植物花的形成是一个漫长而复杂的过程,受许多基因和代谢途径的影响,发挥主要作用的是MADS-box基因家族的转录因子,通过编码转录因子,结合其他基因的调控区,激活或者抑制受体基因的表达,与各个代谢途径相互影响,形成复杂的调控网络,调控花的形成和分化。目前,MADS-box基因已成为花卉形成和发育研究的热点,其在植物的春化、花序分生组织分化、胚的发育,以及果实成熟等方面发挥着重大的作用,深入研究MADS-box基因家族,具有重大的园艺和农艺应用价值[9-11]。目前,最广泛为人们所接受的调控花器官形成模型是 “ABCDE”模型[12],其中FRUITFULL(FUL)基因是MADS-box基因家族的A类基因,定位于第5条染色体上,并且FUL基因与AP1基因具有很高的相似性,属于同一个亚家族[13]。研究表明,FUL基因在被子植物由营养生长转向生殖生长的过程中发挥作用。在拟南芥中,FUL基因在花原基中大量表达,调控花序分生组织分化和角果的伸长,同时还影响叶片的发育[14-15]。在金鱼草中,FUL同源基因调控心皮壁的分化[16]。水稻中,FUL同源基因OsMADS14表达的部位包括不育器官空颖、外稃、内稃,以及生殖器官雄蕊和心皮[17]。草莓中,FUL同源基因调控果实的成熟[18]。葡萄中,FUL同源基因促进卷须的形成和分化[19]。目前已从牡丹[20]、草莓[18]、油菜[21]、桃花[22]、黄瓜[23]等植物中分离出FUL的同源基因,但是在园林绿化植物紫薇中却鲜有报道。
本研究以湖南省林业科学院培育的紫薇湘韵[24]为材料,采用RT-PCR法获得了紫薇LiFUL1基因的CDS全长序列,对序列进行了生物信息学分析,并进行了原核表达,同时采用实时荧光定量PCR方法探究LiFUL1基因在紫薇湘韵和红叶花器官发育阶段5个不同时期的表达情况。植物的成花受激素的调控,ABA作为一种植物内源激素,在植物成花过程中起诱导作用,有研究表明,ABA与MADS-box基因家族成员AGL21存在负相关关系[25],而ABA与MADS-box基因家族其他基因的相关关系尚未见报道。本实验提取并用HPLC法测定了紫薇花器官发育不同时期花芽内源激素ABA的含量,对内源激素ABA含量与LiFUL1基因的相对表达量做相关性分析,为初步探究ABA激素信号对紫薇LiFUL1基因的影响提供基础数据。
1 材料与方法
1.1 材料
湘韵和红叶2个品种均采自湖南省林业科学院实验基地,采集的样品为紫薇花序顶端的花芽,图1-A画圈区域即为花芽样品采摘部位。分别采集湘韵和红叶花器官发育阶段5个不同时期的花芽,各时期花芽特征见图1-B:第1个时期,花芽分化出花萼,花芽较小,于6月5日采摘;第2个时期,花芽的花瓣、雄蕊已开始分化,于6月9日采摘;第3个时期,花芽处于雄蕊、雌蕊分化期,于6月13日采摘;第4个时期,花芽的雌蕊、雄蕊分化完成,花蕾基本发育成熟,于6月18日采摘;第5个时期,花蕾刚刚开裂,于7月3日采摘。采样均在10:00左右进行,分别从同树龄同品种不同新生花序上摘取适量花芽。液氮速冻,保存于-80 ℃超低温冰箱备用。

A,湘韵花序,画圈区域为花芽样品采摘部位;B,湘韵5个不同时期的花芽。A,Inflorescence of Xiangyun,flower buds for sample collection were pointed out with circle; B,Xiangyun flower buds at different stages.图1 紫薇湘韵的花序与5个不同时期的花芽Fig.1 Inflorescences of crape myrtle Xiangyun and flower buds at five different stages
1.2 方法
1.2.1 总RNA提取
利用植物RNA快速提取试剂盒提取紫薇花芽总RNA。1%琼脂糖凝胶电泳验证RNA完整性,酶标仪测定RNA浓度。
1.2.2LiFUL1基因扩增
取1 μg RNA利用PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒进行反转录;根据转录组数据中FUL1基因的CDS全长序列设计特异引物,上游加入KpnⅠ酶切位点,下游加入EcoRⅠ酶切位点,引物序列为LiFUL1-F:5′-GCCGGGTACCATGGTGAGAGGGAAGACCCAGAT-3′,LiFUL1-R:5′-GCCGGAATTCTCAATTCTGAGGTGGTCGACCTT-3′。以紫薇花芽单链cDNA为模板,用LAtaq进行扩增,终体系为20 μL;扩增程序为:94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,35个循环。扩增产物用胶回收试剂盒回收,然后连接pTOPO克隆载体,转化大肠埃希菌DH5α。进行菌液PCR鉴定,选取PCR阳性克隆菌液送至生工生物工程上海(股份)有限公司进行测序,将所得片段序列在NCBI中进行BLAST比对分析,确定所获得片段是否为目的基因特异片段。
1.2.3LiFUL1生物信息学分析
运用Primer5.0软件将紫薇LiFUL1基因的CDS序列翻译为氨基酸序列,运用ExPASy在线分析软件Protparam(http://www.expasy.ch/tools/protparam. html)预测LiFUL1基因编码蛋白的理化性质;运用ProtScale在线分析软件(http://web.expasy.org/protscale/)分析LiFUL氨基酸的亲疏水性;运用TMHMM2.0 (http://www.cbs.dtu.dk/services/TMHMM/)在线分析软件进行LiFUL1基因编码蛋白的跨膜结构域预测;运用PSORT Prediction在线分析软件(http://psort1.hgc.jp/form.html)进行亚细胞定位;将LiFUL1基因编码的氨基酸序列在NCBI数据库中进行Blastp比对,与其他物种的AP1/FUL基因编码的氨基酸序列通过MEGA-X软件构建系统进化树,进行物种同源性分析。
1.2.4 原核表达载体的构建
将测序正确的pTOPO-LiFUL1重组质粒和pcold载体质粒分别用KpnⅠ和EcoRⅠ进行双酶切,回收酶切片段后,利用T4连接酶16 ℃连接5 h,将连接产物转化大肠埃希菌DH 5α感受态后,均匀涂布在含有100 ng·μL-1氨苄青霉素的LB固体培养基上,37 ℃倒置培养过夜。挑选阳性克隆菌斑送至生工生物工程上海(股份)有限公司进行测序。将测序比对正确的菌种用质粒提取试剂盒提取质粒,转化大肠埃希菌BL21(DE3)菌株进行原核表达。
1.2.5LiFUL1的原核表达与纯化
将含有重组质粒的大肠埃希菌BL21(DE3)阳性克隆振荡培养过夜,菌液以1:50比例稀释到含有100 ng·μL-1氨苄青霉素的液体培养基中,37 ℃培养至D600为0.6左右,加入IPTG至终浓度分别为0、0.4、0.6、0.8 mmol·L-1,然后15 ℃连续培养24 h;离心收集菌体,经1×PBS(pH 7.5)缓冲液重悬,超声破碎,离心取上清,加入蛋白上样缓冲液并煮沸10 min使蛋白变性后,经10% SDS-PAGE电泳检测分析。取上一步诱导表达浓度最高的菌液15 mL,5 000×g离心5 min,弃上清;用His标签蛋白纯化试剂盒纯化含有多聚His-Tag标签的重组蛋白,SDS-PAGE电泳检测纯化情况。
1.2.6LiFUL1基因表达特性分析
为明确LiFUL1基因在花器官分化过程中的时空表达特性,利用荧光定量PCR进行表达量的检测。根据CDS序列设计荧光引物,上游引物LiFUL1-qF:5′-GTCGCACTCATCATCTTCTCCTC-3′,下游引物LiFUL1-qR:5′-TGTTGTTGGCTCCGAGTTCCTT-3′。反应体系为10×SYBR®Premix ExTaqTM10 μL,上下游引物(10 mmol·L-1)各0.3 μL,cDNA模板2 μL,加水补足至20 μL,每个反应体系重复3次。实时PCR扩增程序如下:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环。实时PCR反应均以18S为内参。
1.2.7 ABA的提取和测定
称取1 g紫薇花芽样品,加入液氮充分研磨,加入12 mL 80%的冷甲醇和15 μL抗氧化剂,冰浴超声后过夜浸提12 h,倒出上清液;沉淀再加入5 mL 80%冷甲醇,冰浴超声后浸提4 h,合并2次上清液,10 000×g离心20 min,倒出上清液,加入0.1 g交联聚乙烯吡咯烷酮(PVPP)摇床振荡30 min,10 000×g离心10 min,取上清液,40 ℃旋转蒸发约20 min使甲醇蒸干;再加入2倍体积石油醚萃取3次,取水相,调节pH至2.8~3.0;加入等体积乙酸乙酯萃取3次,合并酯相,40 ℃旋转蒸发至乙酸乙酯完全蒸发,加入1 mL色谱甲醇定容,用0.45 μm滤膜过滤至进样管,ABA提取完成。分别精密吸取10 μL对照品与样品溶液注入液相色谱仪进行测定。测定条件:以V(甲醇)∶V(0.075%冰醋酸)=90∶5为流动相,柱温30 ℃,检测波长为254 nm。
2 结果与分析
2.1 LiFUL1基因的克隆
以紫薇花芽cDNA为模板,通过PCR扩增并经1%琼脂糖凝胶电泳验证,在753 bp处得到特异性条带(图2)。对该序列进行BLAST分析,结果表明,扩增出来的序列与GenBank中已注册的多种植物的FUL/AP1转录因子具有较高的相似性。利用TBtool对其cDNA序列进行分析,结果表明,该基因包含完整的开放阅读框(ORF)序列长度为753 bp,编码251个氨基酸;说明通过克隆已得到该基因的CDS全长序列,将该基因命名为LiFUL1。提交至GenBank,获得基因登录号MN894547。
2.2 LiFUL1生物信息学分析
2.2.1LiFUL1氨基酸序列
LiFUL1基因编码的蛋白分子式为C1222H1987N379O384S10,分子质量为28.453 13 ku,由20种氨基酸组成,其中亮氨酸含量最多,色氨酸含量最少,负电荷残基数(Asp+Glu)为32,正电荷残基总数(Arg+Lys)为37,理论等电点9.05。对蛋白进行亲疏水性分析,结果如图3所示,亲水性区域比例大于疏水性区域,GRAVY为-0.822(<0),预测LiFUL1基因编码蛋白为亲水性蛋白。跨膜软件分析显示,该蛋白不具跨膜结构,也无信号肽。SOPMA预测LiFUL1基因编码蛋白的二级结构如图4所示,该蛋白含有较多的α-螺旋和无规

M,DNA 2 000 marker;1,RT-PCR扩增产物。M,DNA 2 000 marker;1,RT-PCR products.图2 紫薇LiFUL1基因PCR扩增结果Fig.2 PCR amplication results of LiFUL1 gene from crape myrtle
则卷曲,其中α-螺旋(Hh)最多,由140个氨基酸残基组成,占56%;无规则卷曲(Cc)由70个氨基酸残基组成,占30.4%,延伸链(Ee)由24个氨基酸残基组成,占9.6%;β-转角(Tt)由10个氨基酸残基组成,占4%。用SWISS-MODEL预测LiFUL1基因编码蛋白的三维结构模型,结果如图5所示。利用PSORT Prediction对LiFUL1基因编码蛋白进行亚细胞定位预测,结果显示,该蛋白定位在细胞核,这与转录因子调节基因转录的功能相符合。
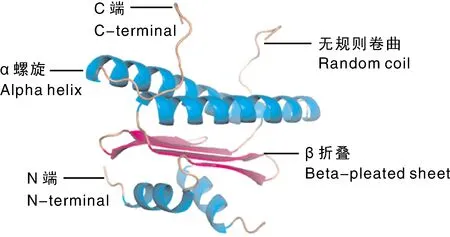
图5 LiFUL1蛋白三级结构预测Fig.5 Prediction of the tertiary structure of LiFUL1
2.2.2LiFUL1编码蛋白的系统进化分析
利用NCBI的Conserved Domains进行预测发现,LiFUL1氨基酸序列含有MADS-box基因家族的2个保守功能结构域,一个是转录因子MADS-box结构域,位于氨基酸残基2-79,另一个是转录因子K-box结构域,位于氨基酸残基84-169,属于MADS基因超级家族(图6-A)。将本研究获得的LiFUL1基因编码的氨基酸序列与其他6种植物的FUL/AP1蛋白进行比对发现,LiFUL1蛋白具有高度保守性,目的氨基酸序列C末端具有保守的euFULmotif(图6-B),由此推断目的基因为FUL同源基因。选择蓝桉、油棕、中华猕猴桃等15个物种的FUL/AP1同源蛋白序列,采用MEGA-X软件的Neighbor-Joining法构建系统进化树,结果表明,紫薇与蓝桉亲缘关系最近,相似度为56%。

分数>0表示疏水性,分数<0表示亲水性。Score>0 represented hydrophobicity,and score<0 represented hydrophilicity.图3 LiFUL1蛋白亲/疏水性预测Fig.3 Prediction of the hydrophobic/hydrophilic property of LiFUL1 protein
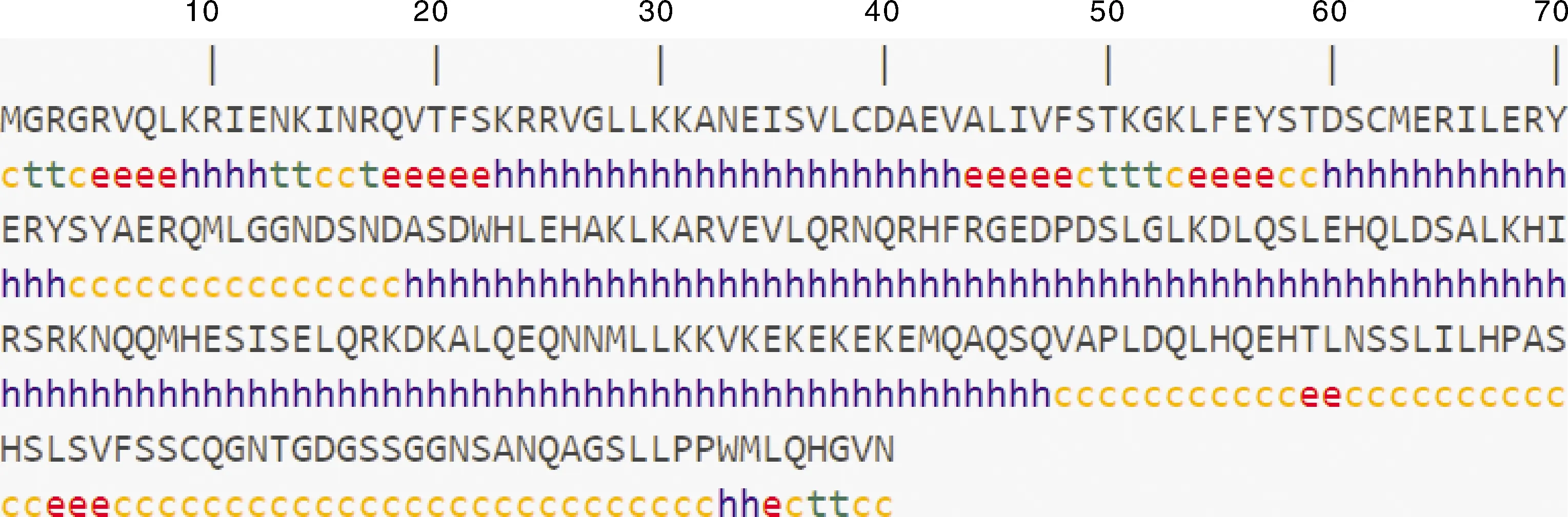
h,α-螺旋;e,延伸链;c,无规则卷曲;t,β-折叠。h,Alpha helix; e,Extended strand; c,Random coil; t,Beta-pleated sheet.图4 LiFUL1蛋白二级结构预测Fig.4 Secondary structure prediction of LiFUL1 protein
2.3 LiFUL1表达与ABA含量的相关性
利用qRT-PCR方法检测LiFUL1基因在湘韵和红叶花器官5个不同发育时期的表达水平,结果如图7-A所示。LiFUL1基因在紫薇不同时期花芽中的表达量明显不同,前4个时期的表达量呈现逐步下降的趋势,第5个时期又升高。湘韵中LiFUL1相对表达量在第1个时期最高,第4个时期最低,前3个时期LiFUL1基因在湘韵中的表达量显著(P<0.05)高于红叶。

A,LiFUL1氨基酸保守结构域预测;B,不同物种FUL蛋白的氨基酸序列对比,从上到下依次是蓝桉、中华猕猴桃、菠菜、白千层、荔枝、毛竹、紫薇,图中藏蓝色表示同源级别为100%,粉色表示同源级别大于75%,浅蓝色表示同源级别大于50%;C,基于不同植物FUL/AP1氨基酸序列构建的系统树。A,Prediction of conserved domain of LiFUL1 amino acid; B,Homology comparison of amino acids sequence of FUL protein among different plants. In the figure,from top to bottom were Eucalyptus globules,Chinese kiwi,spinach,Melaleuca chinensis,lychee,bamboo,crape myrtle. Dark blue indicated that the homology level was 100%,pink indicated that the homology level was greater than 75%,and light blue indicated that the homology level was greater than 50%; C,Phylogenetic tree based on FUL/AP1 amino acid sequences of different plants.图6 LiFUL1编码蛋白的系统进化分析Fig.6 Phylogenetic analysis of LiFUL1 encoding protein

柱上无相同小写字母表示差异显著(P<0.05);Li1~Li5表示紫薇花器官的5个不同发育时期。Data on the bars marked without the same lowercase letter indicated significant difference at P<0.05. Li1-Li5 represented five different developmental stages of crape myrtle flower.图7 紫薇花器官5个不同发育时期的LiFUL1基因相对表达量和ABA含量Fig.7 Relative expression of LiFUL1 gene and ABA content at five different developmental stages of crape myrtle flower
利用HPLC法测定了紫薇花器官5个不同发育时期的ABA含量,结果如图7-B所示。随着花的成熟,湘韵和红叶中ABA的含量均逐渐下降。LiFUL1基因相对表达水平和ABA含量的相关系数(r)为0.3,相关性不显著,推测紫薇内源激素ABA不直接调控LiFUL1基因的激活与表达。
2.4 LiFUL1蛋白原核表达与蛋白纯化
将目的基因与Pcold载体连接,转化大肠埃希菌感受态DH5a并酶切验证,结果见图8-A,重组质粒被切成2个片段,被切下来的片段和目的基因片段的大小一致,证明原核表达载体构建成功。将重组质粒转化大肠埃希菌感受态BL21,预测的目的蛋白分子质量约为28.453 13 ku,由于pCold在N端有一个48.0 ku的分子伴侣TF,因此,融合蛋白的分子质量约为76.45313 ku。10%SDS电泳显示,添加IPTG的培养基中,在66~90 ku处诱导出大量蛋白(图8-B),表明LiFUL1蛋白诱导表达成功。分别添加浓度为0.4、0.6、0.8 mmol·L-1IPTG进行诱导,由图8-B可知,0.4 mmol·L-1IPTG诱导的蛋白最多。多次实验发现,15 ℃连续培养24 h为较合适的培养条件,因此,LiFUL1-TF蛋白适宜的诱导表达条件是0.4 mmol·L-1IPTG,15 ℃连续培养24 h。将0.4 mmol·L-1IPTG诱导的目的蛋白进行纯化,纯化后的目的蛋白分子质量与预测的分子质量基本一致,图8-B中箭头标注的位置就是纯化后的目的蛋白。

A:M1,DNA 2 000 marker;1,Pcold-TF-LiFUL1质粒双酶切。B:M2,蛋白marker;1,无IPTG诱导;2~4,0.4、0.6、0.8 mmol·L-1 IPTG诱导;5,纯化后的LiFUL1融合蛋白A:M1: DNA 2 000 marker; 1: Double digests of pcold-LiFUL1-TF. B:M2: Protain marker; 1: Pcold-TF-LiFUL1 without IPTG induction; 2-4: Pcold-TF-LiFUL1 with 0.4 mmol·L-1 IPTG induction,Pcold-TF-LiFUL1 with 0.6 mmol·L-1 IPTG induction,Pcold-TF-LiFUL1 with 0.8 mmol·L-1 IPTG induction; 5,Purification of LiFUL1 fusion protein.图8 LiFUL1融合蛋白的原核表达与纯化Fig.8 Prokaryotic expression and purification of LiFUL1 fusion protein
3 结论与讨论
本研究从紫薇中克隆了一个成花调控相关基因LiFUL1,氨基酸保守性分析表明,LiFUL1编码的蛋白质含有典型的MEF2-like MADS、K-box结构域,C末端含有保守的euFULmotif,表明LiFUL1属于MADS超级基因家族中的FUL/AP1亚家族。FUL基因在植物的成花转变与果实发育过程中发挥重要作用,如调控拟南芥花序分生组织分化、角果的伸长[14],调控金鱼草心皮壁的分化[16],影响番茄果实的成熟[26]等,因此,推测LiFUL1基因是紫薇成花转变与果实发育过程中的重要转录因子基因。湖南省林业科学院培育的湘韵和红叶紫薇花芽分化过程基本类似,符合常见开花植物花芽分化的过程和方式,但是湘韵紫薇只开花不结实,雌雄性均不可育,雄性不育表现为花药不开裂和花粉败育,雌性不育表现为进入二分体时期以后,胚珠发育停滞[27-28]。本研究结果显示,LiFUL1基因在湘韵花芽的花萼分化时期、花瓣与雄蕊分化时期、雄蕊与雌蕊分化时期的表达量显著高于红叶。初步推断LiFUL1基因在紫薇湘韵花器官发育前3个时期的高水平表达有可能直接或间接阻碍了其正常结实。
矩阵分析结果表明,紫薇内源ABA含量与LiFUL1基因表达量之间无显著相关性,推测内源激素ABA可能不直接参与LiFUL1基因的调控。除此之外,LiFUL1蛋白在大肠埃希菌中成功表达并得到纯化,适宜的诱导表达条件是0.4 mmol·L-1TPTG在15 ℃诱导24 h,目的蛋白以可溶性蛋白的形式存在。利用组氨酸和咪唑竞争性地与Ni2+特异性结合的原理,最后纯化得到目的蛋白,为LiFUL1基因在蛋白水平上的研究提供科学依据。
LiFUL1基因是紫薇MADS基因家族的一员,后续将进行LiFUL1基因启动子克隆,并将启动子转化烟草进行瞬时表达,探究影响LiFUL1基因的表达的多种因素;并将LiFUL1基因转化紫薇幼苗,进行LiFUL1基因的功能验证。
