猪链球菌rpoE基因克隆及生物信息学分析
2020-07-28杜炎斌张港琛王瑜欣刘宝宝宫胜龙
杜炎斌,张港琛,王瑜欣,刘宝宝,宫胜龙,东 笑,汪 洋
(河南科技大学 动物科技学院 洛阳市畜禽分子病原与免疫学重点实验室,河南 洛阳 471003)
猪链球菌是一种重要的人畜共患病原体,严重危害养殖业和人类健康[1]。其中,猪链球菌2型毒力较强,在欧洲、北美洲以及亚洲均有报道,在世界范围内分布广泛[2]。猪链球菌感染动物后,导致机体出现败血症、肺炎及脑膜炎症状,病情严重时突然死亡。人感染猪链球菌后,主要表现为脑膜炎、心内膜炎、听力丧失,严重者可出现中毒休克综合征(STSS)[3]。
rpoE基因编码的RpoE被认为是无乳链球菌等多种原核生物进行环境适应的重要调控因子,当机体处于胁迫状态如温度酸碱等胁迫环境,rpoE通过调控部分基因表达以适应环境变化[4-6]。RpoE蛋白对于维持周质和外膜的蛋白质表达十分重要,并且RpoE具有良好的免疫原性,被认为有成为疫苗的潜力,属于胞质外功能蛋白家族[7-8]。研究表明,牙龈卟啉单胞菌中部分毒力基因表达受rpoE调节[9]。Humphreys等[10]通过实验证实,rpoE基因缺失后沙门氏菌在小鼠模型中定植能力显著下降、毒力降低。此外,有研究表明,rpoE基因与生物被膜形成有关,无乳链球菌ΔrpoE菌株葡聚糖结合蛋白(GbpC)基因表达下调,而GbpC被认为对于生物被膜中胞外多糖基质的形成十分重要[4]。
目前,关于猪链球菌rpoE基因的研究较少,特别是生物信息学方面鲜有报道。因此,本研究利用生物信息学方法对猪链球菌rpoE基因及RpoE蛋白进行系统性分析,以期为相关基因工程疫苗的研发与后续研究rpoE提供参考依据。
1 材料与方法
1.1 猪链球菌rpoE基因克隆
根据猪链球菌ZY05719菌株rpoE基因序列(登录号:AKG39741.1),设计扩增引物,分别为rpoE-F:5′-cccgtgctattttggaagaa-3′和rpoE-R:5′-catgaacgtaagccccattt-3′,引物由上海睿勉生物技术有限公司合成。以猪链球菌基因组为模板对rpoE目的基因进行扩增,扩增产物回收后连接pMD18-T载体,转化至大肠埃希菌DH5α细胞,在含有Amp抗性的平板上进行筛选后,将扩增产物送上海睿勉生物技术有限公司进行测序。
1.2 生物信息学分析
通过ProtParam在线程序(https://web.expasy.org/protparam/)进行RpoE蛋白理化性质分析,包括理论等电点pI、分子质量、稳定性,及半衰期指数等。对RpoE蛋白的保守结构域分析使用NCBI的CDD程序(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);使用TMPred(https://embnet.vital-it.ch/software/TMPRED_form.html)和TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM/)联合分析RpoE的跨膜区域;关于RpoE蛋白是否存在信号肽的预测使用SignalIP(http://www.cbs.dtu.dk/services/SignalP/)进行[11];使用PSORTb程序(https://www.psort.org/psortb/)进行亚细胞定位分析。预测RpoE蛋白N、O两种糖基化及磷酸化位点的存在,同时通过IEDB(http://tools.immuneepitope.org/main/)预测其优势B细胞抗原表位。此外,RpoE蛋白三级结构的预测在SWISS-MODEL程序进行(https://swissmodel.expasy.org/)。最终,通过String(https://string-db.org/)在线程序预测RpoE与其他蛋白互作关系,并结合相关文献分析其调控机制[12]。
2 结果与分析
2.1 rpoE基因克隆
重组质粒pMD18-T-rpoE测序结果表明,rpoE基因全长582 bp。
2.2 RpoE蛋白质的理化性质
Protstparam程序分析认为,rpoE基因编码的RpoE蛋白分子式为C954H1430N240O368S4,由193个氨基酸组成,其中带负电荷氨基酸数比带正电荷数多53个。其理论分子质量为2.227748×104u,理论等电点为3.73。RpoE不稳定指数为53.52,消光系数为24 410,属于不稳定蛋白。RpoE蛋白在体外哺乳动物网织红细胞、酵母和大肠埃希菌体内半衰期大约为30、20和10 h。
2.3 跨膜结构域、信号肽及亚细胞定位
RpoE蛋白的跨膜区使用TMHMM和TMpred联合分析,TMpred与TMHMM分析表明其肽链中不存在跨膜氨基酸,因此,认为RpoE可能是一种胞质蛋白。SingaIP 4.1软件预测结果显示,未发现信号肽。通过PSORTb v3.0程序进行亚细胞定位分析,RpoE最终预测定位在胞质中得分为7.5,综合分析认为RpoE可能属于胞质蛋白。
2.4 糖基化、磷酸化位点及保守结构域分析
通过NetNGlyc 1.0和Netphos 3.1分析RpoE蛋白磷酸化与糖基化位点。结果表明,RpoE蛋白中存在磷酸化丝氨酸位点11个,磷酸化络氨酸位点5个,磷酸化苏氨酸位点2个(图1),序列中不存在糖基化位点。

图1 RpoE磷酸化位点分析Fig.1 Phosphorylation site of RpoE protein
通过NCBI的CDD程序分析,发现RpoE蛋白存在4个保守域结构,分别命名为COG3343、PRK02363、pfam05066和TIGR04567,均属于HARE-HTH超家族成员。
2.5 抗原表位分析
利用IEDB程序进行RpoE蛋白B细胞抗原表位分析。RpoE蛋白表面可及性采用Emini法预测,得分较高区域分别为8-15、24-34、43-52、95-113、140-157和179-189位氨基酸(图2-A)。用Parker法进行蛋白亲水性分析,得分较高区域主要集中在后半段,分别为6-15、24-34、94-123、125-136、139-165和166-193位氨基酸(图2-B)。使用Karplus-Schulz法分析RpoE可塑性,发现前半部分布较均匀,高可塑性区域主要集中靠近C端侧,分别为5-16、23-34、44-55、95-113、124-165和166-179位氨基酸(图2-C)。RpoE蛋白抗原性使用Kolaskar & Tongaonkar在线分析,结果显示,RpoE氨基酸序列平均抗原指数为0.980,抗原指数较高的区域为11-28、51-71、78-90、133-145和184-193位氨基酸(图2-D)。

A,Emini表面可及性预测;B,Parker亲水性预测;C,Karplus & Schulz可塑性预测;D,Kolaskar & Tongaonkar抗原性预测。A,Emini surface accessibility prediction; B,Parker hydrophilicity prediction; C,Karplus & Schulz plasticity prediction; D,Kolaskar & Tongaonkar antigenic prediction.图2 B细胞抗原表位预测Fig.2 B cell antigenic epitope of RpoE protein predicted by IEDB
对RpoE编码肽链表面可及性、亲水性、可塑性和抗原性综合分析,并结合蛋白二级结构特点进行筛选,认为优势B细胞抗原表位大体应满足如下指标,序列位于无规则卷曲区域内,氨基酸数目在5~15,以及表面可及性指数≥1.0,可塑性指数≥1.015,亲水性指数≥3.210,抗原性指数≥0.980,最终筛选出 5个优势B细胞抗原表位,具体序列见表1。
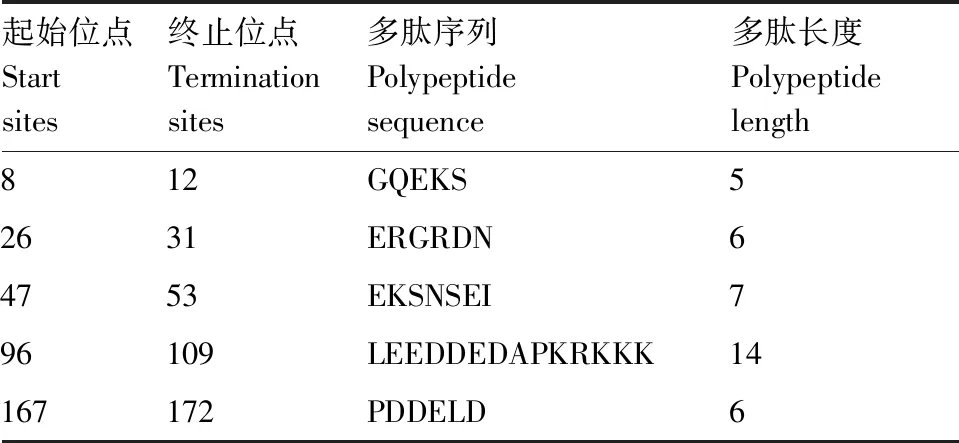
表1 RpoE优势B细胞抗原表位氨基酸序列
2.6 蛋白结构与互作
蛋白二级结构综合分析结果表明,RpoE蛋白中存在108个α-螺旋,占比为52.3%;其余由66个无规则卷曲、7个β-转角和15个延伸链组成,比例分别为36.3%、7.8%、和3.6%。通过SWISS-MODEL软件完成RpoE蛋白三级结构模型的构建(图3-A)。观察到较多的无规则卷曲和α-螺旋,与二级预测结果较一致。但GMQE评价模型可靠性得分为0.3,表明该模型可信度一般。
RpoE与其他蛋白间相互作用关系通过STRING程序进行分析,显示存在10个蛋白与RpoE间存在相互作用(图3-B),其分别为RpoZ、RpoB、RpoA、RpoC、folE、PyrG、PnP、SSU05_2118、SSU05_0839和SSU05_0544。与RpoE相互作用网络相关的生物学通路主要包括RNA代谢及转录、芳香族化合物及其他环状化合物合成过程。

图3 RpoE蛋白三级结构预测(A)及蛋白互作网络分析(B)Fig.3 Tertiary structure prediction (A) and protein interaction network analysis (B) of RpoE protein
3 讨论
猪链球菌对养殖业健康发展造成威胁。目前,主要通过使用抗生素和早期疫苗接种进行猪链球菌病的防控;然而,大量抗生素的使用加剧耐药性的产生,另一方面由于猪链球菌血清型众多,商品化疫苗存在交叉免疫保护效果欠佳的问题[13]。因此,猪链球菌相关疫苗的研究仍不断深入。相关研究表明,使用猪链球菌某些表面毒力因子及相关分泌蛋白作为亚单位疫苗,对于猪链球菌感染具有一定的免疫保护作用。
研究人员通过转录组、蛋白组学实验证明,rpoE基因与无乳链球菌毒力相关,认为其具有一定的研究价值[10,14]。本研究通过生物信息学方法对rpoE基因进行分析,其编码由193个氨基酸组成、理论等电点为3.73的亲水性蛋白,根据结构与生物特性预测结果分析,RpoE为含有存在限制性内切酶HTH结构域的胞质蛋白,一般认为具有该结构域的蛋白在生物体内主要对DNA转录起调控作用[15]。研究人员研究鼠伤寒沙门氏菌转录组发现,RpoE直接或间接调控超过半数以上基因[16]。此外,我们使用IEDB对该蛋白抗原表位进行预测,综合考虑可及性、可塑性、抗原性和亲水性特点,预测其存在5个B细胞抗原表位,认为其能够诱导B细胞产生抗体,具有作为疫苗的潜力。
通过预测发现RpoE上存在较多磷酸化位点,考虑其可能在信号转导中发挥作用,使用String程序分析蛋白互作关系,并结合相关文献分析获知细菌内可能存在多种RpoE调控网络(图4)。rpoE基因上游存在多个启动子,RseA为RpoE的负调控元件,当机体处于胁迫环境时,RseA蛋白水解,最终产生大量RpoE进行应激响应[17]。此外,RpoE还存在另一种调节方式,即鸟苷四磷酸ppGpp与多个小分子RNA的联合调控[18],ppGpp是维持细菌基因组完整的关键分子[19]。特殊环境中,鸟苷四磷酸能够激活rpoE的转录,rpoE一定程度上间接增加CsrB、CsrC的转录,继而减少CsrA翻译(CsrA对rpoE转录起抑制作用),通过一系列反馈调节,RpoE表达增多,从而完成对包膜的损伤修复[20]。
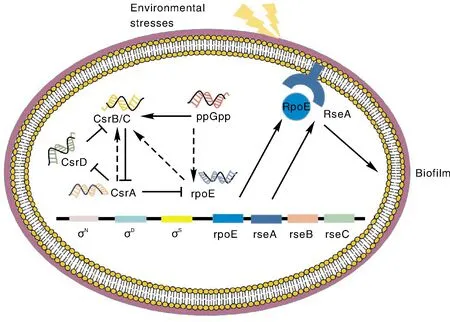
图4 rpoE基因调控示意图Fig.4 Schematic diagram of rpoE gene regulation
本研究成功克隆了猪链球菌rpoE基因,并对编码的RpoE蛋白进行了较全面的生物信息学分析,预测分析了该蛋白的相关结构、生物特性及功能,探究其调控机制并构建相关模式图、预测该蛋白存在5个优势B细胞抗原表位,为进一步研究其功能、调节机制及相关猪链球菌疫苗提供借鉴。
