电化学方法监测氯化胆碱离子液体-乙醇胺混合吸收液吸收CO2
2020-07-27曾国平
黄 青,胡 杨,戴 伟,曾国平,李 杰,吴 田*
(1.湖北第二师范学院材料科学研究院,化学与生命科学学院,湖北武汉 430205;2.武汉大学化学与分子科学学院,湖北武汉 430072; 3.湖北省环境净化材料工程技术研究中心,湖北武汉 430205)
工业高速发展导致地球生态环境正遭到严重破坏,其中“温室效应”的影响最大,最重要的原因是CO2气体在大气中含量的增加。因此,如何有效地吸收捕获CO2己经成为许多国家的战略性研究课题[1]。离子液体(ILs)由于具有较高的热稳定性、较宽的电化学窗口以及可调的溶解能力,作为一种取代传统挥发性有机溶剂的绿色介质而广泛应用于电化学以及分离提纯等领域[2,3]。而且离子液体几乎没有蒸气压,在很宽的温度范围内其比热容只有水的三分之一,同水溶液相比,将其用于酸性气体的捕获具有很多优势[4 - 6]。在CO2等酸性气体捕获方向,可将离子液体进行功能化设计用于增强捕获能力[7]。从降低成本和便捷制备吸收液的角度考虑,也可以在离子液体中加入例如乙醇胺(MEA)等有机碱,因此离子液体与有机碱的结合也成为研究的热点[8 - 12]。这些报道对CO2吸收/解吸过程的监测主要采用热重分析(TGA)或分析天平称重研究体系的质量变化[8,9,11],或者采样进行核磁氢谱分析[9]。
氯化胆碱(ChCl)和乙二醇(EG)形成的低共融溶剂(ChCl-EG -based DES)是一类新型的离子液体,这类离子液体具有价格低廉、粘度较低、合成简便以及适宜大规模生产等优势[13 - 16]。本文研究氯化胆碱离子液体-乙醇胺混合吸收液(ChCl-EG-MEA)吸收CO2性能,并进行了吸收以及解吸过程中的电化学行为研究。ChCl-EG-MEA捕获CO2后,可突破水溶液的电化学窗口限制,将电化学方法作为监测吸收行为及饱和吸收量的重要手段。通过测定液相中吸收产物质子化乙醇胺(MEAH+)浓度变化来研究吸收的方法,不仅有利于研究吸收过程中的反应机理,而且具有测定速度快,测控便捷等特点。
1 实验部分
1.1 仪器及试剂
Chi660A电化学工作站(上海辰华仪器公司);DF-101S集热式磁力搅拌加热器(河南予华仪器有限公司)。
常规离子液体1-丁基-3-甲基咪唑四氟硼酸盐([Bmim]BF4)合成见文献方法[2];乙醇胺(分析纯,国药化学试剂有限公司);CO2钢瓶气体(99.995%,武汉钢铁公司);Ar钢瓶气体(99.999%,武汉钢铁公司)。DZF6020电热真空干燥箱(上海实验仪器总厂)。
1.2 实验条件
1.2.1 氯化胆碱离子液体-乙醇胺混合吸收液称取摩尔比为 1∶2的ChCl和EG放入圆底烧瓶中,装置置于集热式磁力搅拌加热器,80 ℃搅拌下充分混合反应2 h,圆底烧瓶中白色固体逐渐熔化,变浑浊直至变成澄清透明的液体,室温下呈无色粘稠状液体即为离子液体(ChCl-EG)。离子液体使用前80 ℃真空干燥24 h。将ChCl-EG与MEA以摩尔比6∶1配制成混合吸收液(ChCl-EG-MEA)。采用同样条件制备摩尔比为1∶2的ChCl和尿素(Urea)形成的离子液体,将ChCl-Urea与MEA以摩尔比6∶1配制成混合吸收液(ChCl-Urea-MEA)。
1.2.2 CO2吸收及解吸在50 mL的五口电解槽(配备玻璃导气管和玻璃油封,其余各口以缠绕聚四氟乙烯带的橡胶塞密封)中,加入精确称取离子液体,或者离子液体与MEA配制的混合吸收液。体系中常压下通入CO2,集热式磁力加热搅拌器控温。均匀(每秒3~4个气泡)通入CO2气体至液面下一定时间后,再次称重,计算出吸收CO2的质量,计算时扣除液面上方空气被CO2替代导致的增重33.5 mg。解吸实验时,将装置放入真空干燥箱中(80 ℃,10-5atm)进行10 h的升温及减压。
1.2.3 循环伏安测试使用CHI660A电化学工作站进行循环伏安测试,控温为25 ℃。工作电极为直径60 μm的Pt微盘电极;参比电极为双层套管封装的Ag/Ag+电极,制作方法为:将AgNO3溶于乙腈中,使Ag+的理论含量为0.01 mol/L,将银丝插入该溶液作为内层,与外层离子液体ChCl-EG盐桥以氧化铝陶瓷分隔,再将此夹套插入离子液体中;对电极为大面积Pt片电极(6.0 mm×5.5 mm)。打开气阀与含有少量离子液体的电解槽(预先通入Ar气体30 min除去可能溶解的O2)连通,一定时间后进行循环伏安测试。
2 结果与讨论
2.1 IL-MEA溶液吸收CO2后产物的溶解性
MEA在诸多离子液体中可溶,例如水溶性的常规离子液体[Bmim]BF4,以及氯化胆碱离子液体ChCl-EG、ChCl-Urea。上述三种离子液体与MEA(摩尔比6∶1)混合后,室温下通入CO2的光学照片如图1。通入CO2至30 min后,ChCl-EG、ChCl-Urea体系仍旧保持澄清状态。而[Bmim]BF4体系出现白色沉淀,加热并减压后沉淀消失,体系恢复澄清。体系溶解性的差异在于氯化胆碱离子液体体系具有更大的氢键作用,与产物有更强烈的相互作用导致可溶。考虑到ChCl-EG比ChCl-Urea室温下具有更低的粘度[18],有利于加快CO2吸收过程中的传质,更快达到吸收平衡,吸收及电化学测试优先采用ChCl-EG。ChCl-EG-MEA是在室温下采用循环伏安方法研究CO2吸收/解吸的理想体系。

图1 (A)离子液体与MEA混合(摩尔比6∶1);(B)通入CO230 min之后的光学照片Fig.1 (A) ILs mixed with MEA(molar ratio 6∶1);(B) Optical photographs taken after exposure to CO2 for 30 minutes
2.2 ChCl-EG-MEA溶液吸收质量对时间关系
在25 ℃下ChCl-EG-MEA体系中,由CO2吸收量随通气时间的曲线可知吸收较快发生,30 min时已接近平台,此时吸收1.918 mmol CO2。作为比对,我们也检测了25 ℃下ChCl-EG体系中,CO2吸收量随通气时间的曲线,30 min时已接近平台,此时吸收了0.286 mmol CO2,即达到了0.038 mol-CO2/mol-ChCl-EG。考虑到ChCl-EG未加入MEA时对CO2的吸收量也较为显著,计算时扣除掉ChCl-EG-MEA体系中ChCl-EG吸收的一部分CO2,得到体系中MEA的吸收曲线。ChCl-EG-MEA体系在30 min时,其中MEA吸收的CO2为1.632 mmol,即1.295 mol-CO2/mol-MEA。实验结果见图2。该结果显著大于文献报道中的[C3OHmim]BF4-MEA体系对CO2的吸收量[9]。推测反应如下式:
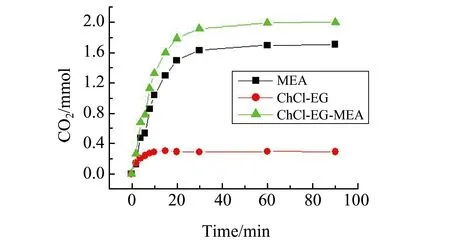
图2 ChCl-EG-MEA混合物(7.57 mmol ChCl-EG;1.26 mmol MEA)以及ChCl-EG(7.57 mmol)中,吸收CO2(1 atm)随通气时间(3~4 bubbles/sec)的变化Fig.2 Absorption of CO2(1 atm) as a function of bubbling time(3 - 4 bubbles/s) in mixtures of ChCl-EG-MEA(7.57 mmol ChCl-EG;1.26 mmol MEA) or ChCl-EG(7.57mmol) as indicatedThe data indicated by and symbols are obtained by experiments,and the data indicated by symbols are obtained by calculation.
(1)
根据反应式(1),理论上每摩尔MEA对CO2的吸收量最大为1 mol,实验结果略高于该数值。可能MEA的加入,通过化学反应增强了吸收液吸收CO2的稳定性,MEA促进了作为溶剂的ChCl-EG对CO2的吸收量的提升。
2.3 CO2在ChCl-EG-MEA溶液中的循环伏安行为
为了进一步监测吸收过程中的体系状态,以及验证反应式(1)中产物MEAH+的生成,我们研究了Ar气氛围下ChCl-EG加入MEA前后,以及通入CO2后的循环伏安行为。图3(a)虚线为室温下Ar气体饱和的ChCl-EG的循环伏安曲线(工作电极为Pt微盘电极,扫速100 mV/s,电势范围-1.5~0.7 V)。该体系具有约2.1 V的电化学窗口,负向窗口较宽,并且在扫描区间内无明显的杂质峰,合成得到的ChCl-EG满足电化学测试的要求。在Ar气氛围下7.57 mmol ChCl-EG中加入1.26 mmol MEA后,阳极窗口的起峰电势有所提前,与加入的MEA的电化学氧化有关。而阴极窗口基本保持不变,即便加入MEA后,阴极区也具有良好的电化学稳定性。7.57 mmol ChCl-EG中加入1.26 mmol MEA,Ar气饱和后通入CO2,测试不同通气时间下的循环伏安行为,如图3(b)。将还原峰电流对通气时间作图,如3(b)内插图所示。ChCl-EG体系的粘度在室温下仅为20 cP[17],显著低于室温下绝大多数常规离子液体的粘度[2]。该体系吸收CO2极为迅速,在5 min达到较大的还原电流,10 min时电流密度已经接近30 min时的结果。
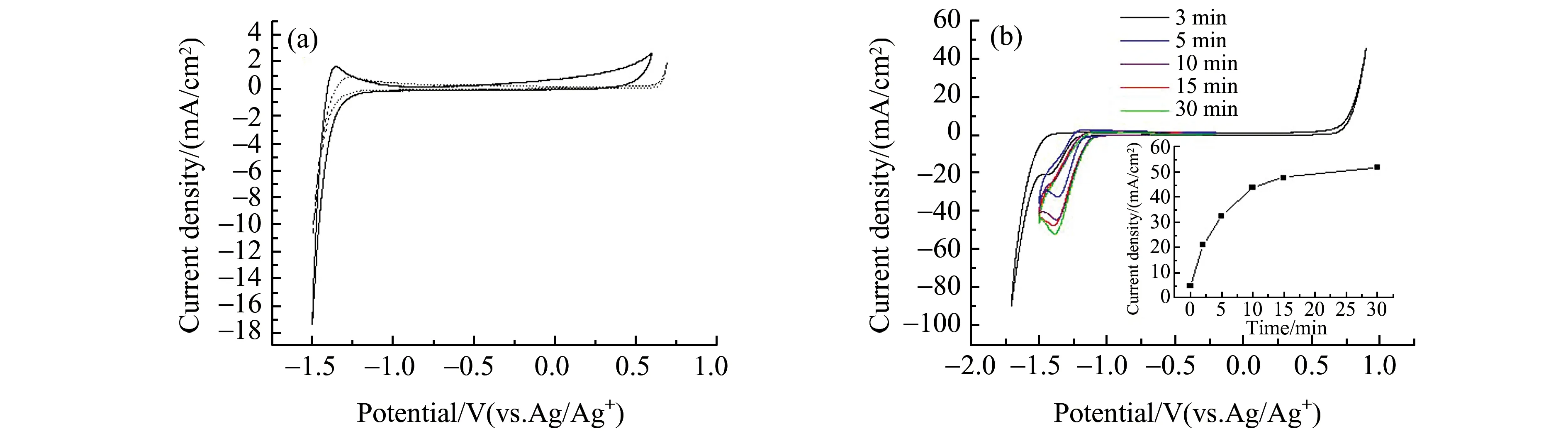
图3 (a) Ar气氛围及25 ℃下7.57 mmol ChCl-EG中加入1.26 mmol MEA前后的循环伏安图;(b) 25 ℃ ChCl-EG-MEA(1.26 mmol MEA;7.57 mmol ChCl-EG)通入CO2(3~4 bubbles/s)不同时间下的循环伏安图(插图为峰电流对通气时间的关系)Fig.3 (a) CVs recorded in the 7.57 mmol ChCl-EG electrolyte before or after adding 1.26 mmol MEA at Ar atmosphere and 25 ℃;(b) CVs recorded in the ChCl/EG-MEA electrolyte after bubbling CO2 at different time(Inset illustration:a plot of the peak current in(b) against the bubbling CO2 at different time)
根据反应式(1)的产物以及文献报道的MEAH+的电化学还原行为[9],我们推断体系中发生了相同的还原反应,过程如下:

(2)
可见循环伏安方法能够快速检测体系的MEAH+,通过MEAH+判定反应(1)达到平衡的时间以及吸收过程中的体系状态。
2.4 解吸行为
吸收CO2的体系可以通过升温、减压、酸化达到CO2解吸的目的。进一步利用的方法有将其作为有机合成的碳源,例如进行羧化反应,或者将CO2进行电还原加以利用[18]。CO2解吸之后也有利于吸收液循环利用。对于离子液体-有机胺溶液,CO2后续解吸处理的方式主要是升温[8,11]或者升温结合减压[9]。与吸收行为的研究方法一样,在离子液体-有机胺溶液中进行CO2解吸,主要分析体系质量变化[8,9,11]及核磁氢谱[9]。质量分析方法与电化学分析方法同样便捷,但要求离子液体-有机胺溶液不存在微量挥发性杂质,并且吸收液本身在解吸过程中不挥发,解吸过程中质量的减轻完全由CO2的挥发所导致[9]。而电化学分析方法,检测的是具有电化学活性物质的特征峰,解吸过程中即便吸收液中存在其它微量挥发性杂质或者吸收液本身的少量挥发,对特征峰的电化学行为影响相对较小。我们通过循环伏安技术研究了ChCl-EG-MEA体系通入CO2后在减压和升温条件下的解吸行为。
ChCl-EG -MEA体系通入CO2达到饱和后,我们首先考察室温下减压对体系解吸的作用。25 ℃通入Ar气达到CO2减压作用的目的,记录不同通气时间下的循环伏安行为(图4(a))。通气10 min后峰电流降低程度并不显著,20 min和30 min时MEAH+的还原峰电流已发生了显著降低。为考察进一步减压后MEAH+还原峰的降低程度,将上述已通入Ar气30 min后的电解槽置于真空干燥箱(25 ℃,10-5atm),2 h 后取出,记录MEAH+的循环伏安行为,其峰电流接近通入Ar气30 min后的峰电流。减压前后的称重也表明体系质量基本未发生变化(减压后称重增加0.2 mg)。可见25 ℃下通入Ar气30 min可以实现体系中部分CO2解吸,其解吸作用与进一步在该温度下真空放置(10-5atm)减压2 h的效果相当。减压过程即反应(1)逆向进行,部分CO2从体系中解吸,MEAH+含量降低,导致MEAH+还原峰电流减小。
为进一步实现CO2的解吸,我们采取了升温的方式,将CO2达到饱和的ChCl-EG-MEA吸收装置放入真空干燥箱(80 ℃,10-5atm)10 h后,降温到室温。采用循环伏安方法即可便捷快速检测体系中的MEAH+,以监测体系中CO2的解吸情况。图4(b)结果表明MEAH+的还原峰位置未发生显著移动,峰电流显著减小。从峰电流判断,该条件下的解吸程度明显大于图4(a)中所示的通入Ar气30 min后的解吸程度。经过10 h 80 ℃条件下的真空解吸后,大部分CO2已经从体系中逸出,可见在该条件下可实现离子液体的回收利用。
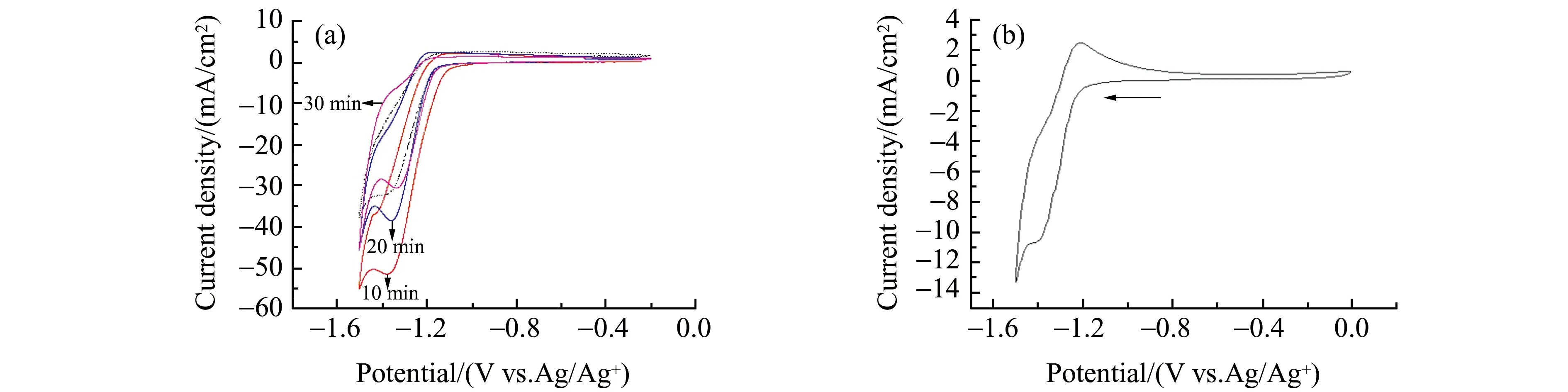
图4 在25 ℃下ChCl-EG-MEA(1.26 mmol MEA,7.57 mmol ChCl-EG)通入CO2(3~4 bubbles/sec)达到饱和后:(a)在25 ℃通入Ar气进行减压,不同通气时间的循环伏安图(实线),以及继续真空条件下减压的循环伏安图(虚线);(b) 在升温减压(80 ℃,10-5 atm)10 h后,降温到室温下的循环伏安图Fig.4 ChCl-EG-MEA electrolyte after saturated with CO2,and then (a) CVs recorded after bubbling Ar at different time at 25 ℃ and after vacuum(25 ℃,10-5 atm) for 2 hours;(b) CVs recorded after vacuum heating(80 ℃,10-5 atm) for 10 hours
3 结论
研究了ChCl-EG -MEA混合吸收液(摩尔比6∶1)吸收CO2性能及解吸行为,通过循环伏安技术监测吸收产物MEAH+的电化学行为,该溶液对CO2吸收极为迅速并且对CO2有较大吸收容量。80 ℃真空条件下的解吸后的MEAH+的循环伏安行为表明,该条件下可实现离子液体的回收利用。通过测定液相中MEAH+浓度变化来研究吸收的方法不仅有利于研究吸收过程中的反应机理,而且具有测定速度快,测控便捷等特点。
