CYP2U1基因沉默对人膀胱癌J82细胞增殖、凋亡、迁移能力的影响
2020-07-27赵小磊赵振华常俊锴李松
赵小磊 赵振华 常俊锴 李松
河南大学淮河医院泌尿外科(河南开封475000)
早期膀胱癌手术治疗预后较好,但对于已发生临床转移者手术治疗预后并不理想[1-2]。研究[3]表明,致癌物质代谢酶的基因多态性是决定个体癌症遗传易感性的重要因素。细胞色素P450(cytochrome P450,CYP)是肿瘤形成和治疗中的关键酶,其家族成员可介导癌物质的代谢活化[4-6]。CYP2U1 是CYP 家族成员,研究[7]证实CYP2U1 在膀胱癌发病过程中有重要调控作用,但具体机制仍未明确。故本研究重点分析CYP家族成员CYP2U1基因沉默对人膀胱癌J82 细胞增殖、凋亡、迁移能力的影响。
1 材料与方法
1.1 材料人膀胱癌J82 细胞株,购自南京科佰生物科技有限公司。
1.2 试剂与仪器逆转录试剂盒(上海闪晶分子生物科技有限公司),脂质体转染试剂LipofectamineTM2000[贝克曼库尔特商贸(中国)有限公司],siRNA 片段(上海吉玛制药技术有限公司),HER标记的羊抗鼠IgG(南京亿迅生物科技有限公司),鼠抗兔GAPDH 单克隆抗体(上海信帆生物科技有限公司),BCA 蛋白试剂盒,p53、B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)、半胖氨酸蛋白酶3(cysteinyl aspartate specific proteinase-3,caspase-3)多抗(武汉云克隆科技股份有限公司)。
1.3 方法
1.3.1 细胞转染与分组设计靶向人CYP2U1 的siRNA 序列,正义链:5′-AGTCATAGGATGGTATATCGTTAC-3′;反义链:5′-TCTACCGGTCTAAGATGTAGATGC-3′,无关通用序列为阴性对照siRNA(NC siRNA)序列。对数生长期人膀胱癌J82 细胞,重新接种生长至融合率80%时,严格按照LipofectamineTM2000 脂质体法转染说明书要求进行。将转染pGenesil-1-CYP2U1-siRNA、NC siRNA 质粒的细胞分别命名为干预组、对照组,未经处理细胞株为空白组。
1.3.2 CYP2U1、p53、Bcl-2、caspase-3 mRNA 和蛋白表达检测取转染48 h 后细胞,提取细胞总RNA,逆转录合成cRNA,以RT-PCR 法进行检测。PCR 反应条件:95 ℃30 s,95 ℃15 s,60 ℃20 s,70 ℃10 s 重复40 个循环。Image J 软件分析条带灰度值,以GAPDH 为管家基因,2-△△CT为目的基因相对表达强度。引物序列:CYP2U1:F:5′-ACATGGTAGTTAGGCATGCAAT-3′,R:5′-CGGTAGCATGAACTAGCATCGA-3′;p53:F:5′-TTAGGCTTACGCTTATCGGATA-3′,R:5′-TGAGCTTATCAATCTCGTGTTG-3′;Bcl-2:F:5′-CTACTTCGGATGATGAGGTCAG-3′,R:5′-ATTCGTAGTTCGATTATCGCCCT-3′;caspase-3:F:5′-GATCGTACGAGGTTGAGTGCCG-3′,R:5′-CATGTAGCAGTAGCAGTAGTTCG-3′;GAPDH:F:5′-ATACGTCCGCAGTTCCGAATTA-3′,R:5′-CATAATGCTATGGCCGTCGATAT-3′。
取转染48 h 后各组细胞,BCA 法检测蛋白浓度,一抗为CYP2U1、p53、Bcl-2、caspase-3 及HRP 标记的二抗,经温育、洗涤、显色后观察结果。Image J 软件分析条带灰度值,以目的蛋白灰度值/GAPDH 的灰度值为蛋白表达量。
1.3.3 细胞增殖能力检测取稳定转染细胞和对照组细胞,以0.25%胰蛋白酶消化后,调整浓度为2×103/孔,接种于96孔板,每组5个复孔,分别在培养24、48、72 h 时加入MTT 溶液20 μL(5 mg/mL)混匀,继续培养4 h,弃上层清液,加入150 μL DMSO待充分溶解后,以酶标仪检测各孔490 nm 波长处吸光度值(OD)。
1.3.4 细胞迁移能力检测取对数生长期细胞,以2 × 103/孔密度接种6 孔板,各组细胞贴壁生长后,弃培养基,以10 μL 移液枪头在培养板中划直线,PBS 轻柔洗涤去除边缘细胞碎片,每孔加入2 mL 无胎牛血清DMEM 培养液,24 h 后倒置显微镜下观察细胞迁移情况。迁移率(%)=(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度×100%。
1.3.5 细胞凋亡情况检测取对数生长期细胞,以2×103/孔密度接种于6孔板,加入无DMEM 培养基,孵育24 h 后离心,PBS 洗涤2 次,避光加5 μL Annexin V-FITC 及PI,1 h 内以流式细胞仪检测。
1.4 统计学方法采用SPSS 24.0 统计软件,以描述计量资料,多样本计量资料比较采用单因素方差分析,两两样本比较采用SNK-q检验。P<0.05差异统计学意义。
2 结果
2.1 转染后CYP2U1 mRNA 及蛋白表达与空白组和对照组比较,干预组的CYP2U1 mRNA 及蛋白相对表达量均降低(P<0.05)。见表1。
表1 转染后CYP2U1 mRNA 及蛋白相对表达量Tab.1 The expressions of CYP2U1 mRNA and protein after transfection ±s
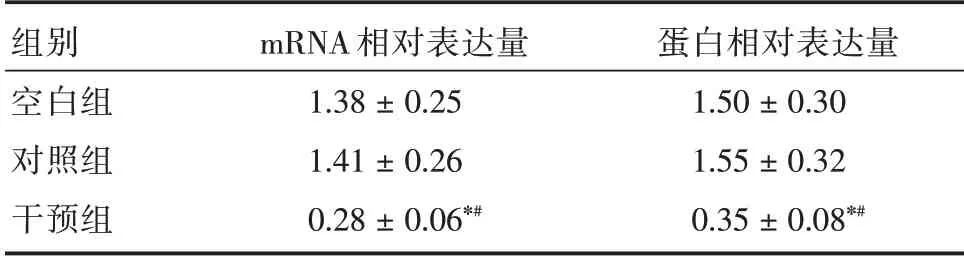
表1 转染后CYP2U1 mRNA 及蛋白相对表达量Tab.1 The expressions of CYP2U1 mRNA and protein after transfection ±s
注:与空白组比,*P<0.05;与对照组比,#P<0.05
组别空白组对照组干预组mRNA 相对表达量1.38±0.25 1.41±0.26 0.28±0.06*#蛋白相对表达量1.50±0.30 1.55±0.32 0.35±0.08*#
2.2 细胞增殖情况3 组OD值均随时间延长呈升高趋势(P<0.05);与空白组和对照组比较,干预组不同时刻OD值更高(P<0.05)。见表2。
表2 细胞增殖情况Tab.2 Cell proliferation ±s
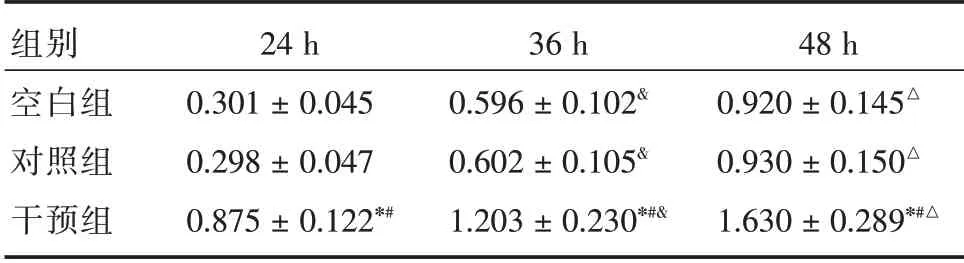
表2 细胞增殖情况Tab.2 Cell proliferation ±s
注:与空白组比,*P<0.05;与对照组比,#P<0.05;与24 h 比,&P<0.05;与36 h 比,△P<0.05
组别空白组对照组干预组24 h 0.301±0.045 0.298±0.047 0.875±0.122*#36 h 0.596±0.102&0.602±0.105&1.203±0.230*#&48 h 0.920±0.145△0.930±0.150△1.630±0.289*#△
2.3 细胞迁移情况空白组、对照组、干预组迁移率分别为(32.30±6.32)%、(33.01±6.50)%、(78.36± 10.02)%;与空白组和对照组比较,干预组迁移率更高(q=8.694、8.490,P<0.001)。见图1。
2.4 细胞凋亡情况空白组、对照组、干预组凋亡率分别为(25.32 ± 5.01)%、(26.48 ± 5.89)%、(9.36± 2.03)%;与空白组和对照组比较,干预组凋亡率更低(q=6.602、6.145,P<0.001)。见图2。
2.5 细胞p53、Bcl-2、caspase-3 mRNA 表达与空白组和对照组比较,干预组p53、caspase-3 mRNA相对表达量均降低,Bcl-2 mRNA 相对表达量均升高,差异均有统计学意义(P<0.05)。见表3。
2.6 细胞p53、Bcl-2、caspase-3 蛋白表达与空白组和对照组比较,干预组p53、caspase-3蛋白相对表达量均降低,Bcl-2蛋白相对表达量升高(P<0.05)。见表4、图3。
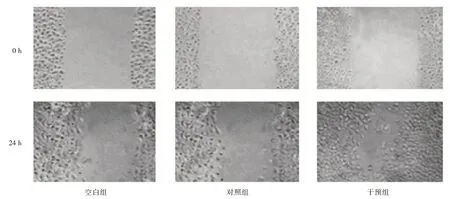
图1 划痕试验(×100)Fig.1 Scratch test(×100)
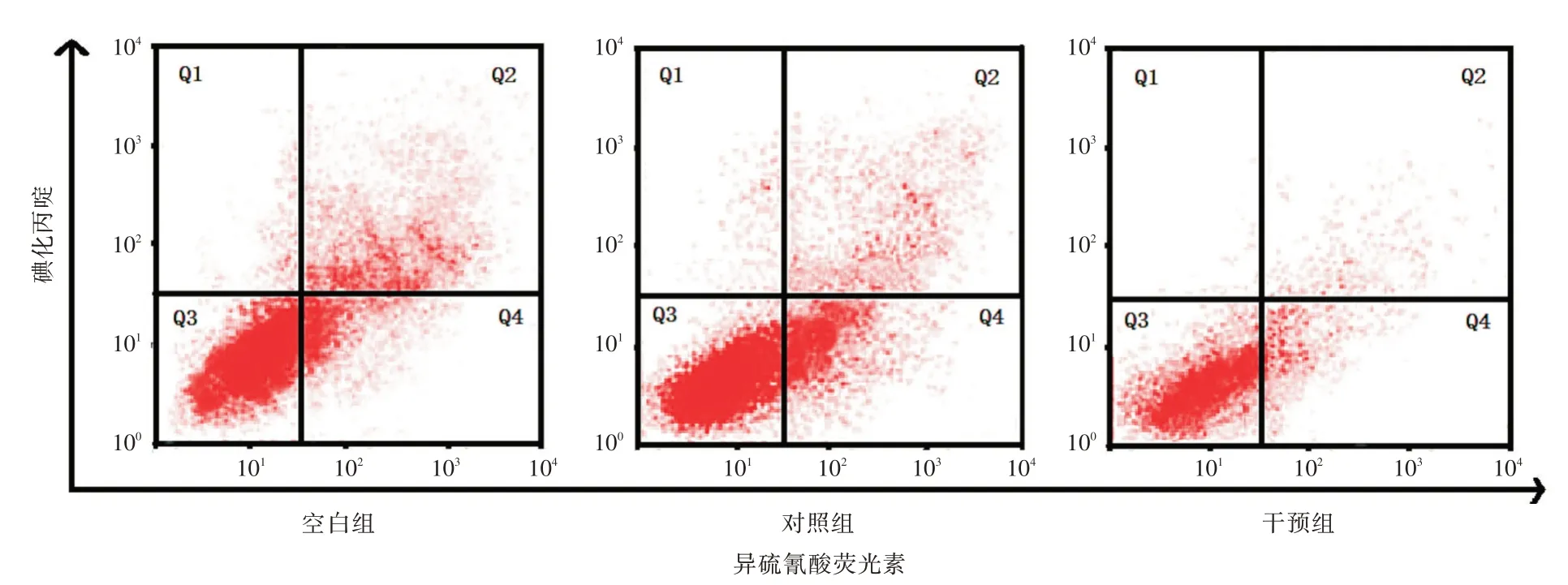
图2 各组细胞凋亡情况Fig.2 Apoptosis of each group
表3 细胞p53、Bcl-2、caspase-3 mRNA 表达情况Tab.3 p53,Bcl-2,caspase-3 mRNA expression of J82 cells ±s
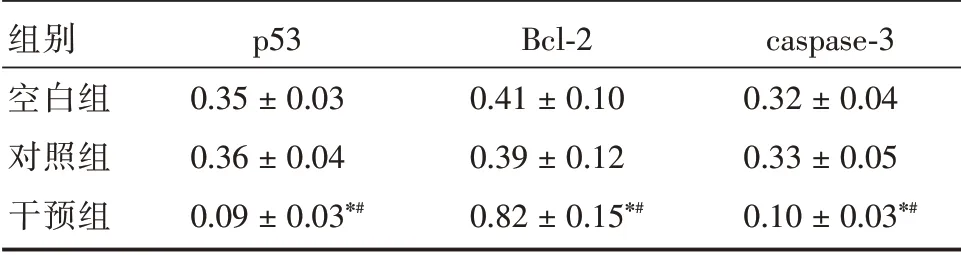
表3 细胞p53、Bcl-2、caspase-3 mRNA 表达情况Tab.3 p53,Bcl-2,caspase-3 mRNA expression of J82 cells ±s
注:与空白组比,*P<0.05;与对照组比,#P<0.05
组别空白组对照组干预组p53 0.35±0.03 0.36±0.04 0.09±0.03*#Bcl-2 0.41±0.10 0.39±0.12 0.82±0.15*#caspase-3 0.32±0.04 0.33±0.05 0.10±0.03*#
3 讨论
膀胱癌的病因仍未完全明确[8-9],且因膀胱癌具有易复发、转移的特点,外科手术治疗的效果不甚满意[10-11]。肿瘤的发生、发展与原癌基因的激活、抑癌基因和凋亡基因的失活或功能的改变等有关,因此了解相关基因调控机制对于肿瘤分子靶向治疗有重要意义。
表4 细胞p53、Bcl-2、caspase-3 蛋白表达Tab.4 p53,Bcl-2,and caspase-3 protein expressions of J82 cells ±s
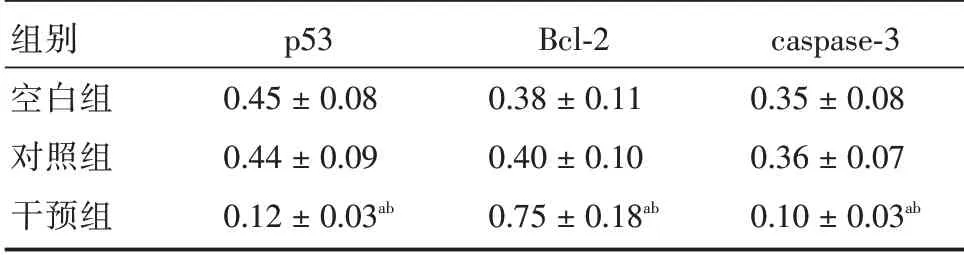
表4 细胞p53、Bcl-2、caspase-3 蛋白表达Tab.4 p53,Bcl-2,and caspase-3 protein expressions of J82 cells ±s
注:与空白组比,*P<0.05;与对照组比,#P<0.05
组别空白组对照组干预组p53 0.45±0.08 0.44±0.09 0.12±0.03ab Bcl-2 0.38±0.11 0.40±0.10 0.75±0.18ab caspase-3 0.35±0.08 0.36±0.07 0.10±0.03ab
本研究结果显示,干预组人膀胱癌J82 细胞MTT 试验OD值和迁移率升高,凋亡率降低,提示CYP2U1 表达降低与膀胱癌的发生有关,与张冲等[12]观点一致。CYP450 在多种内源性化合物、药物的氧化、还原等机体代谢中有重要作用[13]。徐蓉等[14]研究发现,CYP1A1、CYP3A5 基因突变可影响转移性结直肠癌患者的治疗效果和生存期,可用于临床疗效和预后预测评估。GUO 等[15]认为,CYP450 家族成员介导生物合成的花生四烯酸环氧化物参与肿瘤血管的生成,但CYPs 在癌症发展中的作用仍未明确。
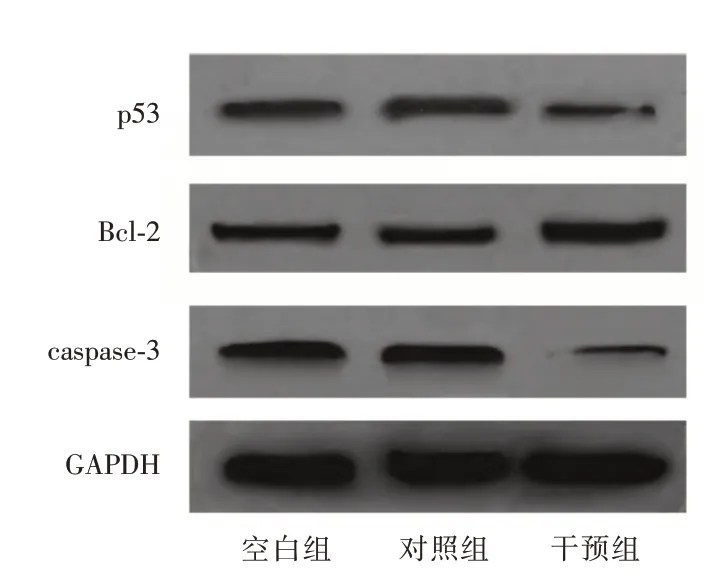
图3 各组蛋白免疫印迹图Fig.3 Western blot of each group of proteins
本研究中,干预组的p53、caspase-3 表达量降低,Bcl-2 表达量均升高,提示沉默CYP2U1 基因可抑制p53、caspase-3 的表达和促进Bcl-2 的表达。p53 属于人体中的抑癌基因,可启动细胞凋亡过程,诱导细胞自杀[16-17]。Bcl-2能抑制多种细胞毒素引起的细胞死亡,从而抑制化疗药物造成的靶细胞凋亡[18-19]。研究[20]证实,Bcl-2 可抑制p53 介导的细胞凋亡。caspase-3 作为细胞凋亡的关键酶,其异常表达与膀胱癌的发生有关,可作为预后判断的生物指标[21-22]。故推断,CYP2U1 基因沉默可能通过抑制p53、caspase-3 表达和促进Bcl-2 表达,从而促进膀胱癌的增殖、迁移,抑制其凋亡。
综上所述,沉默CYP2U1 mRNA 能促进膀胱癌的增殖和迁移,抑制其凋亡,其机制可能与下调p53、caspase-3 基因与蛋白的表达,上调Bcl-2 基因与蛋白的表达有关,但无法确定是否存在其他调控通路发挥促增殖、迁移和抑制凋亡的作用,在今后的研究中需进一步明确其他通路。
