基于Nrf2/HO-1通路探讨石参有效成分对鱼藤酮诱导的帕金森病细胞模型的保护作用
2020-07-27赵燕芬吴伟斌梁结斐梁少明刘文华
赵燕芬 吴伟斌 梁结斐 梁少明 刘文华
1肇庆医学高等专科学校药理教研室(广东肇庆526020);2肇庆学院生命科学学院生物科学教研室(广东肇庆526020)
帕金森病(Parkinson′s disease,PD)是一种以运动迟缓、强直、震颤为主要症状,好发于65~70 岁的一种中枢退行性疾病[1]。据中国帕金森联盟及国内外研究显示,我国65岁及以上居民帕金森病发病率约为1.7%,且每年以10 万人的速度增加。且随着我国人口老龄化的加剧,到了2030年,我国帕金森病患者约有500 万,将占据全球患者的半数[2]。面对如此严峻的形势,从天然植物中寻找有效易得的成分对帕金森病进行有效的预防及治疗[3],具有一定的意义。
研究表明[4],2 型糖尿病与帕金森病在流行病学、发病机制及治疗学上有较多的共同之处。如2 型糖尿病和帕金森病的发病过程中分别在胰腺B 细胞和脑细胞中发生了蛋白质错误折叠,分别由胰岛淀粉样多肽和α-突触蛋白形成,最终诱发了一系列后续的病变[5]。而蛋白错误折叠与细胞内内质网应激、氧化应激及慢性炎症等2 型糖尿病及帕金森病常见诱因密切相关[6],这说明了帕金森病与2 型糖尿病的治疗有一定的互通之处。
石参,豆科猫尾草(Uraria crinite)的干燥根,具有一定的抗糖尿病活性[7],且富含黄酮及皂苷等活性物质[8],其中黄酮类物质中所含有的水飞蓟宾[9],已被证明能通过抑制氧化应激及TLR4 介导的炎症反应等机制,对2 型糖尿病及帕金森病具有一定的治疗作用[10]。因此本研究将利用鱼藤酮诱导人神经母细胞瘤细胞SH-SY5Y 建立帕金森病体外模型[11],以探讨石参提取物对帕金森病的治疗作用及其可能的机制。
1 材料与方法
1.1 材料与试剂人神经母细胞瘤细胞SH-SY5Y,购自中国科学院细胞库;RPMI 1640 培养基(美国Hyclone 公司);PBS 缓冲液(美国Hyclone 公司);胰酶(美国Gibco 公司);DMSO(美国Thermo Fisher 公司);PVDF 膜(美国millipore 公司)、胎牛血清(浙江天杭生物科技股份有限公司)、鱼藤酮、TBST with Tween 20 即用型干粉(上海麦克林生化科技有限公司);石参根(广东省梅州市梅县);CCK-8试剂盒、依达拉奉(美国MedChem Express 公司);活性氧检测试剂盒、总超氧化物歧化酶(SOD)活性检测试剂盒、脂质过氧化(MDA)检测试剂盒、总谷胱甘肽(GSH)检测试剂盒、谷胱甘肽过氧化物酶(GPx)检测试剂盒、BCA 蛋白浓度测定试剂盒(增强型)、Western 及IP 细胞裂解液、蛋白酶磷酸酶抑制剂混合物、SDS-PAGE 蛋白上样缓冲液(5X)、SDS-PAGE 凝胶快速配制试剂盒、电泳液、转膜液、PVDF 膜浸润活化液、彩色预染蛋白质分子量标准、BSA 干粉、特超敏ECL 化学发光试剂盒(上海碧云天生物科技有限公司);HO-1、Nrf2、β-actin 抗体、HRP 标记的山羊抗兔IgG 二抗(货号:AF5393,AF0639,AF7018,S0001,常州Affinity Biosciences 公司)。
1.2 石参水提物、总黄酮及总皂苷提取本研究参考文献[12]进行有效部位的提取,分别使用去离子水提取水提物、50%乙醇水溶液提取总黄酮和80%乙醇水溶液提取后用饱和正丁醇萃取总皂苷,然后减压浓缩后冻干获得各有效成分的冻干粉。
1.3 SH-SY5Y 细胞PD 模型的构建本研究参考文献[13]调整,利用CCK-8 法检测0~20 μmol/L 鱼藤酮孵育24 h及10 μmol/L鱼藤酮孵育0~24 h后细胞活力的变化,再利用DCFH-DA 法检测10 μmol/L 鱼藤酮孵育0~6 h 后细胞内活性氧的变化,综合两项指标数据后,最终以10 μmol/L 鱼藤酮诱导6 h建立活性氧显著升高的非损伤性氧化应激模型,诱导24 h 建立细胞活力显著下降的损伤模型。
1.4 CCK-8 法检测细胞活力SH-SY5Y 细胞以1×103/孔接种于96孔板中,每组6个复孔,12 h后,0~100 μmol/L的依达拉奉(Eda)溶液、0~200 μg/mL的石参水提物(WE)、石参总黄酮(FL)及石参总皂苷(SO)溶液,或按对照(Cont)组/Rot 组/Eda 组/WE组/FL 组/SO 组的分组换入相应的溶液,培养24 h后,每孔更换为基础培养基配置的CCK-8 溶液,培养箱中继续孵育30 min,用酶标仪以450 nm 为检测波长,620 nm 为参考波长检测各孔吸光度,最终以ΔA=A450-A620为各检测孔读数。
1.5 细胞内SOD、MDA、GSH、GSH-Px 等抗氧化相关指标测定SH-SY5Y 细胞以1×105/孔接种于6 孔板中,12 h 后按前法进行分组给药,继续培养6 h 后收集所有细胞,然后按照试剂盒要求对细胞进行处理后检测SOD、MDA、GSH、GSH-Px 等指标。
1.6 DCFH-DA 法检测细胞内活性氧含量SHSY5Y 细胞以1 × 105/孔接种于6 孔板中,12 h 后进行分组给药,继续培养6 h 后,以1 000 r/min 进行甩板5 min 后,吸弃上清,按活性氧检测试剂盒要求进行检测。
1.7 Western blot 法检测细胞内HO-1、Nrf2 蛋白含量SH-SY5Y 细胞以1×105/孔接种于6孔板中,12 h 后按前法进行分组给药,继续培养6 h 后,利用试剂盒提取总蛋白并定量。均一化样品蛋白浓度后利用凝胶电泳分离样品,接着湿法转膜后以5% BSA 溶液封闭1 h,然后在4℃下孵育一抗(1∶1 000)过夜。孵育后用TBST 洗膜4 次,接着在37℃下孵育二抗(1∶5 000)45 min,之后再洗膜4 次,最后利用ECL 发光液和凝胶成像系统对蛋白条带进行显影并收集图像,各蛋白的相对表达量通过待测蛋白/内参蛋白的比值进行表示。
1.8 统计学方法采用imageJ 进行荧光强度及蛋白印迹的半定量分析,数据采用SPSS 25.0 软件进行统计学分析并采用GraphPad 软件进行图表制作,各组间利用单因素方差分析进行差异分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 依达拉奉、石参水提物、石参总黄酮、石参总皂苷对SH-SY5Y 细胞活力的影响见图1。药物干预24 h 后,依达拉奉(Eda)在50 μmol/L、石参水提物(WE)在200 μg/mL、石参总黄酮(FL)在100 μg/mL、石参总皂苷(SO)在50 μg/mL 均可使SH-SY5Y 细胞活力显著下降。后续研究中将使用25 μmol/L 的依达拉奉、100 μg/mL 的石参水提物、50 μg/mL 的石参总黄酮、25 μg/mL 的石参总黄酮作为给药剂量。
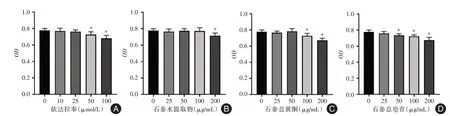
图1 不同浓度的药物对SH-SY5Y 细胞的细胞活力的影响Fig.1 The effects of different concentrations of drugs on the cell viability of SH-SY5Y
2.2 石参提取物对PD 细胞模型的保护作用见图2。各给药组均能有效的对抗鱼藤酮所引起的神经细胞损伤,其中以石参水提物的作用最佳,且石参各提取物均表现出不弱于25 μmol/L 依达拉奉的保护能力。
2.3 石参提取物对PD 细胞模型细胞内活性氧含量的影响见图3。鱼藤酮诱导6 h 后,SH-SY5Y细胞内荧光强度明显增强,而各给药组细胞内荧光强度均减弱,说明鱼藤酮干预细胞6 h 后能有效升高细胞内活性氧含量,而各给药组均能逆转这种变化。通过半定量数据可知,各给药组均能显著减少鱼藤酮所引起的活性氧增加,而与25 μmol/L 依达拉奉相比,石参水提物及总黄酮效果更优(图4)。
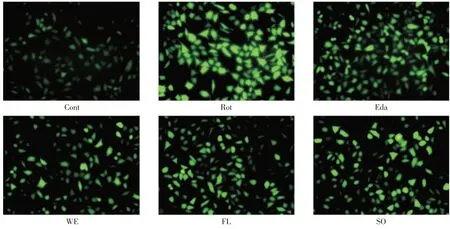
图3 药物对PD 细胞模型的细胞内活性氧含量的影响Fig.3 The effects of drugs on intracellular ROS in a cellular PD model
2.4 石参提取物对PD 细胞模型抗氧化功能的影响经过鱼藤酮的诱导,神经细胞内与氧化应激相关的MDA 显著升高,而与抗氧化相关的SOD、GSH、GPx 均显著下降。而通过药物的干预,在MDA 显著减少的同时SOD 等保护物质显著增加,其中,以石参水提物的作用最为显著(图5)。
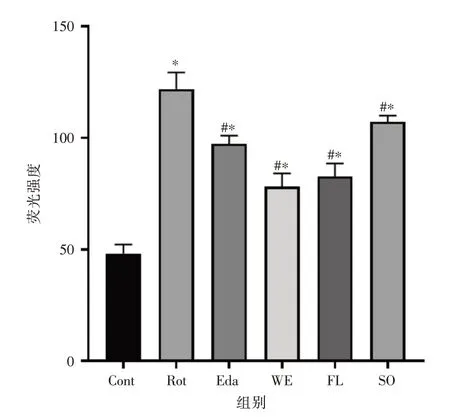
图4 药物对PD 细胞模型的细胞内活性氧含量的影响荧光强度半定量分析Fig.4 Semi-quantitative analysis of fluorescence intensity of effects of drugs on intracellular ROS in a cellular PD model
2.5 石参提取物对PD细胞模型细胞内HO-1、Nrf2蛋白表达量的影响在细胞处于氧化应激状态时,Nrf2/HO-1 通路是重要的保护性通路。见图6,各给药组均能显著上调Nrf2 和HO-1 两种蛋白的表达量。其中,石参水提物及石参总黄酮能较好的上调Nrf2 的表达量,而依达拉奉及石参水提物能有效上调HO-1 的表达量。
3 讨论
大量研究表明[7],Ⅱ型糖尿病与PD之间具有较强的联系。前期研究证明石参在体内外都具有一定抗糖尿病及抗氧化的作用[7,12],因此推测其可能具有一定的抗PD 作用。
核因子E2 相关因子2(Nrf2),是细胞抗氧化的重要通路中的核心转录因子,当细胞遭受氧化应激损伤时,Nrf2 被激活并入核,上调血红素加氧酶-1(HO-1)等蛋白的转录。HO-1 是一种微粒体酶能在细胞受到氧化应激损伤时对细胞起很好的保护作用[14]。
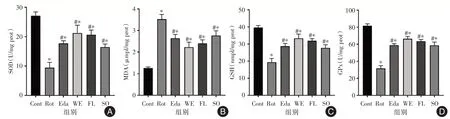
图5 药物对PD 细胞模型的细胞内抗氧化指标的影响Fig.5 The effects of drugs on intracellular antioxidation capacity in a cellular PD model
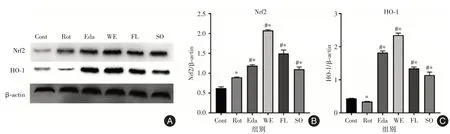
图6 药物对PD 细胞模型的细胞内Nrf2 及HO-1 表达的影响Fig.6 The effects of drugs on the expression of Nrf2 and HO-1 in a cellular PD model
本研究利用鱼藤酮及人神经母细胞瘤细胞系SH-SY5Y 构建体外PD 模型以探讨石参提取物对PD 的治疗作用。前期研究显示,通过10 μmol/L的鱼藤酮干预6、24 h,能构建稳定的活性氧升高及氧化损伤模型。为比较药物的作用,本研究选用了临床常用的以清除自由基为主要作用的神经细胞保护剂依达拉奉作为阳性对照[15-16]。研究结果显示,在24 h 损伤模型的研究上,相对于依达拉奉,石参各种提取物都表现出了更强的保护作用,且以水提物为最强,总皂苷次之,但二者无显著差异,而传统认为的具有较好抗氧化作用的总黄酮保护能力较弱;对于诱导6 h 的活性氧升高模型,总黄酮显示出了接近水提物的较强的抑制作用,而总皂苷在对抗活性氧方面表现出较低的活性。通过上述研究表明,石参提取物确实具有一定的对抗鱼藤酮诱导的体外帕金森病模型的作用,且该作用与药物降低细胞内活性氧含量有关。
本研究发现石参有效成分能有效提高模型细胞内的过氧化物歧化酶(SOD)、总谷胱甘肽(GSH)以及谷胱甘肽过氧化物酶(GPx)的含量,增强细胞抗氧化的能力。同时降低细胞内丙二醛的含量,进而改善细胞内脂质过氧化的问题,已有研究表明脂质代谢稳态的失调也参与到PD 的发病过程中[17]。对药物是否通过调节细胞内抗氧化能力核心通路Nrf2/HO-1 通路的研究结果显示,石参有效成分能有效上调模型细胞内Nrf2 及HO-1 的表达量,增强了细胞内应对氧化应激的能力。这说明石参有效成分一定程度上是通过上调Nrf2/HO-1 通路功能,增强细胞内抗氧化能力,进而起对抗鱼藤酮诱导SH-SY5Y 细胞帕金森病模型的作用。
本研究为体外研究,而天然药物有效成分无论是单体还是有效部分,都存在一定的吸收及跨血脑屏障起效的问题[18],因此石参有效成分能否在动物模型上重现保护作用,这些都问题都有待后续的进一步研究证明。
综上所述,石参提取物能有效地逆转鱼藤酮诱导的人神经母细胞瘤细胞系SH-SY5Y 帕金森病模型,其机制可能与上调细胞内Nrf2/HO-1 通路功能,增强细胞抗氧化能力有关。
