泥东风螺EST-SSR开发及其群体遗传多样性分析*
2020-07-26王晓清陈贞年周先文曾志南
熊 钢 王晓清 王 佩 陈贞年 周先文,3 康 骊 曾志南
泥东风螺EST-SSR开发及其群体遗传多样性分析*
熊 钢1,2王晓清2①王 佩2陈贞年2周先文2,3康 骊1曾志南4
(1. 湖南生物机电职业技术学院动物科技系 长沙 410127;2. 湖南农业大学动物科技学院 长沙 410128;3. 湘西州水产工作站 吉首 416000;4. 福建省水产研究所 厦门 361013)
本研究采用MISA软件分析泥东风螺()转录组中微卫星信息。结果显示,从转录组中共获得16324个SSR,共有181种重复基元;泥东风螺转录组中不同类型微卫星的重复基元具有不同的分布特征,其中,二核苷酸重复基元中AC/GT(70.58%)重复基元以重复6次出现频率占优;长度为12~20 bp的SSR占63.95%,长度为21~25 bp的SSR占9.14%,总体的平均长度为18.4 bp。随机选取其中50条序列设计引物,通过对福建野生泥东风螺群体(WP)DNA样本进行PCR扩增和分型,结果获得23个多态性位点,等位基因数目为2~7个不等,期望杂合度(e)为0.190~0.937,观察杂合度(o)为0.065~0.936,多态性信息含量(PIC)为0.061~0.777,有4个位点显著偏离哈迪温伯格平衡(Hardy-Weinberg equilibrium, HWE) (<0.05)。对野生群体和养殖群体(BP)遗传多样性分析显示,野生群体和养殖群体的平均e分别为0.491和0.544,平均o分别为0.477和0.564,平均PIC分别为0.541和0.407。is结果显示,野生群体和养殖群体分别有13个和9个位点杂合子过剩。群体间遗传分化指数(st)为0.001~0.655,平均值为0.053 (0.05 泥东风螺;转录组;EST-SSR;遗传多样性 东风螺(sp)隶属于软体动物的腹足纲、新腹足目、蛾螺科、东风螺属(王如才等, 1988),俗称花螺、泥螺、南风螺等,分布于热带和亚热带海域,是我国沿海重要的经济软体动物。我国现有方斑东风螺()、泥东风螺()和台湾东风螺 () 3种(张汉华等, 2004; 陈利雄等, 2004)。泥东风螺分布于我国福建至广西沿海地区。随着人类活动对海洋的影响,海洋中野生泥风螺锐减,我国研究人员已开展了泥东风螺的人工选育(叶泉土等, 2015a; 林国清等, 2015)、人工养殖(叶泉土等, 2015b)、人工增殖放流(叶泉土等, 2015b)和群体遗传多样性AFLP分析(秦溱等, 2014)的相关研究。 简单重复序列(Simple sequence repeats, SSR)又称微卫星DNA、短串联重复序列,一般以1~6个碱基为核心序列,广泛存在真核生物的基因组中,具有数量丰富、多态性高、共显性等特点(Powell, 1996)。Morgante等(1993)将微卫星用于遗传和物理图谱的构建、品种鉴定、基因定位、遗传多样性、分类和进化及比较基因组等方面的研究。目前,SSR标记主要分为基因组SSR(Genomic SSR, gSSR)和表达序列标签SSR(Expressed sequence tag SSR, EST-SSR)两种。EST-SSR反映的是基因的编码部分,可为功能基因提供更可靠的功能性标记,所以它在物种起源与进化、资源多样性、遗传作图、功能基因的发现与定位和比较基因组学研究等方面都有重要的利用价值。EST-SSR多态性可能与基因功能直接相关,因此,比gSSR标记具有更高通用性(Eujayl, 2002)。新一代测序技术可以对全基因组范围内的转录本进行大规模的高通量测序,并能产生海量的转录组数据(Simon, 2009),这为功能基因组SSR标记的开发提供了更丰富和极有价值的可利用资源(Graham, 2010)。我国研究工作者采用新一代测序技术已从曼氏无针乌贼()(管奥等, 2018)、长江刀鲚()(于爱清等, 2018)、栉江珧()(李东明等, 2017)、凡纳滨对虾()(李东宇等, 2017)、扇贝() (张广明等, 2018; 倪守胜等, 2018)、黄口荔枝螺()(李威等, 2015)和泥蚶() (史松富等, 2013)等水生动物中成功开发并应用于物种群体遗传多样性分析的SSR标记。本课题组利用软件分析泥东风螺转录组数据中微卫星分布特点和规律,利用筛选SSR标记对野生群体和养殖群体的遗传多样性进行分析,可为泥东风螺微卫星标记的开发及应用研究奠定基础。 野生泥东风螺采自福建连江和长乐,共62只。养殖群体来源于福建长乐泥东风螺育种场,共206只。 1.2.1 泥东风螺转录组数据来源 泥东风螺转录组数据是由腹足和肝胰腺组织的mRNA建立混合池,经Illumina HiSeqTM2000高通量测序平台获得的转录组数据文库。 1.2.2 泥东风螺转录组SSR的筛选及引物设计 利用软件MISA(Kanehisa, 2008) (http://pgrc. ipk-gatersleben.de/misa/)对泥东风螺转录组中Unigene的cDNA序列数据进行SSR搜索,设置参数:单碱基最少重复10次以上,双碱基最少重复6次以上,3~6碱基最少重复5次以上;混合重复的2个重复之间的距离不能大于100 bp。随机挑选EST-SSR序列,参照引物设计原则(张新宇等, 2004),利用软件Primer premier 5.0在重复序列两侧保守区设计微卫星扩增引物。 1.2.3 DNA提取 取泥东风螺腹足,采用天泽基因柱式动物DNA提取试剂盒提取泥东风螺总DNA。总DNA用1%琼脂糖凝胶电泳检测,−20℃保存备用。SSR分析采用20 μl PCR扩增反应体系,扩增条件为:94℃预变性5 min;94℃变性30 s,退火(退火温度见表3) 30 s,72℃延伸30 s,30个循环;72℃延伸5 min,在4℃条件下保存。扩增产物采用8%变性聚丙烯酰胺凝胶电泳,银染显色,人工读带后记录带型。 1.2.4 EST-SSR分析 用PopGene 1.3.1(Yeh, 1997)软件计算有效等位基因数(Effective numbers of allele,e)、观测杂合度(Observed heterozygosity,o)、(Expected heterozygosity,e)、群体间基因流(m)、固定系数(st)和群体近交系数(is)。位点多态性(Polymorphis information content, PCI)采用软件包计算,Cervus 3.03 (Kalinowsk, 2007)软件计算哈迪温伯格平衡(Hardy-Weinberg equilibrium, HWE)。 利用MISA软件对Unigenes的cDNA序列数据中筛选1 kb以上的Unigenes进行SSR分析,共筛选到16324个SSR符合设置条件(表1),泥东风螺转录组中SSR种类丰富,共有181种重复类型;各种类型的出现频率差异较大,主要集中在单核苷酸重复、二核苷酸重复和三核苷酸重复,分别占SSR总数量的40.17%、29.75%和15.27%,四核苷酸重复和五核苷酸重复数量少,分别占0.76%和0.04%,未发现多于5个核苷酸重复。SSR在整个泥东风螺转录组中的出现频率和发生频率分别为13.62%和6.86%,平均每350.78 kb出现1个SSR。各种重复基元出现频率差异大(表2),如:AC/GT重复基元占二核苷酸重复的70.58%,AGG/CCT和ACC/GGT重复基元分别占三核苷酸重复的22.60%和20.50%。从整体分布分析中发现多核苷酸重复序列以重复6次出现频率占优势。长度为12~20 bp的SSR占63.95%,长度为21~25 bp的SSR占9.14%,总体的平均长度为18.4 bp。 表1 泥东风螺转录组中EST-SSRs重复次数分布 Tab.1 Repeat number of EST-SSRs in B. lutosa transcriptome 表2 二核苷酸和三核苷酸EST-SSRs不同重复基元分布比例 Tab.2 Percentage of different motifs dinucleotide and trinucleotide EST-SSRs 随机选取其中50条序列设计引物,通过对福建野生泥东风螺62只个体DNA样本进行PCR扩增和分型,获得23个多态性位点(表3)。23个位点的等位基因数为2~7个不等,平均a为3.5,平均e为0.491,平均o为0.477,平均PIC为0.451。HWE平衡检验显示,4个位点显著偏离平衡(<0.05)(表4)。 表3 泥东风螺EST-SSR引物信息 Tab.3 Information of EST-SSR primer in the B. lutosa 利用23个多态性位点分析泥东风螺野生群体和养殖群体遗传多样性(表4),结果显示,福建野生群体e值为0.190~0.937,o为0.065~0.936,PIC为0.061~ 0.777,其中,9个微卫星位点表现为高度多态性(PIC>0.5),11个位点表现为中度多态性(0.5>PIC>0.25),3个位点表现为低度多态性(PIC<0.25)。养殖群体e(0.183~0.979)和o(0.130~0.980)的平均值均高于野生群体,但PIC(0.020~0.787)的平均值低于野生群体。SPSS分析群体间e、o和is差异显著(<0.05),PIC差异极显著((<0.01)。养殖群体高度多态性位点和低度多态性位点分别为7个和5个。在养殖群体样本中检测到B05、B08、B12、B15、B16和B20位点中出现等位基因缺失现象。野生群体和养殖群is分别为–0.214~0.377和–0.130~0.129,群体的is平均值都大于0,在野生群生群体和养殖群体中,位点is<0的分别有13个和9个。HWE平衡检验显示,野生群体和养殖群体分别有4个和9个位点偏离平衡。 Popgene分析野生群体与养殖体间的位点基因流值(m)为0.132~543.787(表4),平均m为4.450,说明这2个群体间的遗传分化小。群体间位点遗传分化指数(st)为0.001~0.655(表4),平均st为0.053,属于遗传分化中等(0.05 不同物种转录组数据库中微卫星分布的频率存在差异。本研究分析了泥东风螺转录组中SSR的分布频率和重复基元的特点。从泥东风螺SSR重复基元来看,二核苷酸重基元中AC/GT占70.58.%,这与其他水产动物中AC/GT重复最多一致(曾聪等, 2013)。三核苷酸重基元占总数15.27%,其中,CCG/CGG重复基元数量最少,这与一些真核生物中发现一定比例的CCG/CGG重复相似(Toth, 2000)。Schlottere等(1992)推测微卫星的长度因在复制过程中的滑动而反映了微卫星位点获得(或失去)重复基元的活跃程度。Schlotterer(2000)认为,SSR位点的变异频率与基元重复数存在一定正相关,即重复次数越多,SSR产生变异的可能性越大。Temnykh等(2001)进一步研究表明,SSR的长度是影响其多态性高低的重要因素,据此分析,泥东风螺转录组基因所含的微卫星长度绝大部分分布在12~25 bp之间,推测是受到强烈趋同选择的压力影响。 表4 泥东风螺23个EST-SSR位点的野生群体和养殖群体遗传多样性分析 Tab.4 Genetic diversity of wild and breeding populations in B. lutosa at 23 EST-SSR loci 对福建野生群体和养殖群体的位点各项参数进行分析,结果显示,野生群体杂合子过剩(is<0,表明存在杂合子过剩)现象比养殖群体多4个位点。养殖群体有6个位点检测到等位基因缺失,这可能与本研究选取样本数量较少及养殖群体选择的亲本来自不同地理群体有关。o和e是判定群体遗传多样性水平的重要指标,养殖群体中平均o和e显著高于野生群体,推测是因目前养殖群体选育采用的技术策略导致养殖群体的遗传多样性发生变化。 野生群体和养殖群体间st为0.053 (0.05 本研究中,泥东风螺养殖群体的遗传多样性显著低于野生群体,这与中国明对虾()(王军等, 2018)、草鱼()(王沈同等, 2018)、大黄鱼() (赵广泰等, 2010)、鳜()(郑荷子等, 2013)水产动物养殖群体比野生群体遗传多性低的研究结果一致,其原因可能为目前养殖泥东风螺繁育亲本群体来源和个体数量问题。研究表明,本研究所开发的SSR具有较高的多态性,研究的群体具有较高的遗传多样性,具有进一步选育的价值。 SSR标记在水生生物之间通用性较好(张琼等, 2010; 刘必谦等, 2007),SSR遗传作图将使物种之间连锁信息的转换更快,实现多个图谱整合,从而更有利于比较基因组学的研究。本研究开发的泥东风螺EST-SSR标记对泥东风螺的亲子谱系分析、群体遗传结构分析、图谱构建、增殖放流效果评估和分子辅助育种等研究方面具有重要的意义。 Chen LX, Wu JF. Culture technique and industrial prospect of ivory shell. Shandong Fisheries, 2004, 21(10): 9–11 [陈利雄, 吴进锋. 东风螺的增养殖技术及产业化前景. 齐鲁渔业, 2004, 21(10): 9–11] Eujayl I, Sorrells ME, Baum M,. Isolation of EST-derived microsatellite markers for genotyping the A and B genomes of wheat. Theoretical and Applied Genetics, 2002, 104(2–3): 399–407 Graham IA, Besser K, Blumer S,. The genetic map ofL. identifies loci affecting yield of the antimalarial drug artemisinin. Science, 2010, 327(5963): 328–331 Guan A, Wu YT, Chen Y,. Deep sequence-based transcriptome analysis of microsatellites in the cuttlefish (). Progress in Fishery Sciences, 2018, 39(3): 144–151 [管奥, 毋玉婷, 陈宇, 等. 曼氏无针乌贼转录组微卫星特征分析. 渔业科学进展, 2018, 39(3): 144–151] Kalinowski ST, Taper ML, Marshall TC. Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment. Molecular Ecology, 2007, 16(5): 1099–1106 Kanehisa M, Araki M, Goto S,. KEGG for linking genomes to life and the environment. Nucleic Acids Research, 2008, 36: D480–D484 Li DM, Yang AG, Wu B,. Development and application of the EST-SSR markers in. Progress in Fishery sciences, 2017, 38(2): 137–142 [李东明, 杨爱国, 吴彪, 等. 栉江珧() EST-SSR标记的开发与应用. 渔业科学进展, 2017, 38(2): 137–142] Li DY, Meng XH, Kong J,. The difference of genetic diversity and the comparison of growth performance between selected population and hybridized population of pacific white shrimp () under low temperature conditions. Progress in Fishery sciences, 2017, 38(4): 69–77 [李东宇, 孟宪红, 孔杰, 等. 凡纳滨对虾()选育群体与杂交群体遗传多样性差异及其在低温条件下生长性能的比较. 渔业科学进展, 2017, 38(4): 69–77] Li W, Zhao S, Jiao HF,. Characterization and analysis of microsatellite markers inusing next generation sequencing. Marine Sciences, 2015, 39(11): 61–67 [李威, 赵姗, 焦海峰, 等. 黄口荔枝螺转录组数据的微卫星标记开发与分析. 海洋科学, 2015, 39(11): 61–67] Lin GQ, Lin D, Chen XF,. Research on the scale artificial breeding technique and the morphological observation of the early developmental stages of. Journal of Fujian Fisheries, 2015, 37(1): 20–28 [林国清, 林丹, 陈曦飞, 等. 泥东风螺()规模化人工育苗技术和早期发育观察. 福建水产, 2015, 37(1): 20–28] Liu BQ, Zeng QG, Wang YJ,. The cross-species amplification and validation of EST-SSR loci in. Acta Hydrobiolonica Sinica, 2007, 31(2): 149–154 [刘必谦, 曾庆国, 王亚军, 等. 条斑紫菜EST-SSR引物种间转移扩增真实性研究. 水生生物学报, 2007, 31(2): 149–154] Morgante M, Olivieri AM. PCR-amplified microsatellites as markers in plant genetics. Plant Journal, 1993, 3(1): 175–182 Ni SS, Yang Y, Liu SF,. Microsatellite analysis ofusing next-generation sequencing method. Progress in Fishery sciences, 2018, 39(1): 107–113 [倪守胜, 杨钰, 柳淑芳, 等. 基于高通量测序的虾夷扇贝基因组微卫星特征分析. 渔业科学进展, 2018, 39(1): 107–113] Powell WMGCP. Polymorphism revealed by simple sequence repeats. Trends in Plant Science, 1996, 7(1): 215–222 Qin Z, Wang XQ, Zeng ZN,. Genetic distance in four populations of(Lamer) assessed by AFLP makers. Journal of Hunan Agricultural University (Natural Sciences), 2014, 40(3): 299–304 [秦溱, 王晓清, 曾志南, 等. 泥东风螺4个群体遗传多样性的AFLP分析. 湖南农业大学学报(自然科学版), 2014, 40(3): 299–304] Schlotterer C, Tautz D. Slippage synthesis of simple sequence DNA. Nucleic Acids Research, 1992, 20(2): 211–215. Schlotterer C. Evolutionary dynamics of microsatellite DNA. Chromosoma, 2000, 109(6): 365–371 Shi SF, Yao HH, Lin ZH,. Characterization and analysis of 24 polymorphic EST-SSR loci in. Marine Sciences, 2013, 37(8): 42–46 [史松富, 姚韩韩, 林志华, 等. 24个泥蚶EST-SSR标记的开发与分析. 海洋科学, 2013, 37(8): 42–46] Simon SA, Zhai J, Nandety RS,. Short-read sequencing technologies for transcriptional analyses. Annual Review of Plant Biology, 2009, 60: 305–333 Temnykh S, DeClerck G, Lukashova A,. Computational and experimental analysis of microsatellites in rice (L.): Frequency, length variation, transposon associations, and genetic marker potential. Genome Research, 2001, 11(8): 1441–1452 Toth G, Gaspari Z, Jurka J. Microsatellites in different eukaryotic genomes: Survey and analysis. Genome Research, 2000, 10(7): 967–981 Wang J, Wang QY, Kong J,. SSR analysis on genetic diversity in breeding and wild populations of. Progress in Fishery sciences, 2018, 39(2): 104–111 [王军, 王清印, 孔杰, 等. 中国明对虾人工选育群体与野生群体遗传多样性的SSR分析. 渔业科学进展, 2018, 39(2): 104–111] Wang RC. China aquatic shellfish primary color guide. Hangzhou: Zhejiang Science and Technology Press, 1988 [王如才. 中国水生贝类原色图鉴. 杭州: 浙江科学技术出版社, 1988] Wang ST, Shen YB, Meng XZ,. Genetic variability in wild and selected populations ofusing microsatellite markers. Journal of Fisheries of China, 2018(8): 1273–1284 [王沈同, 沈玉帮, 孟新展, 等. 草鱼野生与选育群体遗传变异微卫星分析. 水产学报, 2018(8): 1273–1284] Ye QT, Liu Y, Zeng ZN,. Tracking survey after enhancement and releasing ofand its effects analysis. Journal of Fujian Fisheries, 2015a, 37(2): 140–147 [叶泉土, 刘勇, 曾志南, 等. 泥东风螺增殖放流跟踪调查及效果分析. 福建水产, 2015a, 37(2): 140–147] Ye QT, Wu QS, Zeng ZN,. Effect of different bottom sowing density on growth and survival ofjuveniles. Journal of Fujian Fisheries, 2015b, 37(1): 36–42 [叶泉土, 巫旗生, 曾志南, 等. 不同底播密度对泥东风螺()幼螺生长和存活的影响. 福建水产, 2015b, 37(1): 36–42] Yeh FC,Boyle TJB. Population genetic analysis of codominant and dominant markers and quantitative traits. Belgian Journal of Botany, 1997, 129–157 Yu AQ, Shi YH, Xu JB,. Characteristic analysis of microsatellites in the selectedbased on transcriptome dataset. Progress in Fishery Sciences, 2019, 40(5): 101–109 [于爱清, 施永海, 徐嘉波, 等. 长江刀鲚选育群体转录组EST-SSR的分布特征分析. 渔业科学进展, 2019, 40(5): 101–109] Zeng C, Gao ZX, Luo W,. Characteristics of microsatllites in blunt snout bream () EST sequences using 545 FLX. Acta Hydrobiolonica Sinica, 2013, 37(5): 982–988 [曾聪, 高泽霞, 罗伟, 等. 基于454GS FLX高通量测序的团头鲂ESTs中微卫星特征分析. 水生生物学报, 2013, 37(5): 982–988] Zhang GM, Sun XJ, Wu B,. Transferability of EST-SSR frominto. Progress in Fishery Sciences, 2018, 39(4): 1–8 [张广明, 孙秀俊, 吴彪, 等. 虾夷扇贝EST-SSR标记在栉孔扇贝中的通用性研究. 渔业科学进展, 2018, 39(4): 1–8] Zhang HH, Wu JF, Chen LX,. Prospect of artificial breeding, breeding and industrialization of. Southern Aquaculture, 2004(11): 2–5 [张汉华, 吴进锋, 陈利雄, 等. 东风螺人工育苗、养殖及产业化发展前景. 南方水产, 2004(11): 2–5] Zhang Q, Liu XL, Li XL,. Application of simple sequence repeats derived from expression sequence tags (EST-SSRs) in aquatic animal genomics. Fisheries Science, 2010, 29(5): 302–306 [张琼, 刘小林, 李喜莲, 等. EST-SSR分子标记在水生动物遗传研究中的应用. 水产科学, 2010, 29(5): 302–306] Zhang XY, Gao YN. To design PCR primers with Oligo 6 and Primer premier 5. China Journal of Bioinformatics, 2004, 2(4): 15–18 [张新宇, 高燕宁. PCR引物设计及软件使用技巧. 生物信息学, 2004, 2(4): 15–18] Zhao GT, Liu XD, Wang ZY,. Genetic structure and genetic diversity analysis of four consecutive breeding generations of large yellow croaker () using microsatellite markers. Journal of Fisheries of China, 2010, 34(4): 500–507 [赵广泰, 刘贤德, 王志勇, 等. 大黄鱼连续4代选育群体遗传多样性与遗传结构的微卫星分析. 水产学报, 2010, 34(4): 500–507] Zheng HZ, Yi TL, Liang XF,. Genetic structure and genetic diversity analysis of four consecutive breeding generations of. Freshwater Fisheries, 2013, 43(6): 8–12 [郑荷子, 易提林, 梁旭方, 等. 翘嘴鳜连续4代选育群体遗传多样性及遗传结构分析. 淡水渔业, 2013, 43(6): 8–12] Development and Genetic Diversity Analysis ofwith EST-SSR Markers XIONG Gang1,2, WANG Xiaoqing2①, WANG Pei2, CHEN Zhennian2, ZHOU Xianwen2,3, KANG Li1, ZENG Zhinan4 (1. Department of Animal Science and Technology, Hunan Biological and Electromechanical Polytechnic, Changsha 410127;2. College of Animal Science and Technology, Hunan Agriculture University, Changsha 410128;3. Station of Aquaculture in Xiang xi, Jishou 416000;4. Fisheries Research Institute of Fujian, Xiamen 361013) is a marine shellfish that has high economic values. In recent decades, the natural resource ofhas declined due to the environment destruction and overfishing. To further understand the level of genetic diversity and population genetic structure ofwe have evaluated the information characteristics of’s microsatellites, after obtaining transcriptome sequences using MISA software. The results show that a total of 16342 microsatellites and 181 nucleotide repeat motifs were identified. Different types of repeat microsatellites had considerably different distribution characteristics. Mononucleotide and dinucleotide microsatellite repeating units were the most abundant in thetranscriptome, in which 6 repeats of AC/GT (70.58%) were the dominant repeating dinucleotide units. The length of the dominant repeating units was 12~20 bp (63.95%) and 21~25 bp (9.14%), respectively, and the average length was 18.4 bp. Among the 50 designed primer pairs, 23 proved to be polymorphic microsatellite markers in thewild populations (WP). The results showed that the allele number of these microsatellites ranged from 2 to 7. The expected heterozygosity (e) and observed heterozygosity (o) ranged from 0.190 to 0.937, and 0.065 to 0.936, respectively. The polymorphism information content (PIC) ranged from 0.061 to 0.777. Theevalues of the WP and breeding population (BP) were 0.491 and 0.544, respectively. Theovalues of the WP and BP populations were 0.477 and 0.564, respectively. The PIC values for WP and BP were 0.541 and 0.407, respectively. There were 13 population loci that were heterozygote excesses in WP, and 13 population loci in BP. The genetic differentiation index (st) ranged from 0.001 to 0.655, with an average value of 0.053 (0.05 ; Transcriptome; EST-SSR; Polymorphism WANG Xiaoqing, E-mail: wangxiao8258@126.com S917.4 A 2095-9869(2020)04-0117-08 10.19663/j.issn2095-9869.20190417002 http://www.yykxjz.cn/ 熊钢, 王晓清, 王佩, 陈贞年, 周先文, 康骊, 曾志南. 泥东风螺EST-SSR开发及其群体遗传多样性分析. 渔业科学进展, 2020, 41(4): 117–124 Xiong G, Wang XQ,Wang P, Chen ZN, Zhou XW, Kang L, Zeng ZN. Development and genetic diversity analysis ofwith EST-SSR markers. Progress in Fishery Sciences, 2020, 41(4): 117–124 * 海洋公益性行业科研专项经费项目(201205021)、国家自然科学基金(31672640)、湖南省自然科学基金(2017JJ3134; 2016NK2115)和湖南省教育厅基金项目(17C0935)共同资助[This work was supported by Public Science and Technology Research Funds Projects of Ocean (201205021), National Natural Science Foundation of China (31672640), Natural Science Foundation of Hunan Province(2017JJ3134; 2016NK2115), and Scientific Research Fund of Hunan Province Education Department (17C0935)]. 熊 钢,E-mail: xionggang709@126.com 王晓清,教授,E-mail: wangxiao8258@126.com 2019-04-17, 2019-05-12 (编辑 冯小花)1 材料与方法
1.1 材料
1.2 方法
2 结果
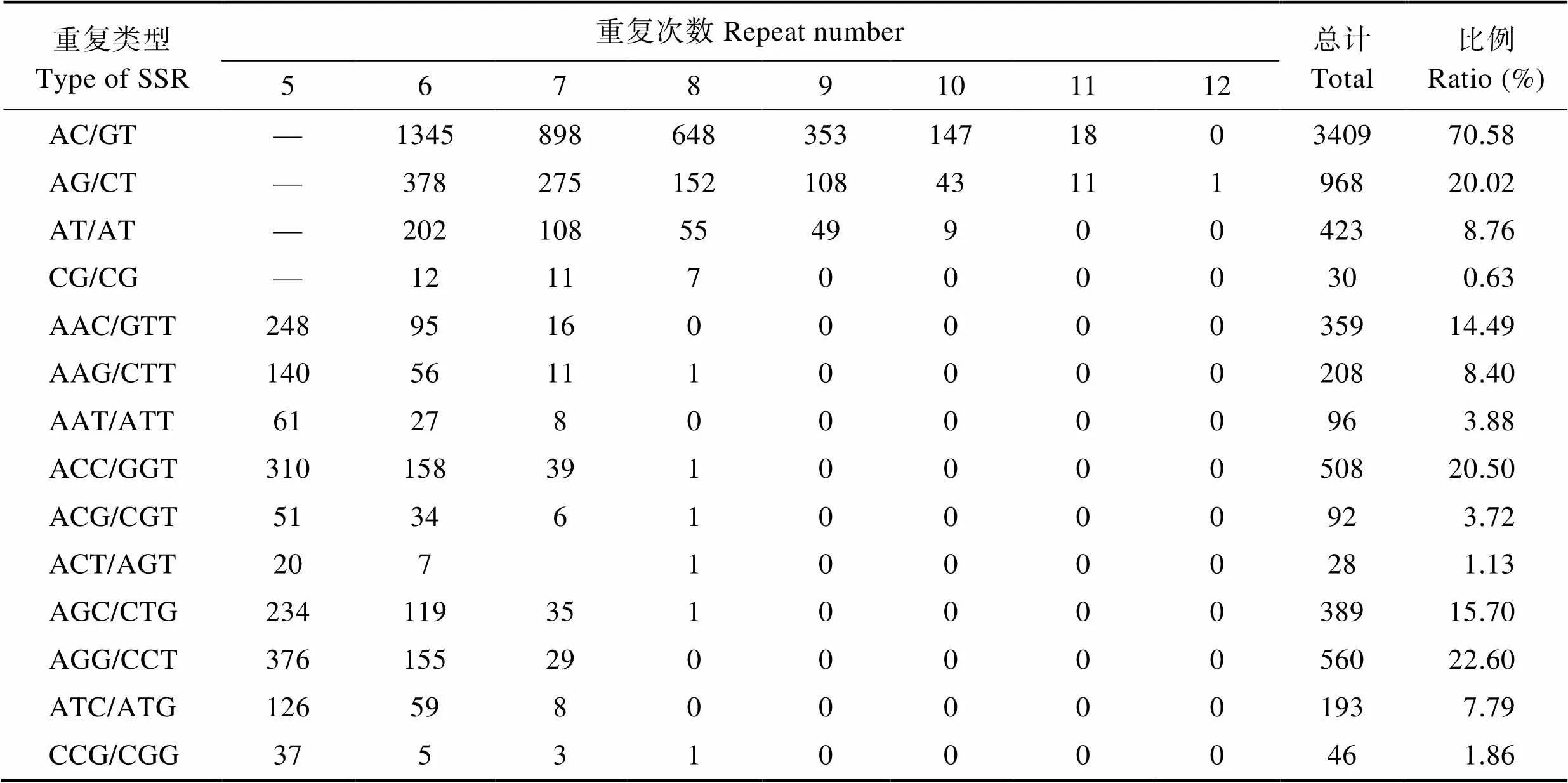
2.1 转录组中EST-SSR特性

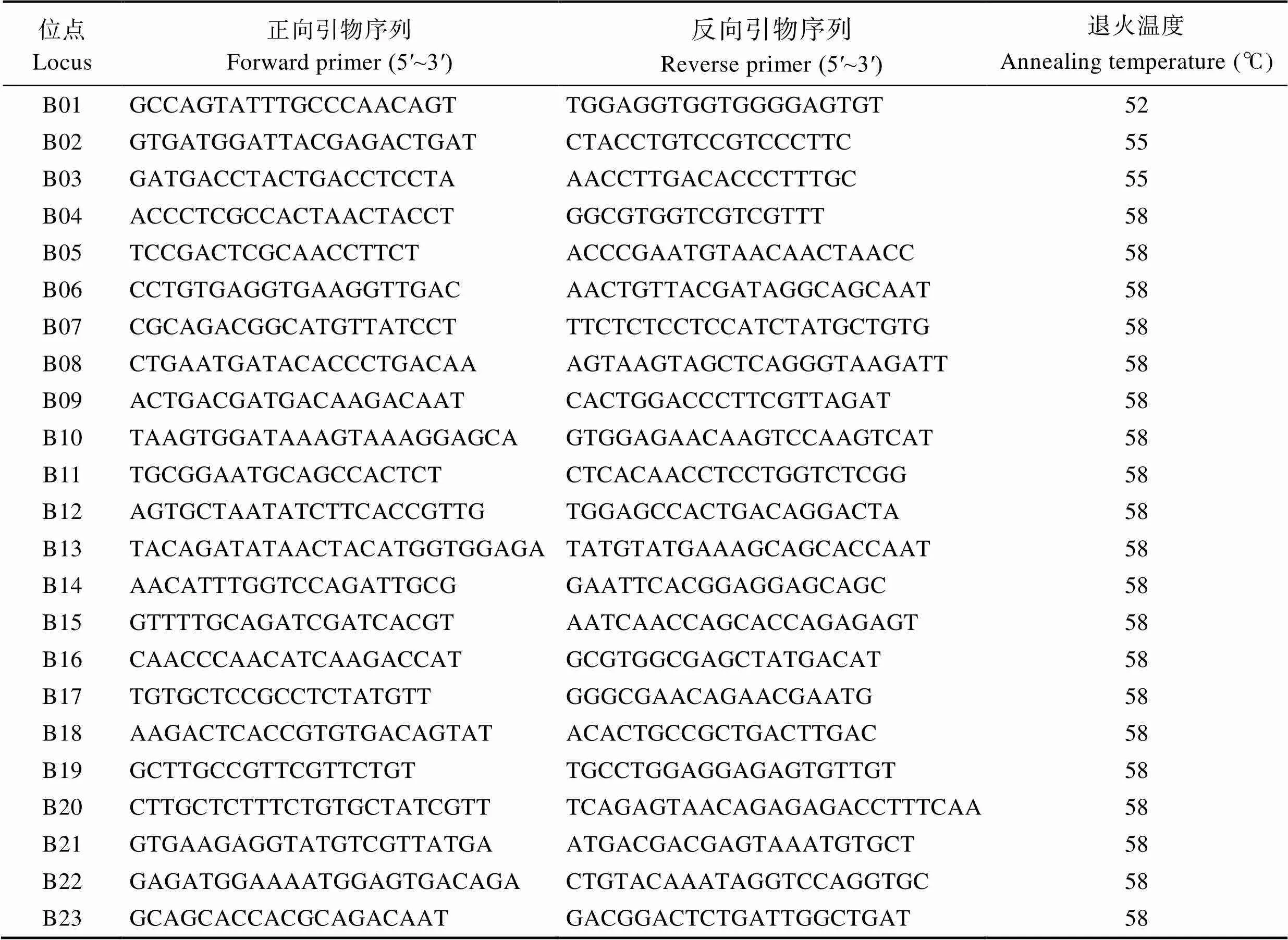
2.2 扩增位3点的多态性
2.3 野生群体和养殖群体遗传多样性
2.4 野生群体和养殖群体遗传分化
3 讨论
3.1 转录组中EST-SSR分布

3.2 EST-SSR在泥东风螺野生和养殖群体中的多态性变化
3.3 泥东风螺野生群体和养殖群体遗传多样性与遗传分化
