日粮纤维水平对不同猪种肠道物理屏障和微生物的影响
2020-07-23王欢李平华牛清杜陶然蒲广范丽娟牛培培吴承武周五朵黄瑞华
王欢 李平华 牛清 杜陶然 蒲广 范丽娟 牛培培 吴承武 周五朵 黄瑞华


摘要:為研究日粮纤维水平对不同品种猪肠道形态、通透性和微生物的影响,按照2×4双因子设计,选择体质量约40 kg的健康二花脸猪和与二花脸猪相同生理阶段约65 kg的大白猪各24头随机分为4个处理组,分别饲喂基础日粮和7%、14%、21%麸皮替代基础日粮,每组6个重复,使用奥饲本全自动生产性能测定系统进行饲喂,每个重复1头猪。正试期28 d,试验结束时采集血液样品,分离血清用于血清内毒素、二胺氧化酶(DAO)和D-乳酸含量测定;屠宰采集盲肠和结肠中段样品进行形态学观察,采集空肠和结肠黏膜进行微生物16S rRNA基因拷贝数测定。结果表明:猪品种对血清内毒素含量、D-乳酸含量、空肠双歧杆菌丰度、盲肠隐窝深度、盲肠肠壁厚度、结肠肠壁厚度、结肠肌层厚度、结肠大肠杆菌和结肠乳酸杆菌丰度有显著影响(P<0.05)。日粮麸皮水平对血清DAO含量、D-乳酸含量和结肠大肠杆菌丰度有显著影响(P<0.05)。二花脸猪,与基础日粮对照相比,7%和14%麸皮替代日粮处理的D-乳酸含量显著升高(P<0.05),21%麸皮替代日粮处理的DAO含量显著升高(P<0.05),7%麸皮替代日粮处理的盲肠肌层厚度显著升高(P<0.05),21%麸皮替代日粮处理的盲肠肠壁厚度显著降低(P<0.05),7%麸皮替代日粮处理的结肠乳酸杆菌丰度显著升高(P<0.05),14%麸皮替代日粮处理的结肠大肠杆菌丰度显著降低(P<0.05)。大白猪,与基础日粮对照相比,14%麸皮替代日粮处理的DAO含量显著升高(P<0.05),14%和21%麸皮替代日粮处理的盲肠肠壁厚度显著增加(P<0.05),7%麸皮替代日粮处理的空肠双歧杆菌丰度显著降低(P<0.05),14%麸皮替代日粮处理的空肠双歧杆菌和结肠乳酸杆菌丰度显著降低(P<0.05)。综上所述,大白猪和二花脸猪在大肠形态、肠道通透性、空肠双歧杆菌丰度、结肠大肠杆菌丰度和结肠乳酸杆菌丰度等方面存在差异,日粮麸皮水平影响结肠大肠杆菌丰度。7%麸皮替代水平增大二花脸猪肠道通透性,但增加盲肠肌层厚度以适应纤维的消化,并增加结肠乳酸杆菌丰度促进肠道健康。14%麸皮替代水平会导致大白猪肠道通透性增大,盲肠肠壁增厚,空肠双歧杆菌和结肠乳酸杆菌丰度降低。
关键词:二花脸猪;大白猪;日粮纤维;麸皮;肠道通透性;肠道形态;肠道微生物
中图分类号:S828.8文献标识码:A文章编号:1000-4440(2020)03-0639-09
Effects of dietary fiber levels on intestinal physical barrier and microbiota in different pig breeds
WANG Huan1,2,LI Ping-hua1,2,3,NIU Qing1,2,DU Tao-ran1,2,PU Guang1,2,FAN Li-juan1,2,NIU Pei-pei2,WU Cheng-wu1,2,ZHOU Wu-duo1,3,HUANG Rui-hua1,2,3
(1.Institute of Swine Science, Nanjing Agricultural University, Nanjing 210095, China;2.Huai′an Academy, Nanjing Agricultural University, Huai′an 223001, China;3.Integration Innovation Center of Jiangsu Modern Agricultural (Pig′s) Industrial Technology System, Nanjing 210095, China)
Abstract: The aim of this experiment was to study the effects of dietary fiber levels on intestinal morphology, permeability and microbiota in different pig breeds. Based on 2×4 two-factor design, twenty-four Erhualian pigs (approximately 40 kg) and twenty-four Large White pigs (the same physiological stage as the Erhualian pig, approximately 65 kg) were selected and randomly divided into four treatment groups including control diet group, 7%, 14% and 21% wheat bran replaced basal diet with six replicates in each group and one pig per replicate. The pigs were fed by the Osborne testing stations system. After the 28-d trial, blood samples were collected and the serum was collected for analyses of endotoxin, diamine oxidase (DAO) and D-lactate. The middle sections of the cecum and colon were collected for histological analysis. Mucosal scrapings from the jejunum and colon were prepared for the detemination of 16S rRNA gene copy number. The results showed that pig breeds had significant effects on serum endotoxin content, D-lactate content, the abundance of Bifidobacterium in the jejunum, cecal crypt depth, intestinal wall thickness in the cecum, intestinal wall thickness in the colon, muscle thickness in the colon, the abundance of Escherichia coli and Lactobacillus in the colon (P<0.05). The level of wheat bran had significant effects on serum DAO content, D-lactate content and the abundance of Escherichia coli in the colon (P<0.05). For Erhualian pig, compared with the control group, 7% and 14% wheat bran significantly increased D-lactate content (P<0.05), 21% wheat bran significantly increased DAO content (P<0.05), 7% wheat bran significantly increased the muscle thickness in the cecum(P<0.05), 21% wheat bran significantly decreased intestinal wall thickness in the cecum (P<0.05), 7% wheat bran significantly increased the abundance of Lactobacillus, 14% wheat bran decreased the abundance of Escherichia coli in the colon (P<0.05). For Large White pig, compared with control group, 14% wheat bran significantly increased DAO content (P<0.05), 14% and 21% wheat bran significantly increased the intestinal wall thickness in the cecum (P<0.05), 7% wheat bran significantly decreased the abundance of Bifidobacterium in the jejunum (P<0.05), 14% wheat bran significantly decreased the abundance of Bifidobacterium in the jejunum and the abundance of Lactobacillus in the colon (P<0.05). In conclusion, there were differences between Erhualian pig and Large White pig in large intestine morphology, intestinal permeability, the abundance of Bifidobacterium in the jejunum, the abundance of Escherichia coli in the color, the abundance of Lactobacillus in the colon. The level of wheat bran affected the abundance of Escherichia coli in the colon. The 7% wheat bran increased intestinal permeability in Erhualian pigs. However, muscle thickness in the cecum was increased to odapt to the digestion of fiber, and the abundance of Lactobacillus in the colon was increased to improve intestinal health. The 14% wheat bran increased intestinal permeability and intestinal wall thickness in the cecum, and decreased the abundance of Bifidobacterium in the jejunum and Lactobacillus in the colon.
Key words:Erhualian pig;Large White pig;dietary fiber;wheat bran;intestinal permeability;intestinal morphology;intestinal microbiota
中国是养猪大国,养猪历史悠久。玉米、豆粕一直是养猪业中的主要饲料原料,提供了猪所需要的大部分营养需求。但是由于玉米、豆粕的大量使用等诸多原因,玉米、豆粕等常规饲料进口量逐年增加,价格不断上涨,养殖成本日益上升[1]。如何降低玉米、豆粕等常规饲料使用量来降低饲养成本已成为研究热点[2]。
麸皮是面粉加工过程中产生的副产品,常被用作猪饲料中的纤维成分,以降低饲料成本[3]。麸皮中含有大量的不溶性纤维,导致肠道消化过程受到抑制,因此它在猪饲养中的应用具有一定局限性[4]。但日粮纤维(Dietary fiber,DF)对维持猪肠道屏障功能和微生物区系稳定非常重要[5]。日粮纤维可以增强非反刍动物抵抗病原菌肠道感染的能力,例如果胶、瓜尔豆胶、燕麦胶或菊粉、抗性淀粉和不可消化的低聚糖等[6]。某些日粮纤维具有益生元效应,即具有诱导肠道微生物群向有益方向改变的能力,从而对宿主产生有益影响[7]。在当前以非洲猪瘟为代表的病毒性疾病爆发以及病毒与细菌性疾病常常混合感染,且国内即将禁止在饲料中添加抗生素的双重背景下,如何保持猪机体健康,尤其是肠道健康,已成为研究热点,因此研究日粮纤维对肠道健康的影响具有重要意义。中国地方猪种(如二花脸猪、梅山猪和淮猪等)与国外引进瘦肉型猪种(如大白猪等)相比,对高纤维日粮的耐受能力更强[8-9]。本研究选择耐粗饲料性能较好的二花脸猪与瘦肉型猪种代表大白猪进行不同含量麸皮日粮对比试验,旨在研究日粮纤维水平对二花脸猪和大白猪肠道形态、通透性和微生物的影响差异,为中国地方猪种及培育品种合理应用麸皮等日粮纤维含量丰富的饲料原料来降低饲养成本,增强猪肠道健康提供理论依据。
1材料与方法
1.1试验动物
考虑到大白猪与二花脸猪生长速度和成年体质量不同,直接选择相同体质量的两个品种猪做对比试验不一定合适,因此参考Kanengoni等[10]报道的方法,选择“相同生理阶段”的猪开展试验。本研究的“相同生理阶段”是指体质量为27%成年体质量的时期。二花脸猪成年体质量由猪场实测,为150 kg;大白猪成年体质量参照Stern等[11]的报道,为240 kg。
选择体质量约40 kg的健康二花脸猪、与二花脸猪相同生理阶段约65 kg的健康大白育肥阉公猪各24头,其中二花脸猪选购于常州市焦溪二花脸猪专业合作社,大白猪选购于江苏梅林畜牧有限公司。
1.2试验设计
每个品种猪随机分为4个处理组,每组6个重复。使用奥饲本全自动生产性能测定系统进行饲喂,每头猪的体质量、采食量等信息都能独立获取,因此每头猪分别被认定为1个重复。试验期间所有供试猪自由采食和饮水。试验预试期10 d,所有猪饲喂基础日粮;正试期28 d,4个处理组分别饲喂不同处理日粮,日粮中性洗滌纤维水平分别为12.84%、14.43%、15.84%和17.38%。
1.3日粮
按照中国《猪饲养标准——肉脂型生长肥育猪》(NY/T 65-2004)标准配制基础日粮(对照),其余3个处理组分别用7%麸皮、14%麸皮和21%麸皮替代基础日粮。按照美国分析化学家协会方法对日粮的粗纤维、粗蛋白、粗脂肪、中性洗涤纤维、酸性洗涤纤维、总日粮纤维、可溶性日粮纤维、不可溶性日粮纤维等指标含量进行测定。日粮配方及营养水平具体信息见表1。
每1 kg饲料中添加:维生素A 52 530 IU、维生素D 3 348 IU、维生素E 572.00 mg、维生素K 24.00 mg、硫胺素41.00 mg、核黄素65.00 mg、泛酸290.00 mg、烟酸325.00 mg、吡哆醇50.00 mg、生物素5.00 mg、叶酸12.00 mg、胆碱6.27 mg、亚油酸120.00 mg、铁42.50 mg、铜3.00 mg、锌45.00 mg、锰2.00 mg、硒0.11 mg、碘0.12 mg。
1.4采样方法
在28 d正试期后,颈静脉采集血液,4 ℃下3 000 g离心10 min,小心吸取血清至1.5 ml离心管。将血清样品储存在-80 ℃下备用,用于分析内毒素、二胺氧化酶(DAO)和D-乳酸。所有试验猪电击放血屠宰后迅速打开腹腔,贲门处切断食管,取出完整胃肠道,剥离肠系膜,分别截取盲肠、结肠中段1~2 cm完整、无损伤部分,迅速放于4%通用型多聚甲醛中固定,用于肠道形态学观察。用无菌载玻片刮取空肠、结肠中段黏膜样品于2 ml冻存管,置于-80 ℃保存,以备微生物16S rRNA基因拷贝数测定。
1.5测定指标与方法
1.5.1肠道通透性血清学检测使用南京建成生物工程研究所ELISA 试剂盒检测血清中内毒素、DAO和D-乳酸的含量。使用ELISA Calc 软件制作标准曲线,并计算样品中内毒素、DAO和D-乳酸含量。
1.5.2肠道形态学观察4%通用型多聚甲醛固定后的样品经脱水、包埋、5 μm切片和HE染色等步骤处理,用尼康Eclipse 80i 电子显微镜观察形态,使用NIS-Element软件测定隐窝深度、肠壁厚度和肌层厚度。
1.5.3肠道微生物16S rRNA基因拷贝数(下简称丰度)测定使用Fast DNA SPIN Kit for Soil试剂盒提取微生物总DNA,微量分光光度计测定浓度及纯度后-20 ℃保存备用。引物由南京擎科生物科技有限公司合成,具体引物序列信息见表2。从菌群中单克隆16S rRNA基因制备质粒,进行梯度稀释后建立标准曲线。使用实时荧光定量PCR仪对黏膜中总菌、大肠杆菌、乳酸杆菌和双歧杆菌16S rRNA基因拷贝数进行定量分析。构建 20 μl反应体系:TB Green Premix Ex Taq II 10.0 μl,上、下引物各0.8 μl,双蒸水6.4 μl,DNA模板2.0 μl。
1.6数据统计与分析
用Excel软件对试验数据进行初步处理,微生物16S rRNA基因拷贝数取以10为底的对数后进行统计分析。使用SAS 9.2软件MIXED模型进行分析,固定效应为猪种和麸皮水平,若 P<0.05 则认为其差异显著,试验结果以最小二乘均值和平均标准误(Standard error of mean, SEM)表示。
2结果与分析
2.1日粮麸皮水平对不同品种猪肠道通透性血清指标的影响
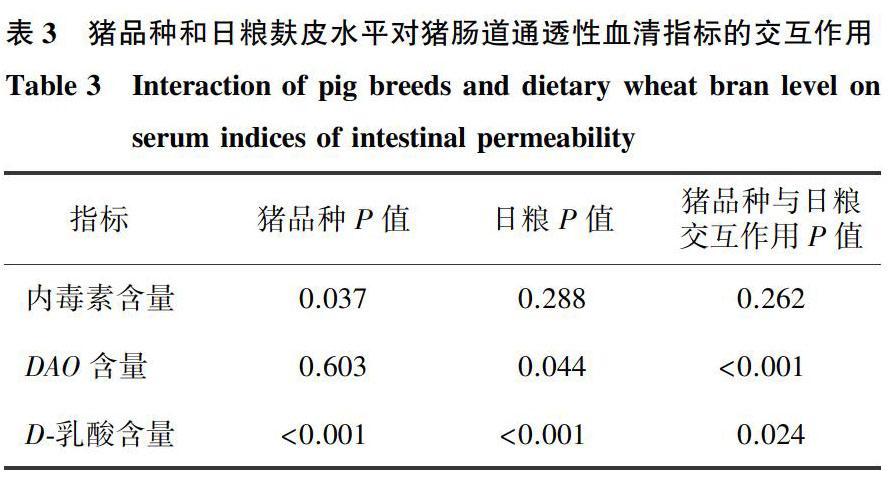
由表3可知,猪品种对血清内毒素和D-乳酸含量有显著影响(P<0.05),日粮麸皮水平对血清DAO和D-乳酸含量有显著影响(P<0.05),猪品种和日粮麸皮水平的交互作用对血清DAO和D-乳酸含量有显著影响(P<0.05)。二花脸猪的内毒素含量显著低于大白猪(P<0.05),二花脸猪的D-乳酸含量显著高于大白猪(P<0.05)。与对照相比,7%和14%麸皮替代日粮处理显著提高了D-乳酸含量(P<0.05)。
由图1可知,7%麸皮替代日粮处理,二花脸猪的内毒素含量显著低于大白猪(P<0.05)。14%麸皮替代日粮处理,二花脸猪的DAO含量显著低于大白猪(P<0.05)。21%麸皮替代日粮处理,二花脸猪的DAO含量显著高于大白猪(P<0.05)。7%和14%麸皮替代日粮处理二花脸猪的D-乳酸含量均显著高于大白猪(P<0.05)。
与对照相比,二花脸猪21%麸皮替代日粮处理的DAO含量显著升高(P<0.05),二花脸猪7%和14%麸皮替代日粮处理的D-乳酸含量显著升高(P<0.05),大白猪14%麸皮替代日粮处理的DAO含量显著升高(P<0.05)。
基础日粮为对照,7%麸皮、14%麸皮、21%麸皮表示分别用7%麸皮、14%麸皮和21%麸皮替代基础日粮。*表示差异显著((P<0.05)。
2.2日粮麸皮水平对不同品种猪肠道形态学的影响
由表4可知,猪品种对盲肠隐窝深度、肠壁厚度和结肠肠壁厚度、肌层厚度有显著影响(P<0.05),日粮麸皮水平对各指标无显著影响,猪品种和日粮麸皮水平的交互作用对盲肠肠壁厚度有显著影响(P<0.05)。盲肠中,二花脸猪的隐窝深度显著低于大白猪(P<0.05),二花脸猪的肠壁厚度显著大于大白猪(P<0.05)。结肠中,二花脸猪的肠壁厚度显著大于大白猪(P<0.05),二花脸猪的肌层厚度显著低于大白猪(P<0.05)。
由图2可知,盲肠中,7%麸皮替代日粮处理二花脸猪的肠壁厚度显著高于大白猪(P<0.05),21%麸皮替代日粮处理二花脸猪的肠壁厚度显著低于大白猪(P<0.05)。与对照组相比,二花脸猪21%麸皮替代日粮处理的盲肠肠壁厚度显著降低(P<0.05),7%麸皮替代日粮处理的盲肠肌层厚度显著升高(P<0.05)。大白猪14%和21%麸皮替代日粮处理的盲肠肠壁厚度显著高于对照(P<0.05)。
2.3日粮麸皮水平对不同品种猪肠道微生物丰度的影响
由表5可知,猪品种对空肠双歧杆菌、结肠大肠杆菌和结肠乳酸杆菌丰度有显著影响(P<0.05),日粮麸皮水平对结肠大肠杆菌丰度有显著影响(P<0.05)。猪品种和日糧麸皮水平的交互作用对空肠双歧杆菌、结肠总菌和结肠大肠杆菌丰度有显著影响(P<0.05)。二花脸猪的空肠双歧杆菌和结肠乳酸杆菌丰度显著低于大白猪(P<0.05),二花脸猪的结肠大肠杆菌丰度显著高于大白猪(P<0.05)。结肠中,7%、14%和21%麸皮替代日粮处理的大肠杆菌丰度均显著低于对照(P<0.05)。
由图3可知,二花脸猪空肠乳酸杆菌丰度在基础日粮对照中显著高于大白猪(P<0.05),双歧杆菌丰度在各麸皮替代日粮处理中均显著低于大白猪(P<0.05)。大白猪空肠双歧杆菌丰度在7%、14%麸皮替代日粮处理中均显著低于对照组(P<0.05)。
由图4可知,基础日粮对照中二花脸猪结肠总菌丰度显著高于大白猪(P<0.05),乳酸杆菌丰度显著低于大白猪(P<0.05);在7%麸皮替代日粮处理中,二花脸猪结肠总菌丰度显著低于大白猪(P<0.05),大肠杆菌丰度显著高于大白猪(P<0.05);在21%麸皮替代日粮处理中,二花脸猪结肠总菌和乳酸杆菌丰度均显著低于大白猪(P<0.05),大肠杆菌丰度显著高于大白猪(P<0.05)。
基础日粮为对照,7%麸皮、14%麸皮、21%麸皮表示分别用7%麸皮、14%麸皮和21%麸皮替代基础日粮。*表示差异显著((P<0.05)。
与基础日粮对照相比,二花脸猪结肠总菌丰度在21%麸皮替代日粮处理中显著降低(P<0.05),大肠杆菌丰度在14%麸皮替代日粮处理中显著降低(P<0.05),乳酸杆菌丰度在7%麸皮替代日粮处理中显著升高(P<0.05);大白猪总菌丰度在7%、21%麸皮替代日粮处理中显著升高(P<0.05),大肠杆菌丰度在各麸皮替代日粮处理中均显著降低(P<0.05),乳酸杆菌丰度在14%麸皮替代日粮处理中显著降低(P<0.05)。
3讨论
3.1日粮麸皮水平对不同品种猪肠道通透性血清指标的影响
肠黏膜屏障的完整对防御病原菌十分必要[15],肠黏膜屏障的损伤会增加肠黏膜通透性。血清中多种因子与肠黏膜屏障功能相关,包括内毒素、DAO和D-乳酸含量[16-17]。内毒素是大肠杆菌的分泌物之一,它在血清中的含量随着肠黏膜损伤和肠道通透性的增加而增加[18]。DAO仅存在于小肠上部绒毛中,其浓度的增加表明肠上皮通透性增加或肠屏障功能受损[19]。D-乳酸是肠道细菌的最终产物,哺乳动物既不产生D-乳酸,也不产生D-乳酸脱氢酶。因此,它们在健康状态下维持在较低水平,当肠黏膜完整性受损时,几乎所有的D-乳酸都会释放到血液中。因此,血清内毒素、DAO和D-乳酸可以作为评估肠黏膜损伤和修复程度的标志物[20]。本研究结果表明,二花脸猪的内毒素含量低于大白猪,二花脸猪的D-乳酸含量高于大白猪,说明肠道通透性血清学指标在品种间存在一定差异。7%和14%麸皮替代日粮处理提高了D-乳酸含量,由此可见,麸皮水平的增加会增加肠道通透性,从而增加血清中标记物的浓度。二花脸猪7%和14%麸皮替代日粮处理提高了D-乳酸含量,14%麸皮替代日粮处理提高了大白猪的DAO含量,说明日粮中麸皮水平对肠道通透性的影响存在明显的品种差异。
基础日粮为对照,7%麸皮、14%麸皮、21%麸皮表示分别用7%麸皮、14%麸皮和21%麸皮替代基础日粮。*表示差异显著((P<0.05)。
基础日粮为对照,7%麸皮、14%麸皮、21%麸皮表示分别用7%麸皮、14%麸皮和21%麸皮替代基础日粮。*表示差异显著((P<0.05)。
3.2日粮麸皮水平对不同品种猪肠道形态学的影响
完整的形态结构对肠道保持营养物质的分泌、消化和吸收能力非常重要。由于纤维主要在大肠中发酵,可能主要对大肠的形态产生影响,所以本试验只测定了盲肠和结肠形态。Ngcc等[21]发现猪品种间肠道形态有显著差异,与长大杂交猪相比,Mong Cai猪回肠的绒毛高度更短,绒毛宽度更小,隐窝密度也更高。二花脸猪和大白猪盲肠隐窝深度、肠壁厚度和结肠肠壁厚度、肌层厚度有差异。这种差异可能与品种本身,以及品种间食糜转运时间和肠道微生物活性的差异有关[22]。
Jin等[23]发现日粮添加10%小麦秸杆饲喂育肥猪2周后结肠隐窝深度增加。Thomsen等[24]发现日粮中添加燕麦壳提高了育肥猪结肠隐窝深度。但本研究发现麸皮替代部分日粮没有影响二花脸猪和大白猪的盲肠、结肠隐窝深度,这与Petkevicius等[25]研究结果一致。这些结果的差异可能是试验使用的纤维源中可溶性成分和木质化程度的不同导致的。另一个因素可能是动物的日龄,Jin等[23]研究中的试验猪体质量为(14.3±1.2) kg,而本研究中的二花脸猪约40 kg,大白猪约65 kg,因此可能是因为大日龄猪的肠道形态相比于幼龄猪更不易受营养因素的影响。
肠壁增厚会降低营养物质的吸收和转运,影响动物的生长速度。本研究发现14%和21%麸皮替代日粮处理增加了大白猪盲肠肠壁厚度,而二花脸猪盲肠肠壁厚度在各麸皮替代水平均没有增加。由此可见,二花脸猪肠壁厚度在高纤维水平下耐受能力更强。肌层厚度增加有利于食糜中纤维与微生物混合,提高微生物发酵机会,从而提高日粮纤维利用率。本试验结果表明7%麸皮替代日粮增加了二花脸猪盲肠肌层厚度,更有利于纤维发酵利用,可能是应对纤维水平增高的适应性改变。
3.3日粮麸皮水平对不同品种猪肠道微生物丰度的影响
肠道微生物主要分布在肠腔内流动食糜中,且黏附于肠道黏膜及相关的黏膜层,发挥营养物质代谢调控、肠道上皮细胞修复、肠道黏膜免疫激活、宿主行为调控、抵抗病原微生物等重要作用[26-29]。康润敏等[30]研究发现3个品种猪盲肠内微生物菌群分布规律和数量存在显著差异。本试验同样发现,二花脸猪和大白猪空肠双歧杆菌、结肠大肠杆菌和乳酸杆菌丰度有差异。
日粮纤维可以在猪肠道内发酵以改善肠道微生物菌群结构,减少肠道疾病的产生并对猪的健康状况有改善作用[31-32]。在小鼠日粮中添加10%和20%米糠显著改善了沙门氏菌感染引起的肠道损伤,增加了乳酸杆菌增殖[33]。添加10%米糠可提高断奶仔猪饲料利用率,并有利于肠道双歧杆菌的定殖[34]。本试验研究结果与之一致,麸皮替代基础日粮处理降低了结肠中大肠杆菌丰度,说明麸皮有助于改善肠道健康。同时发现7%麸皮替代日粮处理增加了二花脸猪结肠乳酸杆菌丰度,14%麸皮替代日粮处理降低了二花脸猪结肠大肠杆菌丰度,表明麸皮替代部分日粮改善了肠道菌群比例,可增加肠道中有益菌群如乳酸杆菌等的优势。对于大白猪,大肠杆菌丰度在各麸皮替代处理中均显著降低,但是14%麸皮替代日粮处理降低了大白猪空肠双歧杆菌和结肠乳酸杆菌等有益菌丰度,这种肠道微生物对添加麸皮反应的差异可能与猪品种有关。
4结论
大白猪和二花脸猪在大肠形态、肠道通透性、空肠双歧杆菌丰度、结肠大肠杆菌和乳酸杆菌丰度等方面存在差异,日粮麸皮水平影响结肠大肠杆菌丰度。7%麸皮替代水平增大二花脸猪肠道通透性,但增加盲肠肌层厚度以适应纤维的消化,并增加结肠乳酸杆菌丰度促进肠道健康。14%麸皮替代水平会导致大白猪肠道通透性增大,盲肠肠壁增厚,空肠双歧杆菌和结肠乳酸杆菌丰度降低。
參考文献:
[1]JHA R, BERROCOSO J D. Review: Dietary fiber utilization and its effects on physiological functions and gut health of swine [J]. Animal, 2015, 9(9): 1441-1452.
[2]MAKKAR H. Review: Feed demand landscape and implications of food-not feed strategy for food security and climate change [J]. Animal, 2017, 12: 1-11.
[3]ZHAO J, ZHANG S, XIE F, et al. Effects of inclusion level and adaptation period on nutrient digestibility and digestible energy of wheat bran in growing-finishing pigs [J]. Asian-Australas J Anim Sci, 2018, 31(1): 116-122.
[4]NOBLET J, GOFF G I. Effect of dietary fibre on the energy value of feeds for pigs [J]. Animal Feed Science and Technology, 2001, 90: 35-52.
[5]HOLSCHER H. Dietary fiber and prebiotics and the gastrointestinal microbiota [J]. Gut Microbes, 2017, 8: 172-184.
[6]GRIZARD D, BARTHOMEUF C. Non-digestible oligosaccharides used as prebiotic agents: Mode of production and beneficial effects on animal and human health [J]. Reproduction, Nutrition, Development, 1999, 39: 563-588.
[7]WEGH C, SCHOTERMAN M, VAUGHAN E, et al. The effect of fiber and prebiotics on childrens gastrointestinal disorders and microbiome [J]. Expert Review of Gastroenterology & Hepatology, 2017, 11: 97-105.
[8]URRIOLA P, STEIN H. Comparative digestibility of energy and nutrients in fibrous feed ingredients fed to Meishan and Yorkshire pigs [J]. Journal of Animal Science, 2012, 90: 802-812.
[9]KEMP B, HARTOG L A, KLOK J, et al. The digestibility of nutrients, energy and nitrogen in the Meishan and Dutch Landrace pig [J]. Journal of Animal Physiology and Animal Nutrition, 1991, 65: 263-266.
[10]KANENGONI A T, DZAMA K, CHIMONYO M, et al. Influence of level of maize cob meal on nutrient digestibility and nitrogen balance in Large White, Mukota and LW × M F 1 crossbred pigs [J]. Animal Science, 2016, 74(1): 127-134.
[11]STERN S, SOLANES F X. Estimated mature weights and growth curves for large white sows [J]. Acta Agriculturae Scandinavica Section A, Animal Science, 2001, 51(2): 142-147.
[12]FIERER N, JACKSON J A, VILGALYS R, et al. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays [J]. Appl Environ Microbiol, 2005, 71(7): 4117-4120.
[13]CASTILLO M, MARTIN-ORUE S M, MANZANILLA E G, et al. Quantification of total bacteria, enterobacteria and lactobacilli populations in pig digesta by real-time PCR [J]. Vet Microbiol, 2006, 114(1/2): 165-170.
[14]FURET J P, FIRMESSE O, GOURMELON M, et al. Comparative assessment of human and farm animal faecal microbiota using real-time quantitative PCR [J]. FEMS Microbiol Ecol, 2009, 68(3): 351-362.
[15]LAKSHMI C, GHIM J, RYU S. Mechanisms regulating intestinal barrier integrity and its pathological implications [J]. Experimental & Molecular Medicine, 2018, 50: 103.
[16]劉伟,王晓红,杨晓军,等. 脓毒症患者肠屏障功能损伤及其相关因素 [J]. 中华医学杂志, 2016, 96( 44 ): 3568-3572.
[17]TAKIISHI T, MORALES C, CMARA N. Intestinal barrier and gut microbiota: Shaping our immune responses throughout life [J]. Tissue Barriers, 2017, 5(4): e1373208.
[18]SMITH F, CLARK J E, OVERMAN B L, et al. Early weaning stress impairs development of mucosal barrier function in the porcine intestine [J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298(3): 352-363.
[19]MANZOTTI G, BREDA D, DI GIOACCHINO M, et al. Serum diamine oxidase activity in patients with histamine intolerance [J]. Int J Immunopathol Pharmacol, 2016, 29(1): 105-111.
[20]FUKUDOME I, KOBAYASHI M, DABANAKA K, et al. Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5-fluorouracil treatment in rats [J]. Med Mol Morphol, 2014, 47(2): 100-107.
[21]NGCC T, TRAN H, LEN N, et al. Effect of fibre level and fibre source on gut morphology and micro-environment in local (Mong Cai) and exotic (Landrace×Yorkshire) pigs [J]. Asian-Australasian Journal of Animal Sciences, 2012, 25: 1726-1733.
[22]FREIRE J, DIAS R, CUNHA L, et al. The effect of genotype and dietary fibre level on the caecal bacterial enzyme activity of young piglets: Digestive consequences [J]. Animal Feed Science and Technology, 2003, 106: 119-130.
[23]JIN L, REYNOLDS L P, REDMER D A, et al. Effects of dietary fiber on intestinal growth, cell proliferation, and morphology in growing pigs [J]. J Anim Sci, 1994, 72(9): 2270-2278.
[24]THOMSEN L E, KNUDSEN K E, HEDEMANN M S, et al. The effect of dietary carbohydrates and Trichuris suis infection on pig large intestine tissue structure, epithelial cell proliferation and mucin characteristics [J]. Vet Parasitol, 2006, 142(1/2): 112-122.
[25]PETKEVICIUS S, BACH KNUDSEN K E, MURRELL K D. Effects of Oesophagostomum dentatum and dietary carbohydrates on morphology of the large intestine of pigs [J]. Vet Parasitol, 2003, 116(2): 125-138.
[26]向明,李媛媛,郭乾鹏,等. 屎肠球菌对哺乳期仔猪结肠微生物群落优势门属的影响[J].南方农业学报,2019,50(3):477-484.
[27]张铮,石青松,朱伟云,等. 乳酸菌发酵饲料对断奶仔猪生长性能和肠道健康的影响[J]. 江苏农业科学,2018,46(19):170-173.
[28]冯士彬,程连平,舒迎霜,等. 黄芪多糖对湖羊羔羊生长性能、血清指标、消化功能和直肠菌群的影响[J].江苏农业学报, 2019, 35(1):122-129.
[29]方雷,陈根元,刘利林,等. 新疆驴盲肠、腹结肠、背结肠固相食糜细菌多样性研究[J]. 江苏农业科学,2019,47(8):176-178.
[30]康润敏,李瑶,吕学斌,等. 利用16S rDNA扩增子测序技术分析不同品种猪盲肠微生物菌落多样性 [J]. 中国畜牧兽医, 2017, 44:3121-3129.
[31]YU C, ZHANG S, YANG Q, et al. Effect of high fibre diets formulated with different fibrous ingredients on performance, nutrient digestibility and faecal microbiota of weaned piglets [J]. Arch Anim Nutr, 2016, 70(4): 263-277.
[32]CHEN H, CHEN D, QIN W, et al. Wheat bran components modulate intestinal bacteria and gene expression of barrier function relevant proteins in a piglet model [J]. Int J Food Sci Nutr, 2017, 68(1): 65-72.
[33]KUMAR A, HENDERSON A, FORSTER G M, et al. Dietary rice bran promotes resistance to Salmonella enterica serovar Typhimurium colonization in mice [J]. BMC Microbiol, 2012, 12: 71.
[34]HERFEL T, JACOBI S, LIN X, et al. Stabilized rice bran improves weaning pig performance via a prebiotic mechanism [J]. J Anim Sci, 2013, 91(2): 907-913.
(責任编辑:张震林)
