寒旱区不同生态型艾活性物质含量、抗氧化能力及挥发性组分比较分析
2020-07-21张真蔺海明杜弢刘孜瀚汉丽娟栗孟飞
张真,蔺海明,2,杜弢,刘孜瀚,汉丽娟,栗孟飞
(1.甘肃农业大学生命科学技术学院,干旱生境作物学重点实验室,甘肃 兰州 730070;2.甘肃省老教授协会,甘肃 兰州 730070;3.甘肃中医药大学药学院,甘肃 兰州 730000;4.甘肃百草中药材种植有限公司,甘肃 兰州 730102;5.榆中县人才交流服务中心,甘肃 兰州 730100)
艾(ArtemisiaargyiLevl.et Van)为菊科(Compositae)蒿属(Artemisia)多年生草本植物,主产湿润与半湿润地区,如河南南阳市、湖北蕲春县[1].艾叶是我国常用中药,历史悠久,早在《神农本草经》既有记载,具有温经止血、散寒止痛、祛湿止痒等功效,常用于治疗吐血、衄血、崩漏、月经过多、胎漏下血、少腹冷痛、经寒不调、宫冷不孕等症[1-2].现代药理学研究表明,艾叶具有抗菌、抗病毒、止血与抗凝血、抗肿瘤、抗过敏、抗氧化、镇静催眠、保肝利胆等作用[3].化学分析发现,艾叶中主要含有挥发油(如蒎烯、水芹烯、1,8-桉叶素等)、黄酮类(如槲皮素、山萘酚、木犀草素等)、三萜类(如α-香树脂、β-香树脂、羽扇烯酮等)、桉叶烷类(如柳杉二醇、魁蒿内酯、1-氧-4β-乙酰氧基桉叶-2,11 ( 13) -二烯-12,8β内酯)、酚类(如绿原酸、朝鲜蓟酸、间羟基安息香酸等)、多糖以及微量元素等[3-5].
基于艾叶在药用、食用、日化等方面的广泛用途,以及随着大健康产业的快速发展,需求量与日俱增,促使人工种植迅速发展,已形成了标准化的人工栽培技术[6].我国艾种质资源丰富,菊科蒿属艾组植物在我国有55 种,9变种,隶属于16 个系中[1].艾生态适应能力极强,产地分布极广,除极干旱与高寒地区外,几乎遍及全国,生于低海拔至中海拔地区的荒地、路旁河边及山坡等地[7].课题组在前期深入调查研究的基础上发现,我省艾野生资源丰富,尽管为我国中药材资源大省和生产大省,但艾尚无大面积栽培;为了助力我省精准脱贫,课题组联合甘肃百草中药材种植有限公司,结合榆中县北山寒旱区优势资源(如光照充足、气候寒旱、病虫害少等),通过初期引种栽培,全面分析和论证了发展绿色有机艾产业的可行性[8].
很多研究已表明,药用植物的品质形成受遗传因子(内因)和环境因子(外因)共同作用的影响[9].为了筛选适宜于寒旱区生态环境下的艾种质资源,本研究引种3个不同生态型(甘肃陇原、河南南阳市、湖北蕲春县)的艾种质,栽培于榆中县北山寒旱区,给予同一原生境生长环境,通过比较与分析艾叶中主要活性物质含量、抗氧化能力及挥发性组分,旨在探明寒旱区生态环境对不同生态型艾品质形成的影响,为进一步的规模化种植提供直接的依据.
1 材料与方法
1.1 试验材料
艾植株于2017年4月引种自3个不同生态产地(甘肃陇原区域、河南南阳市和湖北蕲春县),种植于甘肃百草中药材种植有限公司黄蒿湾万亩陇原艾产业园(榆中县黄蒿湾村,海拔2 280 m,年平均气温7 ℃,降雨量230 mm,无霜期145 d),原生境条件下生长,于2018年8月采集叶片,自然条件下阴干,研磨至粉末.
1.2 提取液的制备
将3.0 g粉末置于30 mL无水乙醇中,置于摇床振荡提取(28℃、120 r/min)24 h后,室温静置2 h,收集上清液,连续提取3次后,合并提取液,在4℃、8 000 r/min下离心10 min,上清液经减压浓缩(500 mbar、70 ℃、150 r/min)至小体积,用超纯水溶解并定容至100 mL;用乙酸乙酯(1∶1,V/V)连续萃取3次后,合并萃取相并减压浓缩(500 mbar、50 ℃、150 r/min)至小体积;萃余相用正丁醇(1∶1,V/V)连续萃取3次后,合并萃取相并减压浓缩(500 mbar、80℃、150 r/min)至小体积;乙酸乙酯和正丁醇萃取所得浓缩液分别用甲醇定容至9 mL,并用0.22 μm微孔滤膜过滤,用于活性物质含量、抗氧化能力以及挥发性组分测定与分析.
1.3 测定指标及方法
1.3.1 可溶性糖含量的测定采用硫酸-苯酚法测定可溶性总糖含量,参考Dubois等[10]和张真等[11]的方法测定.其中,萃取液样品加样量为2 μL,可溶性糖的含量以蔗糖为标准品标定,标准曲线回归方程C(μg) =30.91A-0.55 (R2=0.99).
1.3.2 黄酮类含量的测定采用亚硝酸钠-硝酸铝-氢氧化钠法测定黄酮类化合物的含量,参考张真等[11]和Ma等[12]的测定方法.其中,萃取液样品加样量为200 μL,黄酮类化合物的含量以儿茶素为标准品标定,标准曲线方程C(μg)= 203.15A-5.26 (R2=0.99).
1.3.3 酚类含量的测定采用福林酚试剂法测定酚类化合物的含量,参考张真等[11]和Beato等[13]的测定方法.其中,萃取液样品加样量为50 μL,酚类化合物的含量以没食子酸标准品标定,标准曲线方程C(μg) =32.67A+0.78 (R2=0.99).
1.3.4 抗氧化能力的测定 采用DPPH(1,1-diphenyl-2-picrylhydrazyl)和铁离子还原/氧化能力(ferric reducing/antioxidant power,FRAP)两种方法测定提取液的抗氧化能力.
DPPH法参考Nencini等[14]和Li等[15]的方法测定.其中,萃取液样品加样量为400 μL,抑制率的计算公式为:抑制率(%)=[(A0-A)/A0]×100%,式中,A为样品溶液的吸光值,A0为不加样品溶液的吸光值.
FRAP法参考张真等[11]、Li等[15]和Benzie等[16]的方法测定.其中,萃取液样品加样量为50 μL,样品溶液的抗氧化能力以500 μmol/L Fe2+(FeSO4·7H2O) 为参比基础,FRAP值计算公式为:
FRAP值 (μmol/L) =[(A-A0)/ (AFeSO4·7H2O-A0)] × 500 (μmol/L)
式中,A为样品溶液的吸光值,AFeSO4·7H2O为FeSO4·7H2O溶液的吸光值,A0为不加样品溶液的吸光值.
1.3.5 GC-MS分离与鉴定GC条件:仪器型号:Agilent 7890B-7000D(美国 Agilent Technologies Inc.),非极性石英毛细管柱(30 m×0.25 mm×0.25 μm),柱温50 ℃;升温程序:5 ℃/min,升温至200 ℃,然后以6 ℃/min的速率升温至300 ℃并保持6 min;载气为氦气,流量1 mL/min;进样量4 μL,不分流.MS条件:EI离子源,离子源温度230 ℃,进样口温度280 ℃,四极杆温度150 ℃;电子能量70 eV,质子扫描范围35~400 M/Z;发射电流100 μA,电压1.4 kV.
1.4 数据分析
每个试验重复3次,采用Microsoft Office Excel 2007软件作图,SPSS 11.5软件进行One-Way ANOVA Duncan数据差异显著性分析.
2 结果与分析
2.1 不同生态型艾叶中可溶性糖、总黄酮和酚类含量比较
通过对不同生态型艾叶正丁醇和乙酸乙酯萃取液中可溶性糖、总黄酮和酚类含量进行测定与分析,结果如图1所示.可溶性糖含量在正丁醇萃取液中以南艾和蕲艾较高,在乙酸乙酯萃取液中以陇艾和蕲艾较高,2种萃取液总含量在南艾中最高(11.1 mg/g,以干物质质量计),分别为陇艾和蕲艾的1.4和1.1倍(图1-A);3个生态型艾总黄酮含量在正丁醇萃取液中无显著差异,在乙酸乙酯萃取液中陇艾显著高于蕲艾和南艾,2种萃取液总含量在陇艾中最高(209.8 mg/g,以干物质质量计),分别为南艾和蕲艾的1.5和1.2倍(图1-B);总酚含量在陇艾正丁醇和乙酸乙酯萃取液中均显著高于南艾和蕲艾,2种萃取液总含量在陇艾中达到14.6 mg/g(以干物质质量计),分别为南艾和蕲艾的1.5和1.7倍(图1-C).
2.2 不同生态型艾叶抗氧化能力比较
通过对不同生态型艾叶正丁醇和乙酸乙酯萃取液抗氧化能力进行测定与分析,结果如图2所示.自由基抑制率在陇艾正丁醇和乙酸乙酯萃取液中分别为59.8%和94.1%,均显著高于南艾和蕲艾,两种萃取液总抑制率分别为南艾和蕲艾的1.21和1.24倍(图2-A);铁离子还原/氧化能力在正丁醇萃取液中以南艾最高,陇艾和蕲艾之间无显著差异,在乙酸乙酯萃取液中则以陇艾最高,南艾和蕲艾之间无显著差异,两种萃取液总铁离子还原/氧化能力在陇艾达到9 483.2 μmol/L,分别为南艾和蕲艾的2.1和2.2倍(图2-B).
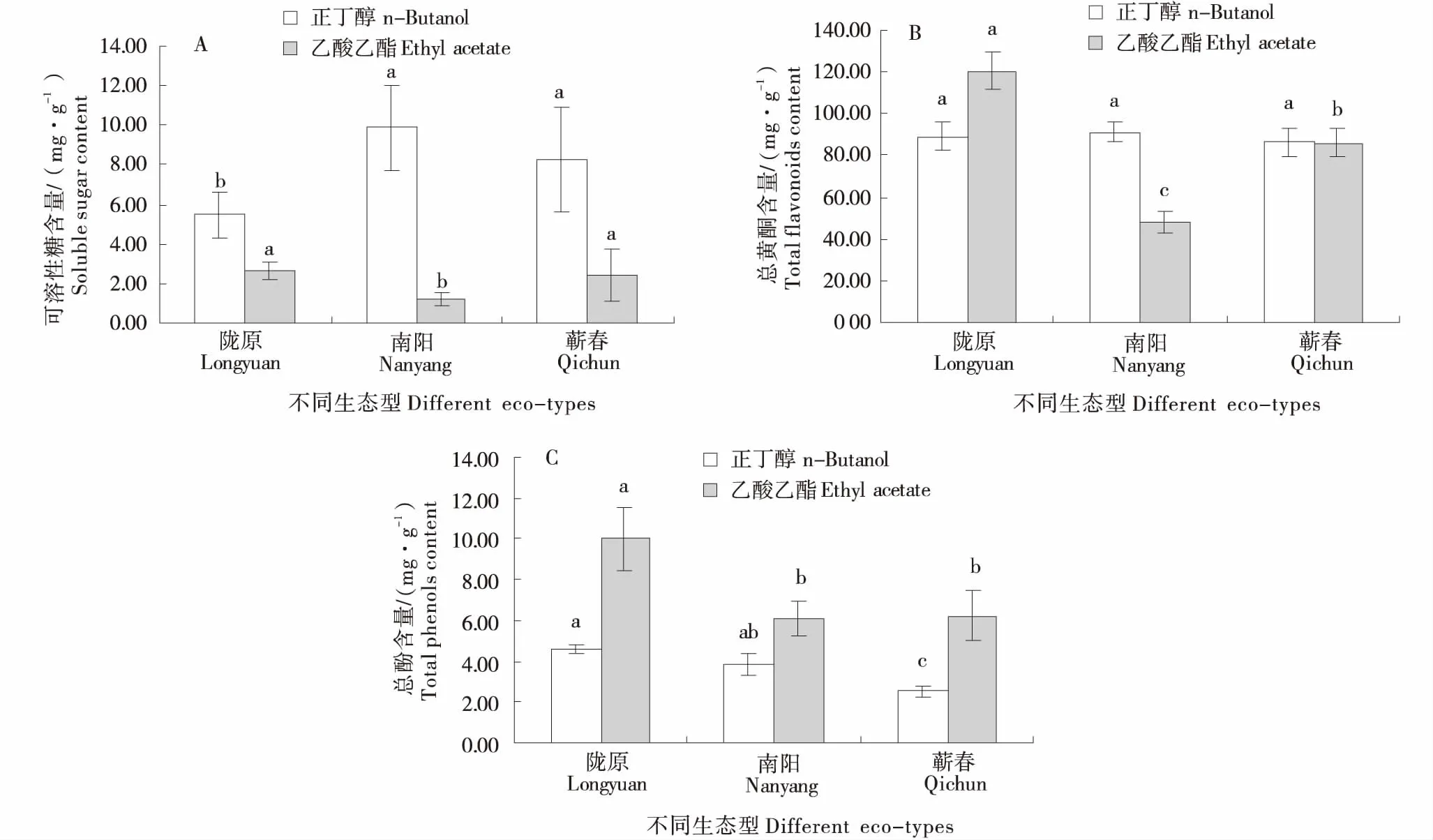
不同小写字母表示在同一萃取液中差异显著(P<0.05).Different lowercase indicated significant at the same extracts at P<0.05 level.图1 不同生态型艾叶中可溶性糖(A)、总黄酮(B)和酚类(C)含量的比较Figure 1 Comparison of contents of soluble sugar (A),total flavonoids (B) and phenols (C) in different eco-types of Artemisia argyi
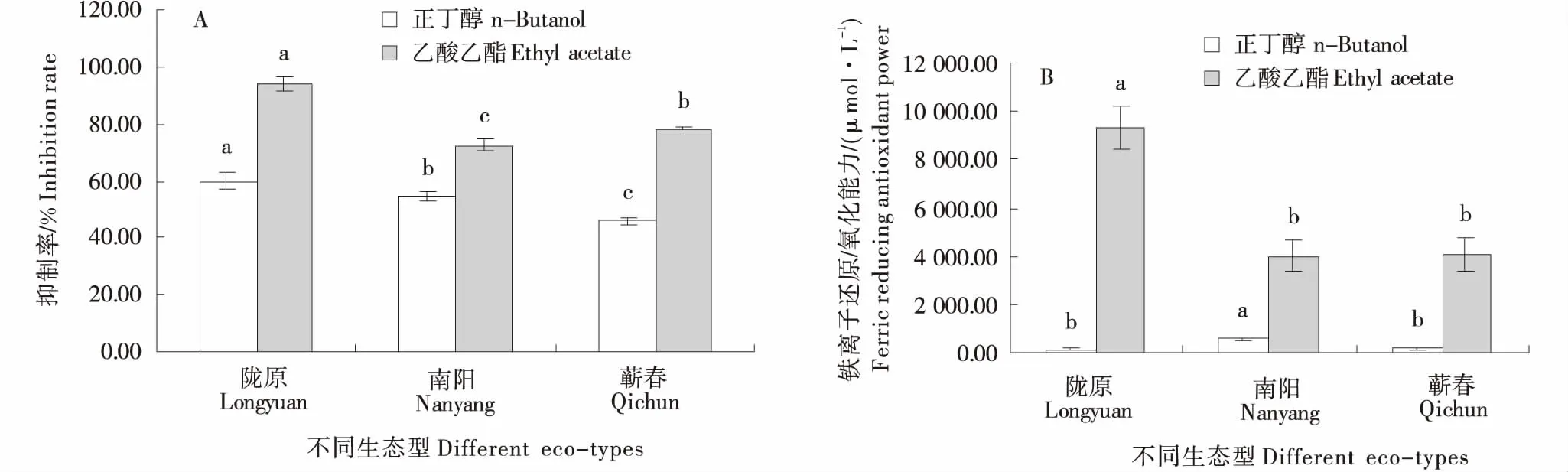
不同小写字母表示在同一萃取液中差异显著(P<0.05).Different lowercase indicated significant at the same extracts at P<0.05 level.图2 不同生态型艾叶中自由基抑制率和铁离子还原/氧化能力的比较Figure 2 Comparison of free radical inhibition rate (A) and ferric reducing antioxidant power (B) in different eco-types of Artemisia argyi
2.3 不同生态型艾叶挥发性组分比较
通过对不同生态型艾叶正丁醇和乙酸乙酯萃取液进行GC-MS分离鉴定,结果分别见表1~2.表1结果显示,3种生态型艾叶正丁醇萃取液中共含有190个挥发性组分,其中陇艾、南艾和蕲艾叶中分别含有97、90和91个,有23个化合物在3种生态型艾叶中共同存在,包括1-Octen-3-ol、Eucalyptol和α-Terpineol等.在所分离鉴定出的190个化合物中,38个已在前人研究中报道,包括 1-Octen-3-ol、Eucalyptol和Thujone等.表2结果显示,3种生态型艾叶乙酸乙酯萃取液中共含有132个挥发性组分,其中陇艾、南艾和蕲艾叶中分别含有80、71和25个,有4个化合物在3种生态型艾叶中共同存在,分别为2,4-Di-tert-butylphenol、Ethanol,2-(9-octadecenyloxy)-,(Z)-、Hexadecanoic acid,ethyl ester和9-Desoxo-9-x-acetoxy-3,8,12-tri-O- acetylingol.在所分离鉴定出的132个化合物中,26个已在前人研究中报道,包括1-Octen-3-ol、Eucalyptol和1,5-Heptadien-4-ol,3,3,6-trimethyl等.
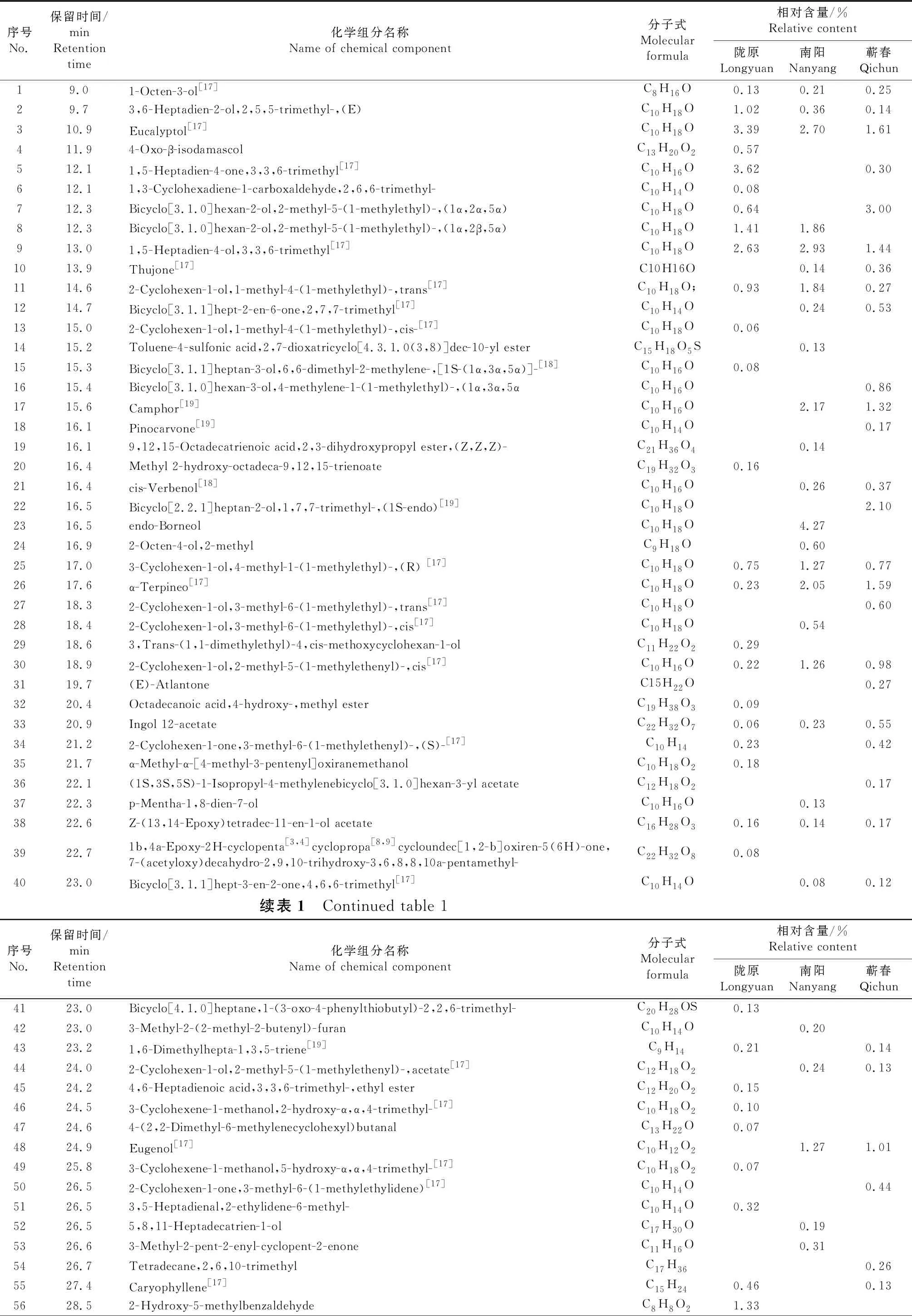
表1 不同生态型艾叶正丁醇萃取液中挥发性组分GC-MS分离与鉴定
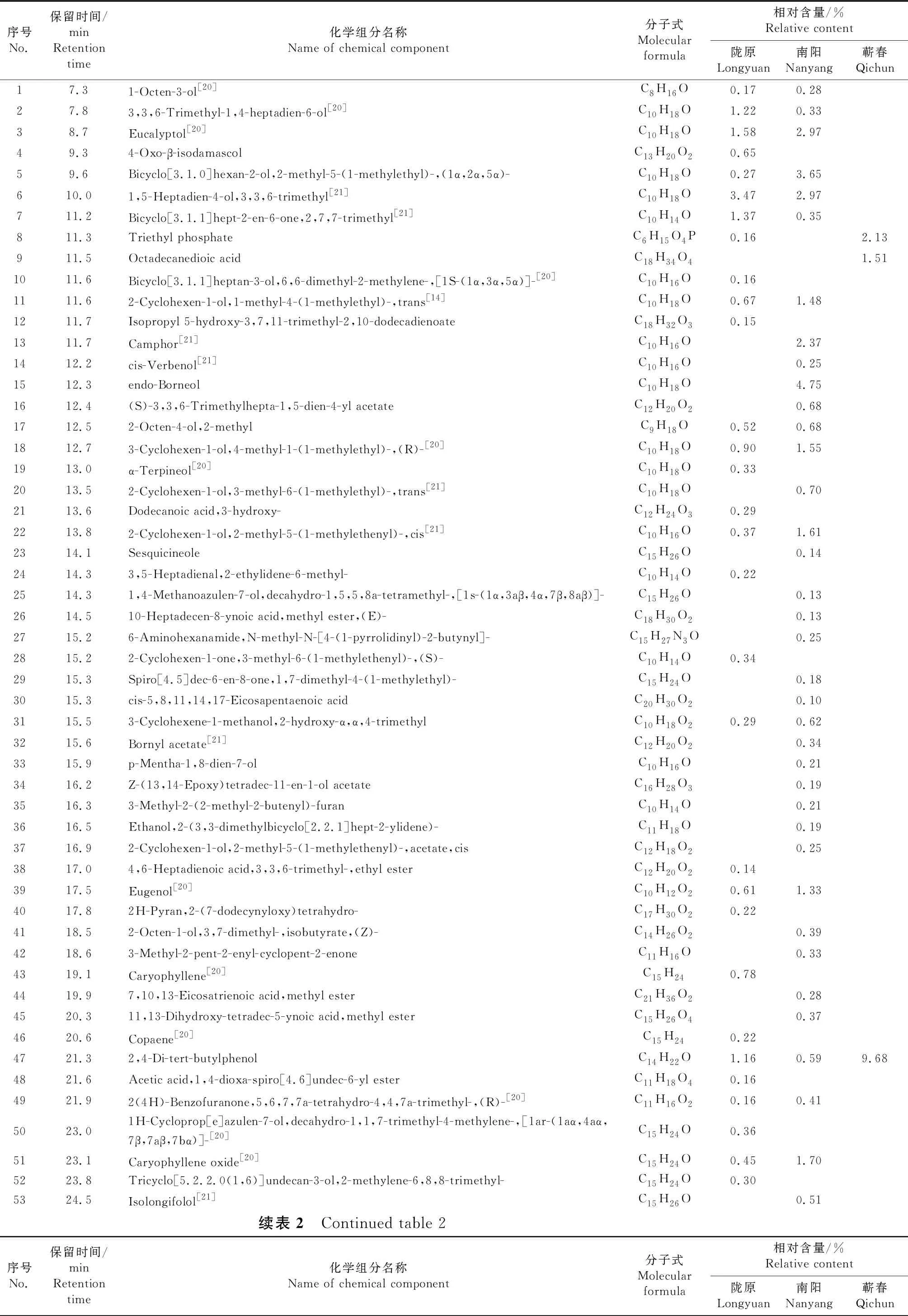
表2 不同生态型艾叶乙酸乙酯萃取液中挥发性组分GC-MS分离与鉴定结果
3 讨论
药材在长期的栽培和人工选育过程中形成了不同的品种或农家类型,其内在品质往往受种质资源的影响,差异较大[9].同时,构成品质形成的代谢产物,如多糖类、萜类、生物碱类、苯丙烷类等,易受到生长环境的调控[22].通过对中国和韩国30个不同产地(湖南、浙江、福建、江苏、广西、四川、陕西、贵州、河北、河南、湖北、韩国首尔等)艾叶中挥发油、总黄酮和鞣质的含量以及出绒率进行检测,发现不同产地艾叶中挥发油、总黄酮、鞣质含量均存在一定的差异[23].通过对10个不同产地(河北、安徽、河南、甘肃、江西、广西、陕西、山东、湖北、四川)艾叶中总酚酸含量进行比较,发现不同产地总酚酸的含量存在一定的差异[24].通过对5个不同产地(江苏南通、湖北蕲春、浙江台州、云南楚雄、新疆乌鲁木齐)艾叶中挥发油组分进行分析,发现不同产地艾叶挥发性成分也存在一定差异[21].以上前人研究结果充分说明,种质资源和生长环境对代谢产物积累具有重要的影响.
本研究通过将3个不同生态型(甘肃陇原、河南南阳和湖北蕲春)的艾种质资源引种至同一寒旱区生长环境,发现艾叶中可溶性糖、总黄酮和总酚含量、总抗氧化能力以及挥发性组分均存在一定的差异,除可溶性糖之外,陇艾叶中总黄酮和总酚含量、总抗氧化能力以及挥发性组分数量均高于南艾和蕲艾.既然3个生态型艾处于同一生境,那么产生差异的可能原因主要有以下两个方面:第一方面,种质资源之间的差异造成了品质形成的差异.目前,尽管《中国药典》(2015)规定艾的基原植物品种为菊科植物艾Artemisia argyi Levl.et Vant[2],但是在全国各地作为艾使用或混用的品种较多[1].长期的人工种植栽培,以及与野生资源的混合生长,促生了种间杂交或变异等.第二方面,陇艾长期生长于寒旱区的生态环境,使得其短时间内较其他种源具有较强的寒旱区适应能力,表现为品质优于南艾和蕲艾;尽管前人报道称,蕲艾叶中总酚酸、挥发油、总黄酮和鞣质的含量以及出绒率均高于其他产区[21,23-24].
本研究对寒旱区3个不同生态型艾叶中活性物质含量以及抗氧化能力方面的测定与分析,表明陇艾在寒旱区有较好的品质形成能力.研究结果可以为艾种质资源选择以及引种栽培提供直接的参考依据,但是针对长期驯化后品质、产量以及其他评价指标(如桉油精含量、挥发油总量、出绒率等)是否也存在显著差异,以及不同生态型种质资源的遗传多样性,还需要进一步的深入与细致研究.
