拮抗烟草疫霉菌的木霉菌株筛选鉴定及防病促生作用研究
2020-07-18李小杰李成军姚晨虓宋瑞芳刘畅邱睿陈玉国白静科李淑君
李小杰 李成军 姚晨虓 宋瑞芳 刘畅 邱睿 陈玉国 白静科 李淑君


摘 要:为了获得对烟草黑胫病菌具有较好拮抗效果的木霉菌株,从河南省各烟区烟草根茎类病害发生较重烟田健康烟株的根际土壤中共分离获得疑似木霉菌28株,通过平板对峙培养,筛选出菌株XYPQ-1、ZMD-1和XYLS-5对烟草疫霉菌具有较强抑制作用,5 d后抑菌率达90%以上。利用分子生物学方法分别将其鉴定为绿木霉菌(Trichoderma virens)、拟康宁木霉菌(Trichoderma koningiopsis)和近渐绿木霉菌(Trichoderma paraviridescens)。对其代谢物抑菌活性及防病促生效果进行了初步研究,结果表明,3种木霉菌产生的挥发性和非挥发性代谢物均对疫霉菌具有明显的抑制作用,其中XYLS-5的抑制效果最好,处理后5 d,其挥发性和非挥发性代谢产物的抑菌率分别达61.71%和100.00%。3种木霉菌对烟草黑胫病均具有较好的室内防效,其中XYLS-5的防效最高,达80%以上,且具有促进烟草种子萌发和根系生长的作用,可作为烟草黑胫病生物防治的拮抗菌加以开发应用。
关键词:烟草黑胫病;木霉菌;拮抗作用;促生
Abstract: In order to acquire Trichoderma strains with preferable inhibitory effect on tobacco black shank, twenty-eight strains of Trichoderma were isolated from rhizosphere soil of uninfected tobacco plants in Henan province. The strains of XYPQ-1, ZMD-1 and XYLS-5 exhibiting better inhibitory effects on Phytophthora nicotianae were screened out by plate confrontation, with inhibitory rate of more than 90% after five days. Based on molecular biological analysis, the three Trichoderma strains were identified as Trichoderma virens, Trichoderma koningiopsis and Trichoderma paraviridescens, respectively. The antifungal activity of metabolites and the antagonistic effect were also studied. The results showed that both the volatile and non-volatile metabolites of the three Trichoderma spp. had inhibitory effect on P. nicotianae, and the strain XYLS-5 exhibited the optimal inhibitory effect, with its inhibition rate of volatile and non-volatile metabolites achieving 61.71% and 100.00%, respectively. The three Trichoderma strains could control tobacco black shank in greenhouse, among which strain XYLS-5 performed the optimal control efficiency exceeding 80% and could promote seed germination and root growth of tobacco. Results indicated that strain XYLS-5 can be used as antagonist for controlling tobacco black shank.
Keywords: tobacco black shank; Trichoderma; antagonism; growth promotion
由寄生疫霉煙草致病型(Phytophtora parasitica var.nicotianae Tucker)引起的烟草黑胫病是烟草生产上最具毁灭性的病害之一,目前在我国大部分烟区均有发生,其中云南、贵州、四川、湖南、湖北、重庆、河南、山东等烟区较为严重[1-2]。
随着人们对生态环境和食品安全意识的提高,烟草绿色防控理念不断深入人心,生物防治技术因其能够减少化学农药残留、降低环境污染和维护生态平衡而越来越受到重视。目前对于烟草黑胫病的生物防治,主要是运用生防因子如拮抗微生物、抗生素和植物诱导抗性因子等,其中利用生防菌株预防烟草黑胫病发生并减轻危害的报道已有很多。李小杰等[3]筛选出一株多粘芽孢杆菌,对烟草疫霉菌的抑制作用强且效果稳定,抑菌率达60.6%。彭阁等[4]筛选出5株对烟草黑胫病菌具有抑制效果的真菌,对烟草黑胫病具有较好防效。徐同伟等[5]筛选出2株芽孢杆菌能有效防治烟草黑胫病,且能促进烟苗的生长与发育。王静等[6]从黑胫病烟田健康烟株根际土壤中分离到一株对烟草黑胫病菌具有较强抑制作用的放线菌,室内防效达70%以上。
木霉属(Trichoderma spp.)是一种分布广泛、环境适应性强和抑菌谱广的丝状真菌,也是目前国内外研究应用最广泛的一类生防真菌,已被报道对多种植物病原真菌具有较好的拮抗效果[7-11],在生物防治烟草黑胫病方面也有诸多报道[4,12-14],但有关河南省防治烟草黑胫病高效木霉菌筛选鉴定及其拮抗机理研究的报道还不多[15]。
本研究从河南省各主产烟区根茎类病害发生较重烟田健康烟株的根际土壤中分离筛选出对烟草疫霉菌具有较好抑制作用的木霉菌株,并对其进行分子鉴定,初步分析其代谢物抑菌活性及对烟草黑胫病的防控和促生长效果,以期为开发微生物制剂和生物农药提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 烟草黑胫病病原为烟草疫霉菌(Phytophthora nicotianae),由本实验室(烟草行业黄淮烟区烟草病虫害绿色防控重点实验室)分离保存。
1.1.2 培养基及培养条件 烟草疫霉菌采用燕麦培养基(OA),在25 ℃黑暗条件下培养14~21 d,每皿加入灭菌的0.1%硝酸钾和1%葡萄糖溶液20 mL,继续培养3 d,诱导孢子囊产生。将培养皿放到4 ℃冰箱中30 min,促使孢子囊释放游动孢子,25 ℃放置20 min,用无菌水调整游动孢子浓度为1×104个/mL备用。木霉菌分离纯化采用马铃薯葡萄糖琼脂培养基(PDA);发酵培养采用马铃薯葡萄糖液体培养基(PDB),培养温度27 ℃,初始pH 6.0、转速180 r/min、装瓶量150 mL,发酵时间为9 d,用无菌水调整孢子浓度为1×105个/mL。
1.2 试验方法
1.2.1 烟田土壤中对烟草疫霉菌有拮抗作用的木
霉菌的分离筛选 从河南省各主产烟区烟草根茎类病害发病较重的烟田采集健康烟株根际土壤样品,参照文献[14-15],采用平板梯度稀释法,用无菌水制成10?3、10?4、10?5、10?6梯度土壤悬浮液,分别取200 μL涂布于PDA培养基上,于25 ℃培养2 d后挑取菌落边缘的菌丝,得到纯化的木霉菌,置于4 ℃冰箱保存備用。
采用平板对峙培养法[15],取活化后直径约为5 mm的烟草疫霉菌菌饼,接种至OA培养基上,在距离疫霉菌菌饼约5 cm处放置分离木霉菌菌饼,以不接种木霉菌为对照,每处理设3次重复。25 ℃恒温培养,每日测量病原菌落生长半径,观察记录木霉菌与病原菌落的相互作用情况,5 d后计算抑菌率。抑菌率(%)=(对照菌落的半径?对峙培养烟草疫霉菌落的半径)/对照菌落的半径×100%。
1.2.2 分离获得的木霉菌分子生物学鉴定 参照Ezup柱式真菌基因组DNA抽提试剂盒(上海生工)说明书,提取霉菌基因组DNA作为模板,应用真菌鉴定通用引物ITS1(5′-TCCGTAGGTGA ACCTGCGG-3′)和ITS4(5′-TCCTCCGCTT ATTGATATGC-3′)进行PCR扩增。扩增体系(25 μL)为:2×PCR Taq MasterMix 15 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,双蒸水补足到25 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,28个循环;72 ℃延伸8 min。将PCR产物进行1.0%琼脂糖凝胶电泳,观察扩增条带明亮单一后送上海英潍捷基贸易有限公司进行测序,应用NCBI(https://blast.ncbi.nlm. nih.gov/Blast.cgi)进行在线序列比对分析。选择同源性较高的序列用MEGA软件的Neighbor-Joining法构建系统发育树。
1.2.3 木霉菌挥发性代谢产物对烟草疫霉菌的抑制作用测定 采用对扣培养法[16-17],将木霉菌菌饼接种于PDA培养基中央,疫霉菌菌块接种到另一个PDA平板中央,两皿中间隔一层灭菌滤膜对扣,用封口膜密封后木霉平板正面朝上放入培养箱,以不接木霉只接疫霉菌菌块对扣作为对照。3次重复,25 ℃恒温培养,每天观察菌落生长情况,5 d后测量疫霉菌落直径并计算抑菌率。
1.2.4 木霉菌非挥发性代谢产物对烟草疫霉菌的抑制作用测定 参照文献[17],在OA平板上平铺灭菌双层滤膜(孔径0.22 μm),用无菌打孔器打取菌落边缘直径为0.5 cm的木霉菌块接入滤膜中央,25 ℃恒温培养,待木霉菌长满滤膜前,用镊子将滤膜连同木霉菌丝揭去,在原位置接入直径为0.5 cm的疫霉菌菌块。以在新的OA平板上接种疫霉菌菌块作为对照。每处理3个重复,每天观察菌落生长情况,5 d后测量疫霉菌落直径并计算抑菌率。
1.2.5 试管烟苗室内接种试验 将生长20 d的烟苗置于2 mL灭菌离心管中,每管同时加入1.5 mL木霉菌发酵液(浓度为1×105个孢子/mL)和0.5 mL烟草疫霉菌孢子悬浮液(浓度为1×104个/mL),设置3个重复,每个重复接种10株烟苗,以1.5 mL清水和0.5 mL疫霉菌孢子悬浮液的混合物为接种对照,同时以清水为空白对照。接种后观察烟株发病情况,参照国家标准GB/T 23222—2008进行分级,计算发病率和病情指数。相对防效按烟草病害药效试验方法YC/T 40—1996计算。
1.2.6 木霉菌发酵液促生作用的测定 将消毒后的烟草种子先用无菌水浸泡,再用木霉菌发酵液(浓度为1×105个孢子/mL)浸泡12 h,然后用无菌水冲洗3次,将种子置于培养皿中,脱脂棉和灭菌滤纸保湿,黑暗下催芽,48 h后统计发芽率,第11天测量烟苗的根长。另以无菌水作对照,每皿20粒种子,3次重复。
1.3 数据分析
利用DPS 7.05软件进行差异显著性检验,采用Duncan新复极差法进行多重比较。
2 结 果
2.1 烟草黑胫病拮抗木霉菌的分离和筛选
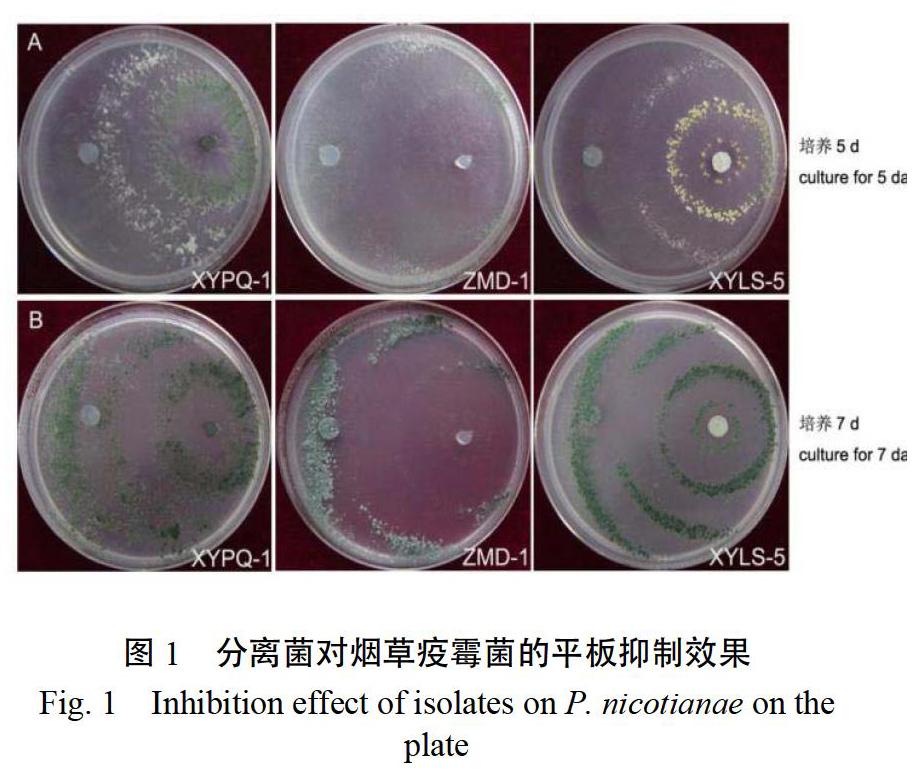
采用平板梯度稀释法从土壤样品中共分离出疑似木霉菌28株,通过平板对峙培养筛选出5株对烟草疫霉菌具有明显拮抗作用的菌株,其中编号XYPQ-1、ZMD-1和XYLS-5的菌株对疫霉菌抑制效果较好,5 d后抑菌率分别为94.81%、96.33%和97.07%(表1),7 d后将病原菌菌落全部覆盖(图1)。
2.2 木霉菌的分子生物学鉴定
以ITS1、ITS4为引物对菌株XYPQ-1、ZMD-1和XYLS-5的基因组ITS区段序列进行PCR扩增,得到大小为600 bp左右的特异性条带,测序结果显示这3个菌株的扩增片段大小分别为591、585和551 bp。通过Blast比对分析,发现与木霉属(Trichoderma)的相似性均达100%。构建的系统发育树可分为3个分支,其中菌株XYPQ-1与绿木霉菌(T. virens)位于同一进化分支,菌株ZMD-1与拟康宁木霉菌(T. koningiopsis)位于同一进化分支,菌株XYLS-5与近渐绿木霉菌(T. paraviridescens)位于同一进化分支(图2)。
2.3 木霉菌代谢产物对烟草疫霉菌的抑制作用
由表2可以看出,3株木霉菌产生的挥发性和非挥发性代谢产物对疫霉菌菌丝的生长均具有不同程度的抑制作用。其中木霉菌XYLS-5的抑制效果最好,处理后5 d,其挥发性代谢产物的抑菌率达60%以上,非挥发性代谢产物的抑菌率达到了100.00%,极显著高于其他两株木霉菌。木霉菌ZMD-1和XYPQ-1的挥发性代谢产物对疫霉菌的抑制率较低,但非挥发性代谢产物的抑菌率较高,达到50.00%以上。
2.4 木霉菌发酵液对烟草黑胫病的室内防控效果
试管苗接种试验结果表明,接种后15 d,木霉菌XYLS-5、XYPQ-1和ZMD-1发酵液处理的烟苗明显比疫霉菌对照处理的烟苗发病轻(图3),发病率和病情指数均极显著低于对照处理,防效分别可达80.47%、75.68%和51.58%(表3)。由此表明,上述3株木霉菌对烟草黑胫病具有较好的室内防效。
2.5 木霉菌发酵液对烟草种子萌发和根系生长的影响
促生试验结果表明,木霉菌XYLS-5、XYPQ-1和ZMD-1发酵液处理的烟草种子萌发率均高于清水对照,其中ZMD-1发酵液处理与对照处理之间差异达到了显著水平(图4)。3株木霉菌发酵液处理的烟苗根系明显比清水对照的根系长(图5),尤其是木霉菌XYLS-5发酵液处理与对照处理之间达到了极显著差异水平(图4)。由此表明,3株木霉菌具有较好的促生长作用。
3 讨 论
木霉属是一类十分重要的真菌,在植物根际、叶围,土壤和植物残体中均可生存。木霉屬真菌种类繁多,目前已发现有250余种(http://www. indexfungorum.org)。我国在河北、浙江、云南、辽宁、山东、西藏等地开展了木霉菌资源收集与鉴定工作,鉴定出多种木霉菌,包括顶孢木霉(T. fertile)、钩状木霉(T. hamatum)、黄绿木霉(T. aureoviride)、短致木霉(T. brevicompactun)、淡黄木霉(T. cerinum)、绿孢木霉(T. chlorosporum)、桔绿木霉(T. citrinoviride)等[18-19]。在农业方面,哈茨木霉(T. harzianum)、绿木霉(T. virens)、深绿木霉(T. atroviride)、长枝木霉(T. longibrachiatum)、拟康宁木霉(T. koningiopsis)和棘孢木霉(T. asperellum)等常被用作生防菌防治各种作物、蔬菜和水果病害[9,11,20-22]。本研究筛选出的3株对烟草疫霉菌具有较强抑制作用的木霉菌株,分别为绿木霉(T. virens)、拟康宁木霉(T. koningiopsis)和近渐绿木霉菌(T. paraviridescens),其中近渐绿木霉菌XYLS-5对烟草疫霉菌的抑制效果最好,其发酵液对烟草黑胫病的室内防效可达80%以上,且能够促进烟草种子萌发和根系生长。虽然近渐绿木霉菌被报道在我国广泛分布[23-24],但目前未见其防控植物病害的相关报道,本研究属首次报道。
本研究木霉菌的室内防效试验中采用试管苗水培接种法,结果表明此方法可使烟苗正常发病,且接种后发病时间短,影响因素单一,操作性和可重复性强,能更直观地反映烟株发病情况和木霉菌对病原菌的抑制效果,这与其他相关研究报道中常使用孢子悬浮液灌根接种法[9,21-22]有所不同。
木霉菌具有重寄生、竞争、抗生、诱导抗性和协同拮抗等多重生防机制[25-26],其中,抗生作用主要是指生防菌分泌某些次生代谢产物(如木霉素、抗菌肽、抗生素等)抑制病原菌生长。据报道[27],已从木霉中分离出具有抗生作用的代谢产物180多种。本研究对筛选出的3种拮抗木霉菌进行了代谢产物抑菌活性分析,初步证明了木霉菌挥发性和非挥发性代谢产物均具有抑菌活性,其中非挥发性代谢产物的抑菌活性最强。下一步将对非挥发性代谢产物的抑菌活性物质成分进行深入分析,为生防制剂或生物农药的研发提供新的有利资源。
4 结 论
本研究筛选出的绿木霉菌(T. virens)XYPQ-1、拟康宁木霉菌(T. koningiopsis)ZMD-1和近渐绿木霉菌(T. paraviridescens)XYLS-5对烟草疫霉菌均具有较强的抑制作用,对峙培养5 d后抑菌率达90%以上。3种木霉菌产生的代谢物均对疫霉菌具有抑制作用,且对烟草黑胫病具有较好防效,其中木霉菌XYLS-5的防效最高,且能够促进烟草种子萌发和根系生长,具有较好的生防应用前景。
参考文献
[1]李淑君. 烤烟病害[M]. 郑州:河南科学技术出版社,2018:27-31.
LI S J. Diseases on flue-cured tobacco[M]. Zhengzhou: Henan Science and Technology Press, 2018: 27-31.
[2]王凤龙,周义和,任广伟. 中国烟草病害图鉴[M]. 北京:中国农业出版社,2019:32-35.
WANG F L, ZHOU Y H, REN G W. Illustrated handbook of tobacco disease in China[M]. Beijing: China Agriculture Press, 2019: 32-35.
[3]李小杰,李成軍,刘红彦,等. 烟草疫霉菌拮抗细菌的筛选鉴定及发酵条件优化[J]. 中国烟草科学,2019,40(1):68-74.
LI X J, LI C J, LIU H Y, et al. Screening and fermentation condition optimization for antagonistic bacteria to Phytophthora nicotianae[J]. Chinese Tobacco Science, 2019, 40(1): 68-74.
[4]彭阁,姜乾坤,谭军,等. 烟草黑胫病拮抗真菌的筛选及活性评价[J]. 中国烟草科学,2018,39(1):77-84.
PENG G, JIANG Q K, TAN J, et al. Selection and field evaluation of antagonistic fungi against tobacco black shank[J]. Chinese Tobacco Science, 2018, 39(1): 77-84.
[5]徐同伟,周建云,祖庆学,等. 两株烟草黑胫病拮抗菌的筛选、鉴定和促生防病潜力评价[J]. 中国烟草科学,2017,38(3):44-50.
XU T W, ZHOU J Y, ZU Q X, et al. Screening, identification, biocontrol and growth-promoting potential evaluation of two bacterial strains against tobacco black shank[J]. Chinese Tobacco Science, 2017, 38(3): 44-50.
[6]王静,孔凡玉,张成省,等. 放线菌F8对烟草黑胫病的拮抗作用及其产酶活性[J]. 中国烟草科学,2013(2):61-65.
WANG J, KONG F Y, ZHANG C S, et al. Antagonism effect and enzyme-producing comparison of Actinomycetes F8 against tobacco black shank[J]. Chinese Tobacco Science, 2013(2): 61-65.
[7]LI M, MA G S, LIAN H, et al. The effects of Trichoderma on preventing cucumber fusarium wilt and regulating cucumber physiology[J]. Journal of Integrative Agriculture, 2019, 18(3): 607-617.
[8]OMOMOWO I O, FADIJI A E, OMOMOWO O I. Assessment of bio-efficacy of, Glomus versiforme, and, Trichoderma harzianum, in inhibiting powdery mildew disease and enhancing the growth of cowpea[J]. Annals of Agricultural Sciences, 2018: S0570178318300034.
[9]景芳,刘彦明,任生兰,等. 长枝木霉T6生防菌剂发酵条件优化及其对辣椒立枯病的防治效果[J]. 中国生物防治学报,2020,36(1):113-124.
JING F, LIU Y M, REN S L, et al. Optimization of the fermentation conditions of biocontrol agent Trichoderma longibrachiatum T6 and its efficiency against pepper blight[J]. Chinese Journal of Biological Control, 2020, 36(1): 113-124.
[10]赵兴丽,张金峰,周玉锋,等. 一株拮抗茶炭疽病菌的木霉菌的分离、筛选及鉴定[J]. 茶叶科学,2019,39(4):431-439.
ZHAO X L, ZHANG J F, ZHOU Y F, et al. Isolation, screening and identification of a strain of Trichoderma antagonizing tea anthracnose[J]. Journal of Tea Science, 2019, 39(4): 431-439.
[11]台莲梅,高俊峰,左豫虎,等. 长枝木霉菌T115D诱导大豆叶片防御酶活性及疫病盆栽防治效果[J]. 中国生物防治学报,2018,34(6):897-905.
TAI L M, GAO J F, ZUO Y H, et al. Induction of defense enzymes activities in soyben and control effect of Phytophthora root rot in flowerpot by Trichoderma longibrachiaum T115D[J]. Chinese Journal of Biological Control, 2018, 34(6): 897-905.
[12]刘畅,许家来,郭凯,等. 烟草黑胫病生防菌的筛选鉴定及发酵条件优化[J]. 江苏农业科学,2016,44(5):167-170.
LIU C, XU J L, GUO K, et al. Screening, identification and fermentation conditions optimization for biocontrol fungi to tobacco black shank[J]. Jiangsu Agricultural Sciences, 2016, 44(5): 167-170.
[13]陳志敏,顾钢,陈顺辉,等. 木霉菌对烟草疫霉的拮抗作用[J]. 福建农林大学学报(自然科学版),2009,38(3):234-237.
CHEN Z M, GU G, CHEN S H, et al. Antagonism of Trichoderma spp. to Phytophthora parasitica var. nicotianae[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2009, 38(3): 234-237.
[14]崔西苓,李世贵,杨佳,等. 耐盐碱抗烟草黑胫病木霉菌株的筛选与鉴定[J]. 中国农业科技导报,2014,16(3):81-89.
CUI X L, LI S G, YANG J, et al. Screening and identification of saline-alkali tolerant and tobacco black shank resistant Trichoderma[J]. Journal of Agricultural Science and Technology, 2014, 16(3): 81-89.
[15]田艳艳,赵世民,李彰,等. 洛阳地区烟田土壤木霉菌的分离鉴定及其拮抗作用测定[J]. 河南农业科学,2015,44(11):79-84.
TIAN Y Y, ZHAO S M, LI Z, et al. Isolation and identification of Trichoderma from tobacco growing soil of Luoyang and determination of their inhibition effects[J]. Journal of Henan Agricultural Sciences, 2015, 44(11): 79-84.
[16]DENNIS C, WEBSTER J. Antagonistic properties of species-groups of ‘Trichoderma: II. production of volatile antibiotics[J]. Transactions of the British Mycological Society, 1971, 57(1): 41-48.
[17]张丽荣,李鹏,康萍芝,等. 压砂西瓜枯萎病生防木霉菌筛选及其拮抗机制研究[J]. 河南农业科学,2018,47(5):75-78,84.
ZHANG L R, LI P, KANG P Z, et al. Screening and antagonistic mechanism analysis of Trichoderma spp. against Fusarium wilt of watermelon in gravel-mulched land[J]. Journal of Henan Agricultural Sciences, 2018, 47(5): 75-78, 84.
[18]章初龙,徐同. 我国河北、浙江、云南以及西藏木霉种记述[J]. 菌物学报,2005,24(2):184-192.
ZHANG C L, XU T. Description of Trichoderma species in Hebei, Zhejiang, Yunnan and Tibet of China[J]. Mycosystema, 2005, 24(2): 184-192.
[19]孙军,段玉玺,吕国忠. 辽宁木霉属(Trichoderma)真菌的形态分类研究[J]. 菌物研究,2006(2):38-44.
SUN J, DUAN Y X, LYU G Z. Morphological identification of Trichoderma species in Liaoning province[J]. Journal of Fungal Research, 2006(2): 38-44.
[20]毕文慧,岳琳,刘秀琳,等. 哈茨木霉对几种常见蔬菜病害防治效果探究[J]. 南方农业,2018,12(11):131-133.
BI W H, YUE L, LIU X L, et al. Study on the control effect of Trichoderma harzianum on several common vegetable diseases[J]. South China Agriculture, 2018, 12(11): 131-133.
[21]王依純,廉华,马光恕,等. 木霉不同施用方式对黄瓜幼苗质量特性及枯萎病防效的影响[J]. 中国生物防治学报,2019,35(3):416-425.
WANG Y C, LIAN H, MA G S, et al. Effects of application modes of Trichoderma on seedling quality characteristics of cucumber and control effect against Fusarium wilt[J]. Chinese Journal of Biological Control, 2019, 35(3): 416-425.
[22]蒋妮,白丹宇,宋利沙,等. 棘孢木霉F2菌株对三七灰霉病的生物防治作用[J]. 江苏农业科学,2018,46(20):94-97.
JIANG N, BAI D Y, SONG L S, et al. Biocontrol effect of Trichoderma asperellum strain F2 on Botrytis cinerea of pseudo-ginseng[J]. Jiangsu Agricultural Sciences, 2018, 46(20): 94-97.
[23]秦文韬,陈凯,庄文颖. 木霉属5个中国新记录种及2种木霉在中国的新分布[J]. 菌物学报,2016,35(8):994-1007.
QIN W T, CHEN K, ZHUANG W Y. Five Trichoderma species new to China and notes on two other widespread species[J]. Mycosystema, 2016, 35(8): 994-1007.
[24]马景. 新疆北部草原和森林生态系统木霉菌多样性研究[D]. 北京:中国农业科学院,2017.
MA J. Biodiversity of Trichoderma in grassland ecosystem and forest ecosystem from northern Xinjiang[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[25]王永阳. 防治苦瓜枯萎病的木霉菌株分离鉴定、定殖检测及其防病促生机理[D]. 泰安:山东农业大学,2018.
WANG Y Y. Isolation, identification and detection of colonization of Trichoderma strains for bitter gourd wilt and their mechanism of disease control and growth promotion[D]. Tai'an: Shandong Agricultural University, 2018.
[26]宋晓妍,孙彩云,陈秀兰,等. 木霉生防作用机制的研究进展[J]. 中国农业科技导报,2006,8(6):20-25.
SONG X Y, SUN C Y, CHEN X L, et al. Research advances on mechanism of Trichoderma in biological control[J]. Review of China Agricultural Science and Technology, 2006, 8(6): 20-25.
[27]李纪顺,陈凯,杨合同,等. 木霉抗生性代谢产物研究进展[J]. 农药,2010,49(10):713-716,719.
LI J S, CHEN K, YANG H T, et al. Bioactive secondary metabolites from Trichoderma species[J]. Agrochemicals, 2010, 49(10): 713-716, 719.
