麦麸阿拉伯木聚糖-牛血清蛋白质酶促共聚物制备及表征
2020-07-18吕丁阳殷丽君陈复生
吕丁阳,殷丽君,陈复生*
1. 河南工业大学粮油食品学院(郑州 450001);2. 中国农业大学食品科学与营养工程学院(北京 100083)
多糖及蛋白质作为生物活性大分子被广泛利用在食品乳状液体系中[1-2]。多糖富含羟基且分子量较大,可通过改善乳状液流变学特性进而提升乳状液稳定性[3]。蛋白质大多含有两亲性氨基酸,可通过提升油水界面张力进而提升乳状液乳化活性[4]。然而,多糖往往缺少与亲水性基团相对应的疏水性基团[5],蛋白质易受环境条件影响[6],为了改善多糖与蛋白质乳化特性,研究人员利用物理化学方法使多糖与蛋白质交联制备多糖-蛋白质共聚物,共聚物能够集合两者优良特性[7]。
多糖及蛋白质结合方式主要分为自然交联、静电交联及共价交联[8]。自然交联代表物质为阿拉伯树胶,阿拉伯树胶由阿拉伯半乳聚糖、阿拉伯半乳聚糖-蛋白质及糖蛋白三部分构成,但阿拉伯树胶取材困难且价格昂贵[9]。静电交联对环境变化较为敏感,形成的多糖蛋白质静电共聚物容易发生解离[10]。共价交联主要分为美拉德反应[11]及酶促交联反应,其中酶促交联反应因产物无毒性、反应条件温和逐渐成为研究热点[12]。多糖与蛋白质的酶促交联反应通常由过氧化物酶、转谷氨酰胺酶、漆酶实现,漆酶主要作用于多糖的酚酸及蛋白质的酪氨酸,二者在漆酶的催化下发生交联进而形成多糖-多糖、蛋白质-蛋白质及多糖-蛋白质共聚物[13-15]。
我国是小麦生产大国,每年因小麦制粉产生约2 000万 t麦麸,大部分麦麸用作饲料,造成极大的资源浪费[16]。近些年来,国内外研究人员对麦麸中含有的膳食纤维、蛋白等进行深入研究,表明麦麸中含有的阿拉伯木聚糖在食品乳化剂行业具有应用前景[17]。试验利用小麦麸皮为原料,从中提取麦麸阿拉伯木聚糖(WBAX)作为模型多糖。选取牛血清白蛋白(第五组分)(BSA)作为模型蛋白,BSA为一种球状蛋白,其酪氨酸主要分布在球状结构外侧,较易与WBAX中含有的阿魏酸交联[18]。选取漆酶作为多糖与蛋白质之间的交联酶[19]。利用漆酶交联WBAX及BSA,并对酶促共聚物进行表征,以期为多糖-蛋白质酶促共聚物的研究及应用提供参考。
1 材料与方法
1.1 材料与仪器
小麦麸皮(河南省农业科学院);BSA(北京索莱宝科技有限公司);漆酶(200 U/mg,北京索莱宝科技有限公司));H2O2(体积分数30%,天津科密欧化学试剂有限公司);叠氮化钠(天津化工试剂三厂);乙腈(色谱级,德国CNW Technologies GmbH公司);无水乙醇(色谱级,天津市津科精细化工);其他试剂均为分析级。
Waters 1525型高效液相色谱仪(美国Waters公司);Aligent 1200型高效液相色谱仪(安捷伦科技有限公司);UV-1901紫外分光光度计(北京普析通用仪器有限公司);DYY-6D电泳设备(北京市六一仪器厂);BS210S分析天平(德国Sartorius公司);LGL-25C冷冻干燥机(北京四环科学仪器厂);GL-20C高速离心机(上海安亭科学仪器有限公司);微孔滤膜(0.45 μm,美国Millipore 生物科技技术公司);MTN-2800D-24氮吹仪(天津奥特赛恩斯仪器有限公司)。
1.2 WBAX提取及成分分析
1.2.1 提取步骤
取200 g粉碎过40目筛的热风干燥小麦麸皮,加入5倍质量的蒸馏水浸泡并加热30 min(沸水浴),待温度降至70 ℃时,加入α-淀粉酶70 ℃水浴加热,通过碘液变色测试麸皮中是否有淀粉残留。待淀粉分解完全,过滤富集沉淀,沸腾蒸馏水冲洗4~5次,75 ℃烘箱干燥。向100 g去淀粉麦麸中加入1.5 L 0.15 mol/L NaOH及25 mL体积分数30%的H2O2,85 ℃恒温水浴锅中碱提3 h。反应后料液离心(4 000 r/min,20 min),取上清液加入4 mol/L HCl将混合液调至pH 4.3,离心(4 000 r/min,20 min)后取上清液,边搅拌边加入无水乙醇(乙醇与料液体积比13∶7),离心(4 000 r/min,20 min),所得沉淀冷冻干燥4 ℃条件下保存[20]。
1.2.2 水分、灰分、蛋白质、阿拉伯木聚糖含量测定
分别根据AACC-Methods 44-19、08-01方法来测定1.2.1中提取的WBAX粗产物中的水分及灰分[21]。利用海能K1100全自动凯氏定氮仪测定样品中蛋白质。利用地衣酚-盐酸法测定阿拉伯木聚糖含量[22]。
1.3 WBAX-BSA酶促共聚物制备
分别利用0.1 mol/L磷酸盐缓冲溶液(pH 6.5)配置质量分数1.0%的WBAX、0.4% BSA,100 U/mL漆酶溶液,浓度0.5 mol/L的H2O2。取50 μL漆酶溶液与50 μL H2O2与1 mL BSA混合,将4 mL WBAX分成体积相同的10份,每隔5 min以400 μL体积添加到上述混合溶液中,配置成WBAX 与BSA质量比10∶1的溶液。对照组为单独的WBAX、BSA溶液及不含漆酶的WBAX/BSA复合物及漆酶催化的WBAX(质量分数1.0%)或BSA(质量分数0.4%),分别记作WBAX、BSA、WBAX/BSA复合物、WBAX(漆酶)、BSA(漆酶)。试验组及对照组放置于35 ℃恒温振荡水浴锅中反应4 h,利用20 μL质量分数1.0%的叠氮化钠终止反应[23]。
1.4 WBAX-BSA酶促共聚物表征
1.4.1 UV-vis分析
当WBAX与BSA在漆酶作用下发生反应时,WBAX结构中含有的阿魏酸及BSA含有的酪氨酸含量会降低,据Oudgenoeg报道[24],阿魏酸、酪氨酸、二阿魏酸、二酪氨酸分别在325,280,348和318 nm处具有最大吸光度。可通过监测各样品在325,280,348和318 nm处吸光度的变化监测酶促反应进程。取1.3制备的样品利用0.1 mol/L pH 6.5的磷酸盐缓冲溶液稀释1倍,以磷酸盐缓冲溶液为标定液,测定各样品分别在325,280,348和318 nm处的吸光度[25]。
1.4.2 SDS-PAGE分析
分别将10 μL样品溶液(WBAX、BSA、WBAX(漆酶)、BSA(漆酶)、WBAX/BSA酶促共聚物、WBAX/BSA复合物)与10 μL样品缓冲液混合,样品缓冲液由质量分数25%甘油、60 mmol/L Tris-HCl(pH 6.8)、质量分数2% SDS、14.4 mmol/L β-巯基乙醇、质量分数0.1%溴酚蓝和50 mmol/L EDTA组成。样品缓冲液混合物煮沸3 min,取10 μL上样,电泳凝胶由5%浓缩胶和12%分离胶组成,在恒流条件下进行,其中浓缩胶电流20 mA,分离胶电流40 mA。凝胶电泳结束后进行振荡染色1 h,脱色处理1 h,蛋白质染色液配方为1.0 g考马斯亮蓝R250、体积分数45%甲醇、45%蒸馏水、10%甲酸;脱色液配方为体积分数10%甲醇、80%蒸馏水、10%甲酸。将经过蛋白染色的凝胶电泳进行糖染色处理,将凝胶先至于体积分数50%乙醇中固定30 min,经过质量分数1%高碘酸+3%乙酸溶液中氧化30 min,利用0.1%偏重亚硫酸钠+10 mmol/L HCl中漂洗2次,在席夫碱试剂中避光染色1 h,用0.5%偏重亚硫酸钠漂洗脱色。
1.4.3 FT-IR分析
采用傅里叶红外扫描仪,分析WBAX-BSA酶促共聚物及WBAX/BSA复合物化学键变化,采用溴化钾压片法,将冷冻干燥的样品与充分干燥的溴化钾以1∶100混合,并用玛瑙研钵研成均匀粉末,以溴化钾为空白对照,扫描区间400~4 000 cm-1,扫描次数32次,分辨率4 cm-1。
1.4.4 乳化稳定性分析
取30 mL制备好的样品溶液于平底小烧杯中,加入10 mL大豆油,在10 000 r/min下均质1 min,分别于0和10 min从烧杯底部0.5 cm处取50 μL匀浆液稀释在5 mL 0.1% SDS溶液中,混匀后在500 nm波长处测定吸光度分别记作A0和A10。用0.1% SDS溶液作为空白对照。根据式(1)、(2)计算乳化活性指数(EAI)和乳化稳定性指数(ESI)[26]。


式中:N为稀释倍数,100;θ为油相体积比,0.25;L为比色杯厚度,1 cm;C为蛋白质浓度;A0、A10分别为0 min和10 min的吸光度;10为2次测定的间隔时间,min。
2 结果与分析
2.1 小麦麸皮阿拉伯木聚糖化学组成分析
WBAX化学组分如表1所示,WBAX中含有的少量蛋白质是由于碱提过程中调至pH 4.3时,不能完全沉淀某些游离蛋白质。WBAX中阿魏酸含量是由阿魏酸标准曲线得出,阿拉伯木聚糖含量是根据地衣酚-盐酸法算得,此方法原理是地衣酚与酸解后WBAX释放的戊糖反应,根据标准曲线得出WBAX中阿拉伯木聚糖含量为67%。

表1 WBAX组成成分分析 %
2.2 酶促共聚物表征
2.2.1 UV-vis分析
WBAX与BSA的酶促反应体系中,会形成WBAXBSA、WBAX-WBAX、BSA-BSA这3种产物。WBAXWBAX、BSA-BSA共聚物分别由阿魏酸的脱氢耦合及酪氨酸的脱氢反应制得,而目标产物WBAX-BSA共聚物是通过阿魏酸与酪氨酸结合制得。WBAX-BSA酶促共聚物的形成通常通过反应物阿魏酸、酪氨酸及副产物(二阿魏酸、二酪氨酸)吸光度变化表征[27]。WBAX与BSA在漆酶作用下形成WBAX-BSA共聚物时,阿魏酸及酪氨酸含量会减少,且减少的阿魏酸及酪氨酸分别可参与WBAX及BSA的分子内交联,也可参与WBAX与BSA的分子间交联,所以需要通过二阿魏酸及二酪氨酸含量进行判断。由表2可知,WBAX经过漆酶处理后,自身含有的阿魏酸能够交联形成二阿魏酸,所以WBAX经过酶处理后,325 nm处吸光度下降19.3%,348 nm处吸光度增加47.3%。而280 nm、318 nm处吸光度无明显变化,说明WBAX自身含有的蛋白质的酪氨酸与阿魏酸交联程度较低或者无交联作用。BSA经漆酶处理过后,280 nm处吸光度降低8.5%,318 nm处吸光度上升10.1%,说明在漆酶作用下,酪氨酸能够形成二酪氨酸进而使BSA发生分子内交联。WBAX与BSA利用漆酶处理时,与未经漆酶处理得WBAX/BSA复合物对照组相比,阿魏酸、酪氨酸含量分别降低34.4%及9.7%,大于WBAX及BSA的分子内交联消耗的阿魏酸及酪氨酸量。二阿魏酸含量低于经过漆酶处理得WBAX,说明WBAX与BSA处在酶反应体系中时,WBAX中的阿魏酸主要与BSA中酪氨酸反应,且WBAX-BSA酶促共聚物的二阿魏酸(318 nm)、二酪氨酸(348 nm)含量低于未经漆酶处理的WBAX/BSA复合物组,说明BSA与漆酶反应体系中引入WBAX时,酪氨酸与阿魏酸的交联会暂时阻碍阿魏酸和酪氨酸的分子内交联。

表2 各样品紫外-可见光吸光度
2.2.2 SDS-PAGE分析
糖蛋白产物的鉴别可以通过SDS-PAGE分析,多糖与蛋白质之间形成多糖-蛋白质共聚物时,浓缩胶与分离胶的交界处会有染色条带出现或者分离胶中会出现拖尾条带[28]。在图1(A)中蛋白染色的凝胶中,WBAX-BSA酶促共聚物(泳道1)在浓缩胶中有一条浅蓝色的染色条带,且进样孔为蓝色,说明有大分子量的蛋白质或者糖蛋白未能进入凝胶。而未经漆酶处理的对照组WBAX/BSA复合物(泳道2)进样孔无蓝色出现,且浓缩胶中无蓝色条带出现。图1(B)为糖染色凝胶电泳,可以看到WBAX-BSA酶促共聚物与WBAX/BSA复合物进样孔均有糖色出现,说明截留在进样孔外的物质为糖蛋白,为验证是否由WBAX、BSA分子内交联产物产生,分别对WBAX及BSA的分子内交联产物的对照组进行验证(图1(C)),泳道1、2中无染色条带出现,说明WBAX中的蛋白质分子量较小没有进入泳道且WBAX分子内交联效果较弱或者交联产物分子量较小不足以截留在泳道内。BSA纯度较高,且经过漆酶处理的BSA无高分子量条带出现,说明WBAX-BSA共价复合物(图1(A)泳道1)在浓缩胶中出现的浅蓝色的染色条带是由WBAX与BSA分子间交联产生。
2.2.3 FT-IR分析
FT-IR用来鉴定WBAX与BSA的异质结合,WBAX与BSA之间形成WBAX-BSA酶促共聚物时,WBAX中的阿魏酸与BSA中的酪氨酸会通过阿魏酸及酪氨酸的芳香环形成C—O—C键。与WBAX/BSA复合物相比,WBAX-BSA酶促共聚物在667 cm-1处出现新峰。芳环上氢键在650~900 cm-1范围内振动,结果表明WBAX可以通过阿魏酸或蛋白质与BSA的酪氨酸分子间反应形成C—O—C键。

图1 各样品凝胶电泳图

图2 各样品红外光谱图
2.2.4 乳化特性分析
由图3可知,WBAX与BSA交联影响产物EAI及ESI,WBAX与BSA在漆酶作用下生成WBAX-BSA酶促共聚物时,EAI及ESI值均增加,与WBAX(75.3 m2/g,17.5 min)、BSA(128.0 m2/g,15.7 min)、WBAX/BSA(144.8 m2/g,18.5 min)复合物的EAI及ESI相比,WBAX-BSA酶促共聚物(155.8 m2/g,23.7 min)上升明显,这是因为WBA与BSA交联时,形成的WBAX-BSA酶促共聚物运用在乳状液中时会迁移到油水界面,其中酶促共聚物的WBAX部分提供大量亲水羟基,BSA部分提供疏水性氨基酸,使得油水界面张力增加,界面膜增厚,因此EAI及ESI增加。
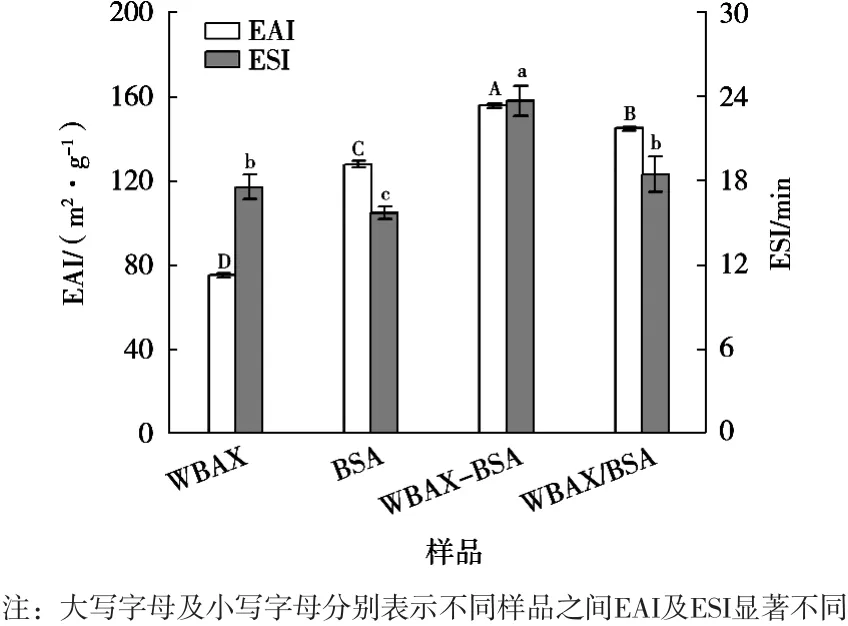
图3 各样品乳化特性分析
3 结论
在漆酶体系下交联麦麸阿拉伯木聚糖与牛血清白蛋白,并利用紫外分光光度计,十二烷基硫酸钠聚丙烯胺凝胶电泳,红外光谱等技术表征了酶促产物形成,结果表面漆酶能够催化麦麸阿拉伯木聚糖及牛血清白蛋白交联,且酶促共聚物能够改善麦麸阿拉伯木聚糖及牛血清白蛋白单体的乳化特性。
