古大湖湿地盐碱土壤微生物群落结构及多样性分析
2020-07-17于少鹏史传奇胡宝忠丁俊男杨春雪
于少鹏,史传奇,胡宝忠,丁俊男,孟 博,杨春雪
哈尔滨学院黑龙江省寒区湿地生态与环境研究重点实验室 哈尔滨湿地研究院, 哈尔滨 150086
黑龙江省湿地类型多样,湖泊湿地面积为35.60万hm2,占全省湿地面积的6.92%。其中永久性咸水湖是湖泊湿地主要类型之一,占全省湖泊湿地的36.94%[1]。主要分布于松嫩平原沉降盆地中心低洼处,如大庆、安达、肇源、杜尔伯特地区。万忠娟等[2]认为盐碱湖泊湿地是因地质地貌、气候、水文等自然因素及修路、堤防、水库工程等人为干扰,导致低洼地排水不畅而形成。盐碱湿地土壤养分含量低,透气性差,植物、土壤微生物多样性均不高[3-4],尤其是原生盐碱土壤中,微生物群落多样性低于次生盐碱土壤和农田土壤[3]。微生物参与土壤有机质分解、养分矿化及土壤团聚体形成,对土壤环境质量具有指示作用[5-6]。其多样性易受到pH值的影响[7- 8],盐碱程度不同是造成微生物优势群落差异的原因之一[9],通常pH值升高抑制微生物生长,导致其群落多样性下降[10-11]。此外,Yan等[12]提出土壤含水量对微生物的影响也十分显著,含水量变化可改变氧气含量,调节微生物种类、活性及生长。植物与微生物之间存在着密切的关系[13],不同土地利用方式植被类型有所不同,进而产生微生物群落及功能多样性差异[14-15],特别是在盐碱土壤中,两者协同分布,共同进化[16-17]。
古大湖湿地是松嫩平原湖泊湿地中永久性咸水湖的典型代表,周边耕地、放养畜禽形成干扰,使土壤环境处于受威胁状态。因此,本研究对4种不同生境类型条件下的盐碱土壤进行采样,分析土壤细菌和真菌的群落多样性差异及其影响因素,为我国东北寒区盐碱湿地生物多样性现状的研究提供基础数据,并为其盐碱湿地土壤保护与合理利用及退耕还湿工作提供参考依据和理论指导。
1 材料与方法
1.1 研究区概况
古大湖国家湿地公园(以下简称“古大湖湿地”)位于黑龙江省安达市境内,松嫩平原中部,地理坐标为125°28′06′′—125°34′34′′ E,46°19′31′′—46°23′58′′ N,东至肇东市宣化乡繁荣村行政边界,西至青肯泡乡和羊草镇交汇处,北至青肯泡乡东大山村,南与蓄水堤坝相邻。东西长8.0 km,南北宽8.2 km,总面积4850.1 hm2。气候干旱,降雨稀少。湿地以盐碱土壤为主,属东北地区典型的内陆平原湖泊-沼泽复合型湿地。包括古大湖大部分湖区,以及草本沼泽和沼泽化草甸湿地,湿地率为99.1%。周边分布人工林和小面积的耕地。
1.2 样品采集
4种生境类型样品采集于2017年9月。原生土壤(Original soil,OS)、林地土壤(Woodland soil,WS)、耕地土壤(Cultivated land soil,CS)和湖岸土壤(Lakeshore soil,LS)样品均取自于距地表0—20 cm处,各生境类型条件下重复3次,每次取5个小样点(2 m×2 m范围内于4个顶点及中心点取样),去除石块和植物根系等杂质,每份取200 g,将5份小样点土壤充分混匀,取5 g装入TinyGene生物科技(上海)公司土壤样本活菌保存液中。依次做好标记,所有土壤样品低温保存带回实验室。分别记录样品采集地地理坐标、海拔及主要植物种类(表1)。
1.3 实验方法
1.3.1土壤微生物群落结构测定
采用MIO-BIO PowerSoil DNA Isolation Kit分别对12个土壤样品进行DNA抽提。采用两步PCR扩增方法,第一步采用50 μL反应体系:5 × Buffer 10 μL,dNTP(10 mmol/L)1 μL,Phusion超保真DNA聚合酶1 U,F/R特异引物(10 μmol/L)各1 μL(细菌16S V4-V5区片段扩增采用特异引物515F 5′-GTGCCAGCMGCCGCGGTAA- 3′,926R 5′-CCGTCAATTCMTTTGAGTTT- 3′;真菌ITS1片段扩增采用特异引物ITS1 F 5′-CTTGGTCATTTAGAGGAAGTAA- 3′,ITS1 R 5′-GCTGCGTTCTTCATCGATGC- 3′),DNA模板5- 50 ng,ddH2O补至50 μL。利用ABI 9700 PCR仪扩增目的片段,程序为:94℃ 2 min;94℃ 30 s,56℃(细菌)/50℃(真菌)30 s,72℃ 30 s,共25(细菌)/33(真菌)个循环;72℃ 5 min,10℃保温。将产物进行胶回收后作为模板进行第二步PCR扩增,采用40 μL反应体系:5×Buffer 8 μL,dNTP(10 mmol/L)1 μL,Phusion超保真DNA聚合酶0.8 U,F/R特异引物(10 μmol/L)各1 μL,DNA模板5 μL,dd H2O补至40 μL。PCR扩增程序为:94℃ 2 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,共8个循环;72℃ 5 min,10℃保温。将第二步PCR产物用2%(质量体积比)的琼脂糖凝胶进行电泳,采用AxyPrepDNA凝胶回收试剂盒进行回收,FTC- 3000TMreal-time PCR仪进行定量,均一化混匀后,NGS Illumina MiSeq 2×300 bp平台高通量测序。

表1 古大湖湿地4种生境类型盐碱土壤样品采样信息
1.3.2土壤理化性质测定
参考鲍士旦[18]土壤分析方法,对12个土壤样品进行理化性质测定,每个样品重复3次。土壤pH值采用pH仪(上海雷磁PHS- 3C)测定《NY/T1121.2—2006土壤检测》;土壤含水量(Moisture,M)采用烘干法测定;土壤总有机碳(Total organic carbon,TOC)含量测定采用重铬酸钾容量法-外加热法《NY/T1121.6—2006土壤检测》;土壤全氮(Total nitrogen,TN)含量测定采用半微量凯氏定氮法《NY/T53土壤全氮法(半微量开氏法)》;土壤碱解氮(Alkali-hydrolyzable nitrogen,AN)含量测定采用碱解扩散法《碱解扩散法LY/T 1229—1999》;土壤全磷(Total phosphorous,TP)含量测定采用HClO4-H2SO4法《NY/T88 土壤全磷测定法》;土壤有效磷(Available phosphorous,AP)含量测定采用钼锑抗比色法《HJ704—2014碳酸氢钠提取-钼锑抗比色法》;土壤速效钾(Available potassium,AK)含量测定采用火焰光度计法《NY/T 889—2004 乙酸铵提取-火焰光度法》。
1.4 数据处理
测序分别得到12个土壤细菌、真菌样品的PE reads,根据Barcode区分每个样品后,对序列进行质控和过滤,删去长度小于200 bp的序列。去除Barcode和引物序列,获得土壤细菌和真菌有效序列,根据overlap关系进行序列拼接,再次将拼接后的序列进行质控和过滤,最终得到细菌、真菌优化序列。在97%相似度水平下将优化序列聚类为用于物种分类的操作分类单位(Operational taxonomic units,OTU),统计各土壤样品中每个OTU的相对丰度信息,利用Office Excel 2010绘制门和属水平的群落结构柱状图。利用Mothur v 1.39.5软件分析各样品微生物群落多样性,包括Ace指数、Chao 1指数、Shannon指数和Simpson指数,并利用SPSS 17.0进行Duncan多重比较,分别分析4种生境类型各指数间差异显著性。利用R软件中vegan程序包,在OTU水平上计算12个样品之间的Bray-cutis距离(Bray-cutis dissimilarity, dBCD),pheatmap程序包进行作图,分析4种生境类型土壤样品间微生物群落差异性。利用SPSS 17.0进行Duncan多重比较,分析4种生境类型各项土壤理化指标间差异显著性。利用Canoco for Windows 4.5对12个样品的OTU相对丰度矩阵做去趋势对应分析(Detrended correspondence analysis,DCA),根据结果中梯度长度在第一轴上的值,选择典范对应分析(Canonical correspondence analysis,CCA)或冗余分析(Redundancy analysis,RDA),分析土壤理化指标对细菌、真菌群落多样性的影响,土壤理化指标解释量显著性检验利用Monte Carlo置换检验方法,置换次数为999。并利用CanoDraw for windows 进行作图。
2 结果与分析
2.1 土壤微生物样品测序结果
在97%的序列相似度水平上,通过对序列进行质控和过滤,共获得细菌、真菌OTU数分别为2971个、934个,细菌种数大于真菌。由图1可知,绝大多数样品的稀疏曲线趋于平缓,如LS细菌、LS真菌、CS真菌样品,即再增大测序深度也不会增加新的OTU数量,说明该样品的OTU覆盖度已达到饱和,能够反映古大湖湿地盐碱土壤微生物群落结构组成。而CS细菌、WS真菌样品等的稀疏曲线仍有上升趋势,尚未达到饱和状态,说明随着测序深度的增加可能会发现新的细菌和真菌类群。同时可知,CS样品中产生的细菌和真菌OTU数目均相对较多。
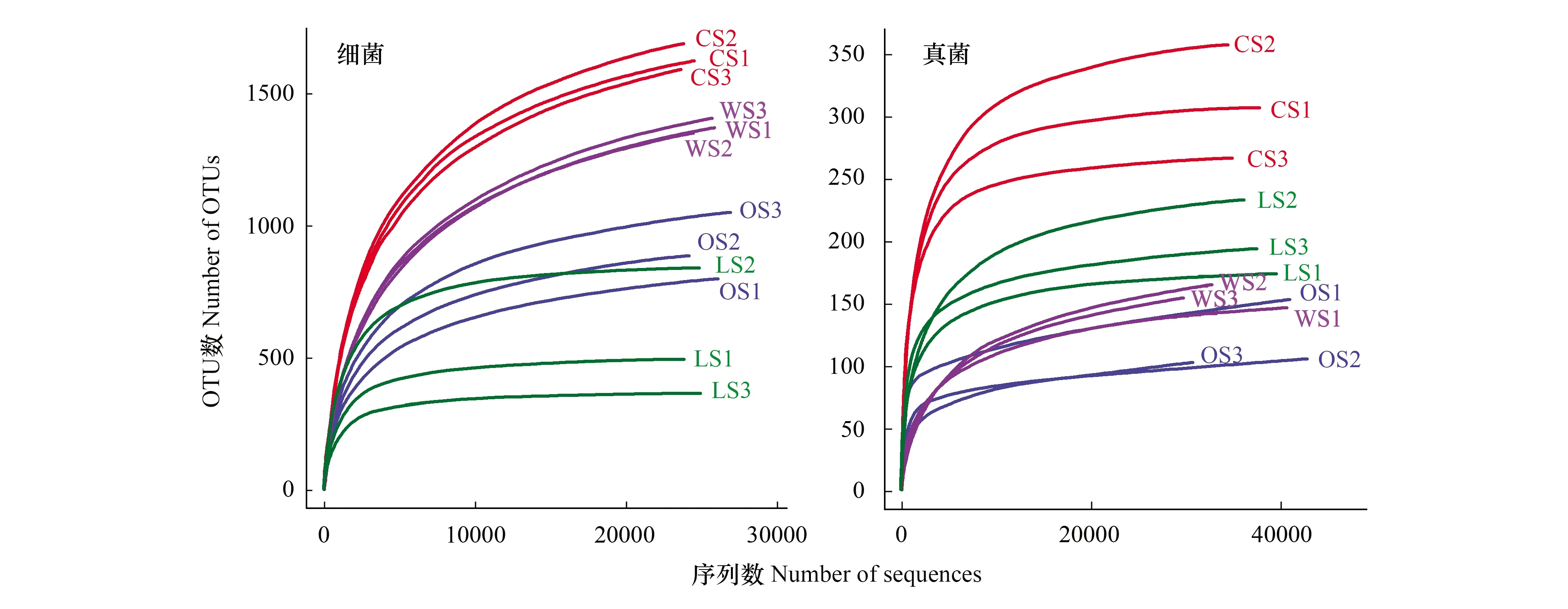
图1 古大湖湿地盐碱土壤细菌和真菌样品在97%水平上的稀疏曲线Fig.1 Rarefaction curves of saline soil bacterial and fungal samples in Gudahu wetland at cutoff level of 97%OS: 原生土壤Original soil; WS: 林地土壤Woodland soil; CS: 耕地土壤Cultivated land soil; LS: 湖岸土壤Lakeshore soil; OTU: 操作分类单位Operational taxonomic units
2.2 土壤微生物群落结构组成分析
2.2.1细菌群落结构组成
依据12个土壤样品细菌门水平分布柱状图(图2),共得到17个细菌类群(不包括相对丰度小于0.5%的类群),相对丰度值最高的为变形菌门(Proteobacteria),在4种生境类型中的平均值分别为26.97%(OS)、25.66%(WS)、31.56%(CS)和59.63%(LS),其中LS3中相对丰度高达69.36%。其余前几个细菌门的相对丰度值由高至低依次为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)等。
在细菌属分类水平上共得到57个类群(不包括相对丰度小于0.5%的类群,图2),变形菌门的未分类细菌属相对丰度值最高,除LS相对较低外,其余3种生境类型条件下相对丰度值均高于70%,OS1中相对丰度值高达87.37%。LS中除变形菌门的未分类细菌属之外,鞘氨醇单胞菌属(Sphingomonas)、Aliihoeflea、盐单胞菌属(Halomonas)和海洋杆菌属(Pelagibacterium)分别占总量的23.15%、30.21%、15.73%和17.86%。

图2 古大湖湿地盐碱土壤细菌门和属群落结构组成Fig.2 Saline soil bacterial phylum and genus community structure composition of Gudahu wetland
2.2.2真菌群落结构组成
根据真菌门水平分布柱状图(图3),共得到8个真菌类群(不包括相对丰度小于0.5%的类群),其中子囊菌门(Ascomycota)相对丰度值最高,在OS1、OS2、CS和LS中相对丰度值均高于45%,LS3中达到76.42%。其次为担子菌门(Basidiomycota),OS3和WS中的相对丰度值均大于85%,WS2中高达92.88%。其余真菌类群相对丰度值较低,同时具有未分类真菌门存在。
在真菌属水平柱状图上可以看出(图3),共得到85个真菌类群(不包括相对丰度小于0.5%的类群),以子囊菌门的未分类真菌属相对丰度值最高,集中表现在OS1、CS和LS中,其值均接近50%。WS2和WS3中相对丰度值较高的是担子菌门的滑锈伞属(Hebeloma),其值分别为91.53%、82.78%,同门的丝膜菌属(Cortinarius)在WS1中相对丰度值为85.97%,OS3中同门的鬼伞属(Coprinopsis)相对丰度值达81.17%,但这3个属在其余样品中比例均极低。
2.3 土壤微生物群落多样性指数分析
由表2可知,土壤细菌丰富度与多样性指数均与OTU数目变化一致,其中CS细菌群落的平均Chao 1指数(1858.438)、平均Ace指数(1824.495)、平均Shannon指数(6.372)及平均Simpson指数(0.9957)数值相对最高。方差分析结果表明,平均Chao 1指数和平均Ace指数中,CS与WS的差异不显著,但与OS差异达到极显著,且OS与LS差异同样达到极显著,说明其CS与WS丰富度接近,大于OS和LS,而LS最低。平均Shannon指数中,CS与WS差异不显著,与OS差异显著,只与LS达到差异极显著,CS与LS平均Simpson指数差异达到显著,说明LS的多样性最低。
土壤真菌丰富度及多样性比较结果可知(表2),CS样品的平均Chao 1指数(317.963)、平均Ace指数(319.676)、平均Shannon指数(4.324)及平均Simpson指数(0.9737)的值最高。方差分析结果表明,CS平均Chao 1指数与其他3种生境类型达到显著差异,与WS达到极显著差异;CS平均Ace指数与其余3种生境类型的差异达到极显著,而3者的两个平均指数差异不显著,说明CS丰富度最高。CS平均Shannon指数与LS接近,与OS、WS差异极显著,而WS显著低于OS。平均Simpson指数中,WS最低,与OS差异显著,而与CS、LS达到极显著差异。说明CS与LS真菌群落多样性接近,且相对较高,其次为OS,而WS真菌多样性最低。

图3 古大湖湿地盐碱土壤真菌门和属群落结构组成Fig.3 Saline soil fungal phylum and genus community structure composition of Gudahu wetland
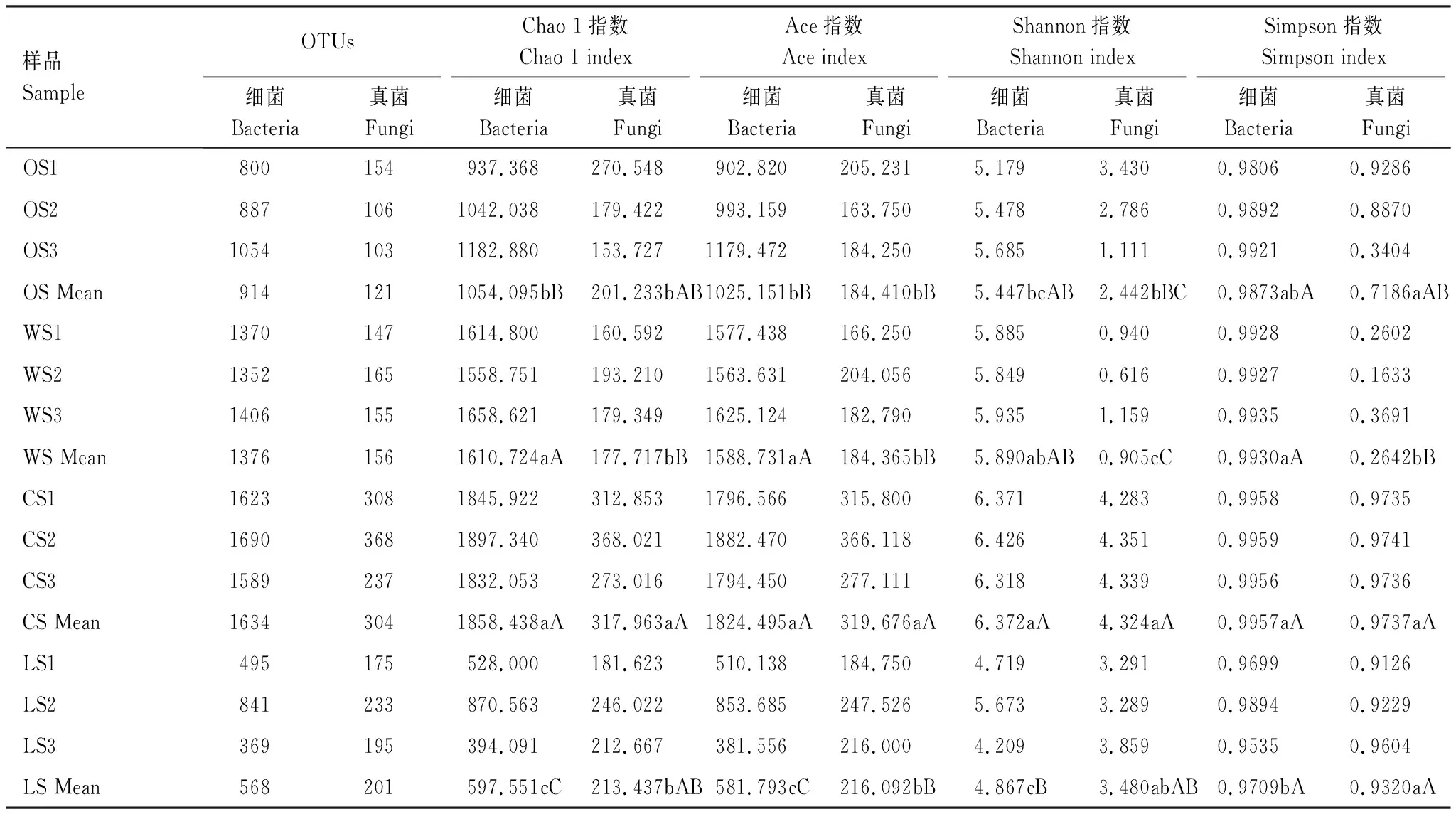
表2 古大湖湿地12个盐碱土壤样品微生物丰富度和群落多样性指数
2.4 土壤微生物群落多样性差异分析
基于Bray-cutis距离(表3),在OTU水平上利用物种有无及其相对丰度信息进行4种生境类型土壤样品微生物群落多样性相似性分析,蓝色越深代表差异性越小,相似性越大,而红色越深表示差异性越大,相似性越小。如图4中,OS与其余3种生境类型的土壤细菌群落多样性具有差异(dBCD> 0.7),甚至OS1与LS几乎没有相似性(dBCD> 0.9),而相比之下,CS与WS最近(dBCD< 0.6)。可以看出,不同生境类型土壤细菌群落多样性具有一定的差异。在同一生境类型条件下,不同采样点间具有相似性,特别是在WS中较为显著(dBCD< 0.25)。
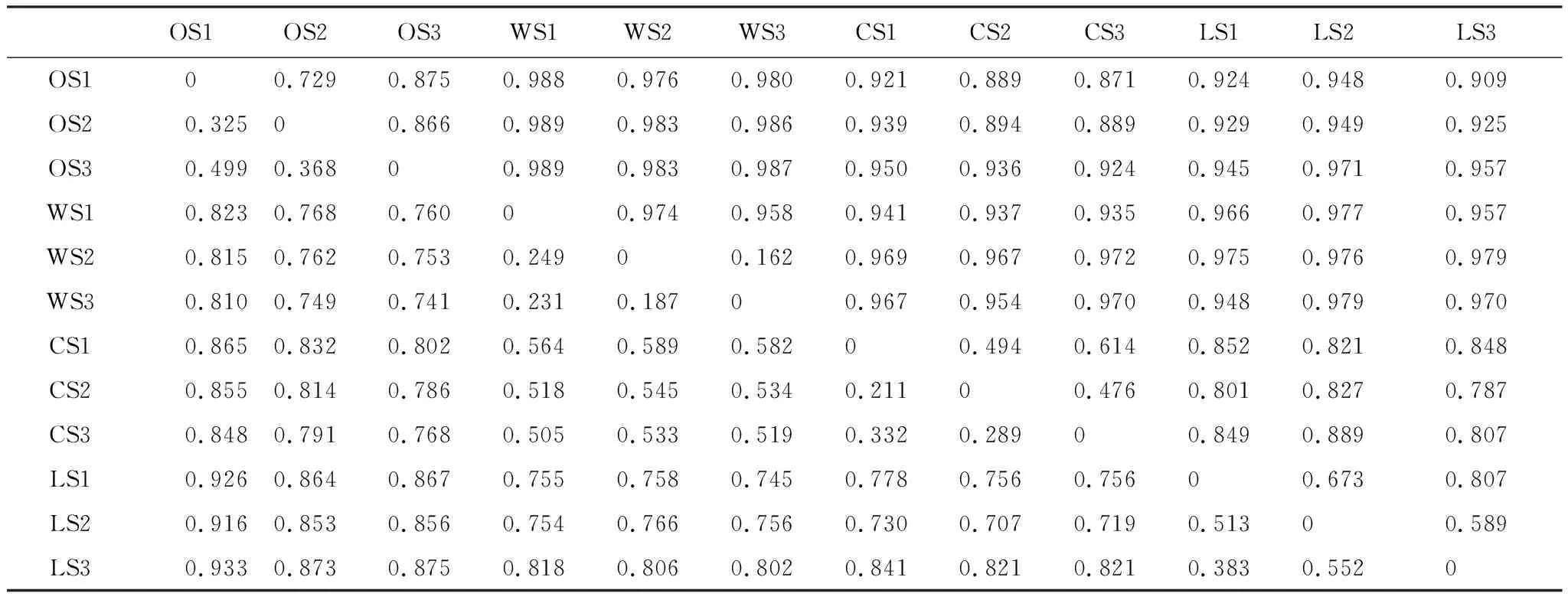
表3 古大湖湿地12个盐碱土壤样品微生物OTU水平Bray-cutis距离矩阵
如图4,各生境类型间土壤真菌群落多样性的相似性均较小,同一生境类型条件下不同采样点间也存在一定的差异。WS2与WS3具有较高的相似性(dBCD= 0.162),最先被分出,说明两者在物种组成及相对丰度上与其余生境类型间存在较大差异。WS1与WS2、WS3具有差异性(dBCD> 0.95),处于不同分支。相比之下,CS与LS关系最近,但两者相似度并不高(dBCD接近0.8)。因此,生境类型和采样点差异对真菌群落多样性均具有较大的影响。
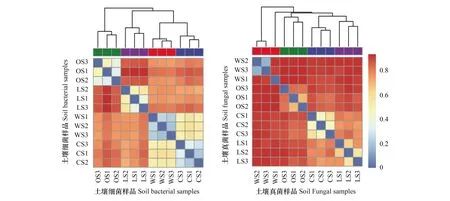
图4 古大湖湿地盐碱土壤细菌与真菌群落多样性差异分析热图Fig.4 Difference analysis heatmap of saline soil bacteria and fungi community diversity of Gudahu wetland
2.5 土壤环境因子及其对微生物群落多样性的影响分析
2.5.1土壤理化指标测定结果
古大湖湿地以盐碱土壤为主,4种生境类型条件下(表4),OS的pH值最高,与其余3种生境类型土壤达到极显著差异。OS与CS含水量接近,均低于LS,而相比之下,WS在秋季含水量最低。CS的土壤养分含量中,除AN与OS、TP与WS的接近之外(差异不显著),TOC((32.97±3.03) g/kg)、TN((4.06±0.24) g/kg)、AP((80.39±1.68) mg/kg)及AK((333.32±27.26) mg/kg)含量均最高,具有极显著差异,而LS中的6项土壤养分含量均处于较低水平。

表4 古大湖湿地4种生境类型土壤样品理化指标
2.5.2土壤理化指标与微生物群落多样性关系分析
依据细菌、真菌样品OTU相对丰度矩阵,得到DCA结果中梯度长度在第一轴上的值分别为3.858和6.798,本研究中均选择CCA。图5中土壤细菌群落多样性与8项理化指标相关性分析,第一、二排序轴分别解释总物种变量的28.1%、21.6%,pH值(P< 0.01)与第一排序轴成正相关,相关系数为0.7518,解释总理化指标的27.93%,对OS细菌群落多样性的影响程度最高。M(P< 0.01)与第二排序轴相关系数为0.7977,LS细菌群落多样性受M的影响程度最大。其余6个理化指标主要影响CS、WS细菌群落多样性,而两者样品分布集中,即受各理化指标影响程度相当。各土壤理化指标的影响程度均达到极显著水平(P< 0.01),表明古大湖湿地盐碱土壤细菌多样性对土壤环境因子敏感。
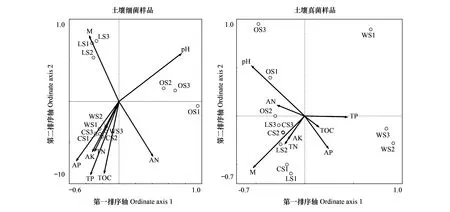
图5 古大湖湿地盐碱土壤理化指标和细菌与真菌群落多样性的典范对应分析Fig.5 CCA between saline soil physicochemical indexes and bacterial/fungal community diversity of Gudahu wetland
图5中土壤真菌群落多样性与理化指标的相关性分析,第一、二排序轴的解释量均较低,仅占总物种变量的15.4%、13.8%。同一生境类型的不同样品在第一排序轴上分布接近,但第二排序轴上分布散乱,在一定程度上反映出古大湖盐碱土壤真菌群落多样性在不同采样点间差异较大。8个土壤理化指标中,pH值(P< 0.01)、M(P< 0.05)分别可以解释总环境变量的18.07%和17.97%,与第一排序轴均成负相关,相关系数分别为-0.5487和-0.5320。pH值对OS真菌群落多样性影响最大,而M对LS、CS及OS真菌群落多样性均有影响,影响程度大于WS。其余理化指标对真菌群落多样性的影响不显著(P> 0.05),说明古大湖盐碱土壤真菌群落多样性对土壤环境因子敏感程度低。
3 讨论
3.1 古大湖湿地盐碱土壤微生物群落结构特征
盐碱土壤微生物中细菌的种类及数量上常处于绝对优势[19],且细菌的生长和繁殖能力常优于真菌[20]。同样,在古大湖湿地盐碱土壤中细菌种数大于真菌。古大湖湿地盐碱土壤细菌组成包括变形菌门、酸杆菌门、放线菌门等,原生土壤中芽单胞菌门占有一定的比例,但与其他湿地土壤常见细菌门水平组成的报道[3, 21-23]差异不大,说明古大湖湿地土壤细菌特有性程度低。变形菌门在不同环境中广泛分布,适应能力强[24-25],同样广泛存在于以盐碱土壤为主的古大湖湿地中。该门的鞘氨醇单胞菌属具有去除难降解污染物的能力[26],Aliihoeflea可去除水体砷污染[27],盐单胞菌属和海洋杆菌属同样见于水体中,均具有重要的生态功能[28-29],在古大湖湖岸土壤中多见,具有深入研究的必要。酸杆菌门在自然环境中同样十分常见,但多难以培养,可以降解植物纤维素等大分子聚合物[30]。本研究发现酸杆菌门主要存在于林地土壤中,可能与木本植物落叶中含大量纤维素有关。
盐碱土壤条件不利于真菌生长[10],相比于前人报道[20, 31-32]的非盐碱土壤真菌种类数量,本研究原生土壤中从总体上偏低。古大湖湿地盐碱土壤真菌门水平种类组成与其他盐碱湿地[33-34]相近,特有性程度低。真菌可参与分解纤维素、树胶、木质素及多糖和蛋白质等有机物,在腐殖质的形成过程中发挥重要的作用[35],提高盐碱土壤的质量[36]。绝大多数已知真菌属于子囊菌门与担子菌门,两者关系密切,前者中未分类物种数量非常多[37]。在本研究中,土壤真菌在属水平上存在未分类类群,绝大多数属于子囊菌门,说明古大湖湿地盐碱土壤中具有发掘真菌新种的潜力。担子菌门的鬼伞属为大型真菌,多数种具有食用、药用价值[38],偶见于古大湖湿地原生土壤中,而滑锈伞属、丝膜菌属多出现在林地土壤中,可与木本植物形成共生菌根,增强木本植物抗性[39-40]。纪垚等[41]研究表明不同植被恢复方式和同一恢复方式条件下土壤真菌种类差异不大,但数量上具有差异性。本研究结果同样表明,在考虑相对丰度时,真菌群落多样性在不同生境类型及同一生境不同采样点间均具有差异,在一定程度上反映出土壤真菌种类集中于几个大类群,但相对丰度上受生境类型的影响较大。
3.2 古大湖湿地盐碱土壤微生物群落多样性
土壤微生物群落多样性常受季节变化的影响[22, 24],季节变化引起土壤盐分及水质改变,进而影响到微生物活性,使其群落多样性发生动态变化[42]。张巍和冯玉杰[10]认为松嫩平原土壤微生物群落多样性一般在8月达到最大值。邵璐和姜华[33]提出秋季温度、水分等良好的气候条件下适宜真菌的生长发育,但在不同季节优势群落一般是稳定的。本实验对秋季土壤微生物群落结构及多样性进行了分析,对于不同时期的比较还有待于进一步研究。
植物与土壤环境因子相互作用,影响土壤微生物群落多样性[14, 35],其中pH值对土壤微生物种类及数量影响程度最为显著[3-4,17],具有最佳的指示作用[8, 43],在以盐碱土壤为主的古大湖湿地4种生境类型中表现更为明显。原生土壤pH值高于其他3种生境类型,达到极显著水平,主要分布碱蓬、碱蒿、碱地肤等耐盐碱植物,伴生物种稀少,细菌群落相对独立,多样性偏低。除原生土壤外,其他3种生境类型土壤均在不同时期、不同程度上受到人为干扰。耕地土壤受耕种、施肥等影响,pH值、含水量及土壤养分含量均适宜作物生长,同时微生物群落丰富度及多样性随之增高。古大湖湖岸利用湖底泥沙修筑堤坝,导致湖岸土壤呈砂质,植被种类较单一,细菌丰富度及多样性均最低。此外,土壤含水量过高或过低均不利用细菌生长[12, 44],湖岸土壤受季节性的水位变化影响,导致细菌多样性进一步降低。古大湖湿地土壤细菌对土壤理化指标敏感,湖岸土壤养分含量低,不利于细菌生存,而林地土壤理化指标与耕地土壤的接近,两者细菌群落多样性差异不显著。
真菌和细菌代谢底物有所不同,真菌抵抗环境胁迫的能力比细菌更强[45]。本研究中发现土壤真菌多样性只受到pH值和含水量的显著影响,且含水量对湖岸土壤真菌群落多样性影响最大,适宜的土壤含水量有利于提高真菌群落多样性,过高或过低的含水量均会影响真菌的生存和繁殖[46-47]。因此,在土壤养分含量对真菌群落多样性影响不显著的情况下,相比于原生土壤过高的pH值和林地土壤秋季过低的含水量,湖岸土壤真菌群落多样性较高。此外,林地土壤真菌群落组成过于单一,均匀度差导致其真菌群落多样性低于原生土壤。
3.3 古大湖湿地退耕还湿植被修复
盐碱土壤处于脆弱的生态状况下,极易进一步退化[10]。植被恢复既可改良盐碱土壤[48],也可改善已退化湿地的土壤环境,提高植物和土壤微生物的多样性[23]。在古大湖国家湿地公园周边耕地实施退耕还湿过程中,既要考虑土壤理化性质,同时也要参考土壤微生物群落结构差异,这对于选用何种植被进行退耕还湿工作具有重要的指导意义。通过对4种生境类型土壤微生物群落结构及多样性的研究可知,耕地土壤与林地土壤的细菌群落相近,与湖岸土壤的真菌群落相近,但与原生土壤细菌及真菌群落均有差异。林地植被能够提高微生物多样性和土壤肥力[8, 49-50],恢复土壤生态。因此在保护古大湖湿地生物多样性的前提下,且考虑湖岸植被对水需求量大的限制因素,建议优先增加林地面积,以防止退耕后的土壤逐渐退化。
4 结论
黑龙江省古大湖湿地原生土壤、林地土壤、耕地土壤及湖岸土壤中,细菌群落包括变形菌门、酸杆菌门、放线菌门等,真菌群落由子囊菌门、担子菌门等组成。耕地土壤与林地土壤中细菌群落多样性较高,其次为原生土壤,湖岸土壤的最低。耕地土壤与湖岸土壤真菌群落多样性较高,原生土壤的偏低,林地土壤中的最低。同一生境类型条件下细菌群落多样性具有相似性,而真菌存在一定的差异;不同生境类型条件下细菌、真菌的相似性均较低。其中原生土壤细菌群落多样性与其余3种生境类型的差异较大,而林地土壤真菌群落多样性具有一定的特殊性。耕地土壤细菌群落多样性和林地土壤的接近,但其真菌的与湖岸土壤更相近。pH值、含水量对土壤细菌、真菌均有显著的影响,土壤细菌群落多样性对土壤环境因子非常敏感,而真菌对土壤环境因子敏感程度低。本文揭示了古大湖湿地盐碱土壤微生物群落结构及多样性在不同生境类型条件下的差异,为古大湖湿地盐碱土壤保护与合理利用提供参考依据,并为其退耕还湿工作提供理论指导。
