I2O5/NaNO2硝化反应合成富电子芳香族硝基化合物
2020-07-15潘乐昊
邵 莺, 吴 铭, 潘乐昊, 黄 磊, 吴 锦
(常州大学 石油化工学院,江苏 常州 213164)
芳香族硝基化合物,在生产、生活中应用广泛,可应用于炸药、香料和染料,也是很多医药和农药的重要功能基团。此外,由于硝基化合物中的硝基是活性很高的前导基团,极易转化为其他官能团,所以可以通过其合成复杂的目标分子,是一类重要的化工原料和合成中间体[1]。
目前已发展了许多的芳烃硝化方法[2],包括芳烃环上的亲电取代直接硝化[1,3-5],过渡金属催化的C—H活化硝化反应[6-7],芳胺的氧化[8-10]和芳卤的硝基取代[11]等。最经典的硝化反应是利用混酸(浓硝酸/浓硫酸)作为试剂,存在严重的环境不友好问题,包括产生大量废酸、设备腐蚀性大、反应条件苛刻、原子经济性差等[1]。Singal[3]用醋酸酐代替浓硫酸实现了肉桂醛的硝化;Suzuki等[4]用NO2/O3,无需酸即可实现硝化;Yang等[5]用硝酸铈铵实现了N,N-二烷基取代芳香叔胺的对位硝化;Fan等[6]以Ru(0)催化,用硝酸铜通过C—H活化反应实现了导向基间位芳烃的硝化;Xie等[7]用NaNO2实现Rh(Ⅲ)催化C—H活化在导向基邻位硝化。这些反应虽然区域选择性高,但是底物上均需要引入无法去除的导向基,局限性大,且需使用昂贵的过渡金属催化剂。Reddy[8]、 Krohn[9]和本课题组[10]分别实现了选择性直接氧化伯、仲、叔胺生成相应的芳香族硝基化合物,克服了直接硝化区域选择性差的问题。但原料价格昂贵,不利于工业生产。Fors 等[11]用Pd(0)催化,以NaNO2为硝基源,将芳氯直接取代转化为芳硝基化合物,依然存在原子经济性差的问题。Nicolaou等[12]报道,I2O5是稳定的氧化剂,即使在较高的的温度下亦可稳定存在[13],可用作醛、酮的脱氢氧化得到α,β-不饱和醛酮;文献[14]也报道了I2O5可以引发自由基反应,并且NaNO2和I2O5均为廉价化工原料。
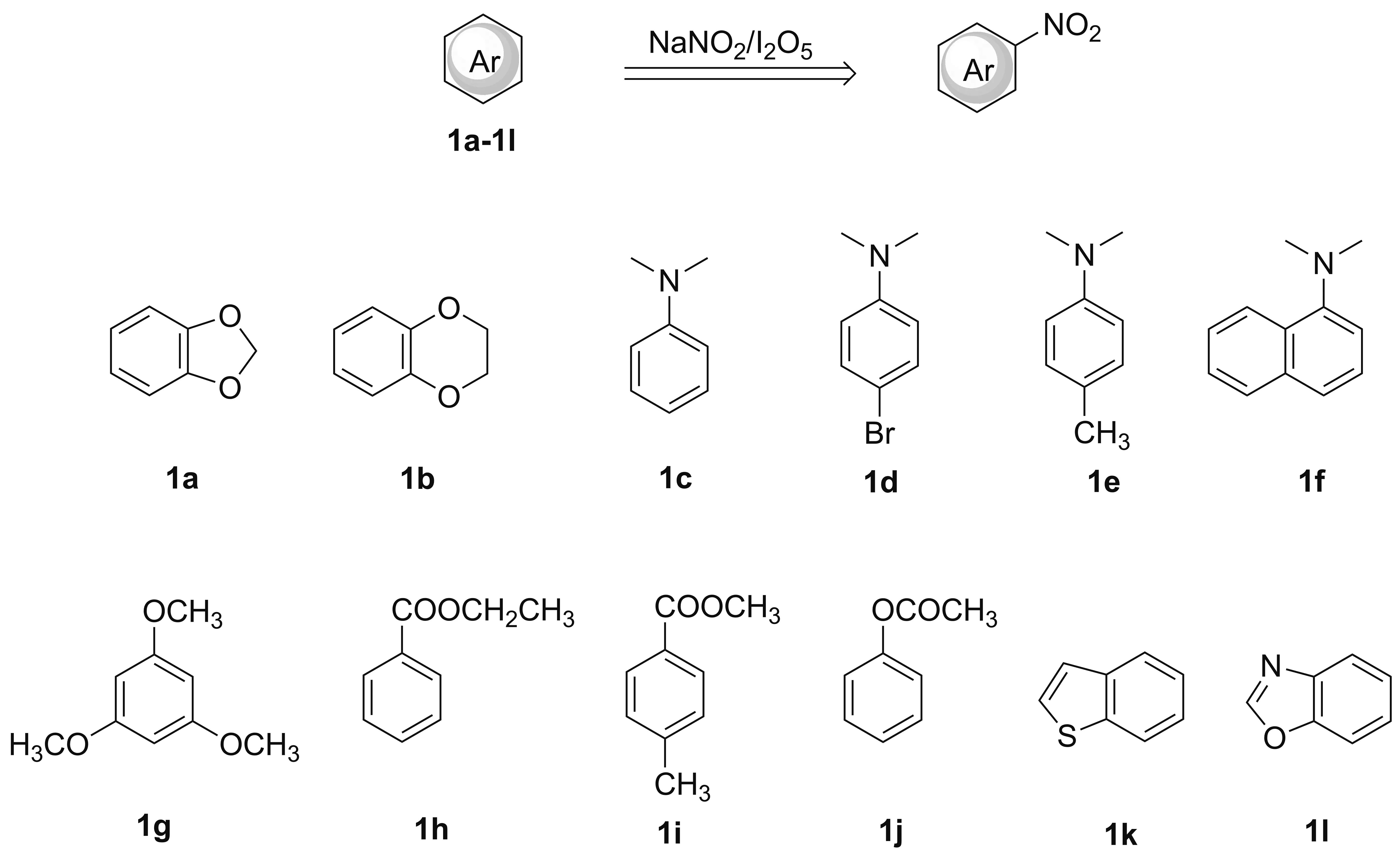
Scheme 1
鉴于此,本文以富电子芳烃1a~1l为底物(Scheme 1),在10~15 ℃,以V(硝基甲烷)/V(水)=20/1为混合溶剂,在NaNO2/I2O5共同作用下快速直接硝化得到其相应芳香族硝基化合物(Scheme 1)。所有产物(2a、2b、2c、2d、3c、4c、3e和3f)均为已知化合物,其结构经1H NMR和MS(EI)确证。并提出了该反应的自由基历程。
1 实验部分
1.1 仪器与试剂
XRC-1型熔点仪(温度未校正); Brucker AC-300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);GCMS QP-2010型气色谱-质谱联用仪。
所用试剂均为分析纯或化学纯。
1.2 合成
(1) 硝化产物的合成(以2a为例)
在空气中,向10 mL封口耐压管中依次加入苯并[d][1,3]二氧杂环戊烷1a61 mg(0.5 mmol), I2O5835 mg(2.5 mmol), NaNO2173 mg(2.5 mmol)、 CH3NO22 mL和水0.1 mL,剧烈搅拌下于15 ℃反应2 h(TLC跟踪)。加入无水亚硫酸钠终止反应,加入饱和Na2S2O315 mL ,分液,水相用CH2Cl2(3×15 mL)洗涤,合并有机相,用无水Na2SO4干燥,过滤,减压蒸去溶剂,残余物经硅胶柱层析[洗脱剂:V(乙酸乙酯)/V(石油醚)=1/5]纯化得淡黄色固体2a[15]70 mg,收率84%, m.p.145~147 ℃ (144 ~146 ℃[11]);1H NMR(300 MHz, CDCl3)δ: 7.90(dd,J=8.6 Hz, 2.3 Hz, 1H), 7.67(d,J=2.3 Hz, 1H), 6.87(d,J=8.6 Hz, 1H), 6.15(s, 2H); MS(EI)m/z: Calcd for C7H5NO4{ [M+H]+}168.03, found 168.00。
以2,3-二氢苯并[b][1,4]二氧杂环己烷1b为原料,用类似方法合成白色固体2b[16]70 mg,收率77%, m.p.121~122 ℃(120 ℃[17]);1H NMR(300 MHz, CDCl3)δ: 7.81~7.75(m, 2H), 6.99~6.81(m, 1H), 4.34(ddd,J=5.6 Hz, 4.3 Hz, 2.6 Hz, 4H); MS(EI)m/z: Calcd for C8H7NO4{ [M+H]+}181.04, found 181.00。
以N,N-二甲基苯胺1c为原料,用类似方法合成邻位硝化的2c,对位硝化的3c和邻对位二硝化4c。
2c[18]: 棕色油状液体8.31 mg,收率10%,1H NMR(300 MHz, CDCl3)δ: 7.78(dd,J=8.2 Hz, 1.6 Hz, 1H), 7.43~7.37(m, 1H), 7.03(dd,J=8.5 Hz, 1.0 Hz, 1H), 6.85~6.80(m, 1H), 2.90(s, 6H); MS(EI)m/z: Calcd for C8H10N2O2{[M+H]+}166.07, found 166.00;3c[18]: 淡黄色固体14.96 mg,收率18%, m.p.162~163 ℃(168~170 ℃[17]);1H NMR (300 MHz, CDCl3)δ: 8.12(d,J=9.5 Hz, 2H), 6.60(d,J=9.5 Hz, 2H), 3.12(s, 6H); MS(EI)m/z: Calcd for C8H10N2O2{[M+H]+}166.07, found 166.00;4c[19]: 橘黄色固体35.90 mg,收率34%, m.p.62~64 ℃(74~75 ℃[20]);1H NMR(300 MHz, CDCl3)δ: 8.68(d,J=2.7 Hz, 1H), 8.20(dd,J=9.5 Hz, 2.7 Hz, 1H), 7.03(d,J=9.5 Hz, 1H), 3.07(s, 6H); MS(EI)m/z: Calcd for C8H9N3O4{[M+H]+}211.06, found 211.00。
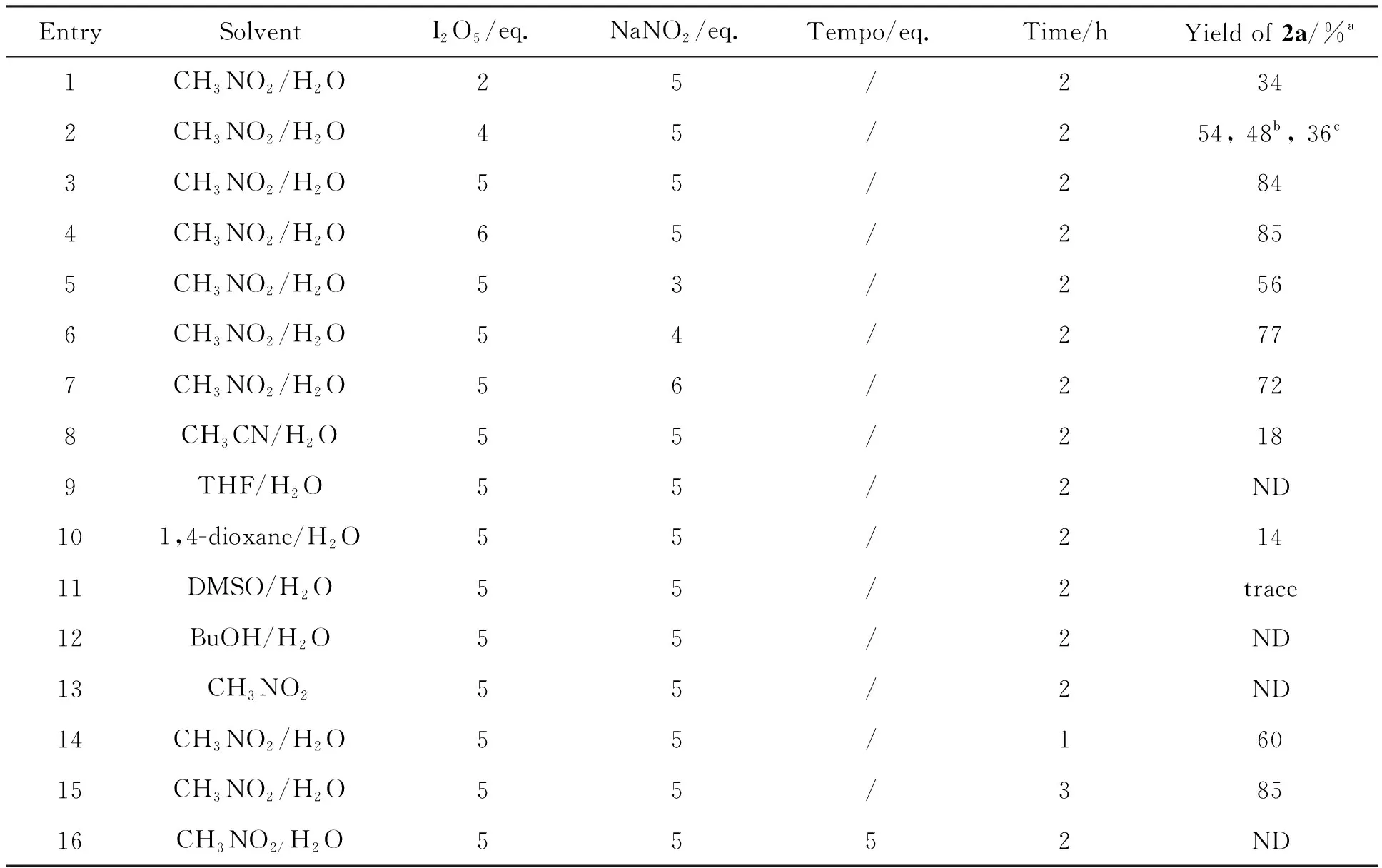
表1 反应条件的优化
a柱层析分离收率,反应温度为15 ℃,化合物1a0.5 mmol,有机溶剂2 mL,水0.1 mL;b反应温度为25 ℃;c反应温度为40 ℃。
以化合物N,N-二甲基-4-溴苯胺1d为原料,用类似方法合成橘黄色固体2d[21]: 53.90 mg,收率44%, m.p.63~64 (67.5 ℃[24])];1H NMR(300 MHz, CDCl3)δ: 8.68(d,J=2.7 Hz, 1H), 8.20(dd,J=9.5 Hz, 2.7 Hz, 1H), 7.03(d,J=9.5 Hz, 1H), 3.08(s, 6H); MS(EI)m/z: Calcd for C8H9N2O279Br{[M+H]+}243.98, found 244.00; C8H9N2O281Br{[M+H]+}245.98, found 246.00。
以化合物N,N,4-三甲基苯胺1e为原料,用类似方法合成黄色油状液体3e[22]: 64.15 mg,收率57%;1H NMR(300 MHz, CDCl3)δ: 7.63(d,J=0.6 Hz, 2H), 2.79(s, 6H), 2.40(s, 3H); MS(EI)m/z: Calcd for C9H11N3O4{[M+H]+}225.08, found 225.00.
以化合物N,N-二甲基-1-萘胺1f为原料,用类似方法合成橘黄色油状液体3f[23]: 44.32 mg,收率34%;1H NMR(300 MHz, CDCl3)δ: 8.73(d,J=8.7 Hz, 1H), 8.60(s, 1H), 8.38(d,J=8.2 Hz, 1H), 7.86~7.80(m, 1H), 7.74~7.69(m, 1H), 3.11(s, 6H); MS(EI)m/z: Calcd for C12H11N3O4{[M+H]+}261.07, found 261.00。
2 结果与讨论
2.1 反应条件的优化
以1a的硝化反应为例,对反应条件进行了优化,结果见表1。 Entry 1~4和5~7分别为I2O5和NaNO2对收率的影响。两者用量均为5 eq.时收率最优,相应的硝化产物2a的收率可达84%。
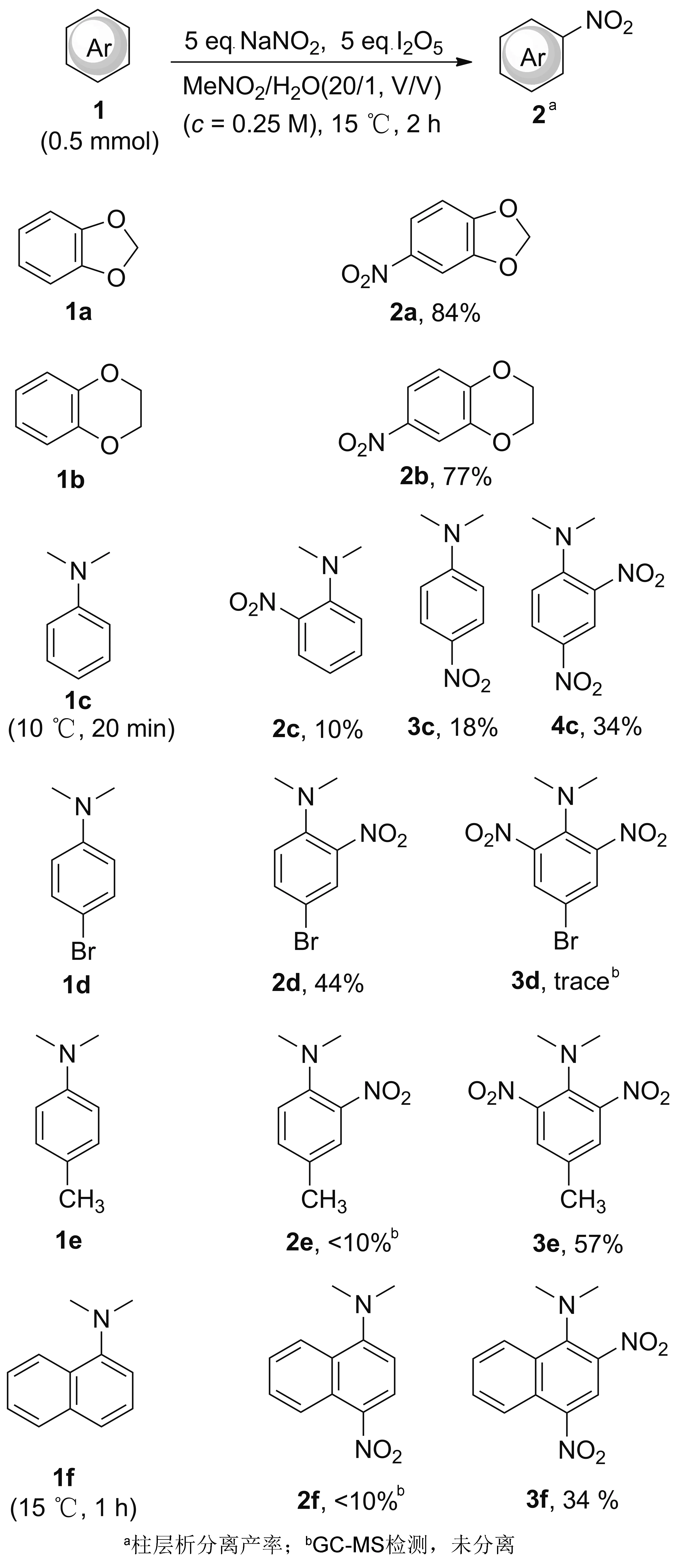
Scheme 2
为了降低I2O5的用量,尝试使用4 eq.I2O5,并升高温度至25 ℃或者40 ℃(Entry 2),收率大幅降低,可见本体系对于温度非常敏感。Entry 8~13为溶剂对收率的影响,选用其他质子性或者偶极溶剂和水的混合溶剂代替CH3NO2/H2O,收率均明显下降。如果仅用CH3NO2为溶剂,未得到任何硝化产物。考虑试剂是无机盐,添加了水可以大大提高溶解度,促进反应进行。Entry 14~15为反应时间对反应的影响,若缩短时间为1 h,收率仅为60%,若延长至3 h,收率并未明显提高。
综上,合成2a的最优条件为:1a(0.5 mmol),I2O5(2.5 mmol, 5eq.), NaNO2(2.5 mmol, 5 eq.)、 CH3NO2(2 mL)和水(0.1 mL),于15 ℃反应2 h。
2.2 反应底物的拓展
按合成2a的方法,拓展其他富电子底物如2,3-二氢苯并[b][1,4]二氧杂环己烷1b和N,N-二甲基苯胺1c的反应。二者均能高收率得到硝化产物,并且产物均有邻对位选择性(Scheme 2)。而原料N,N-二甲基-4-溴苯胺1d,N,N,4-三甲基苯胺1e,N,N-二甲基-1-萘胺1f均可以以中等收率得到相应的产物,电子效应和位阻效应均显著影响产物的生成。1c即使降低温度,缩短反应时间,依然有邻和对单硝化产物2c和3c和邻对双取代产物4c生成;当1c的对位被吸电子基Br取代的时候,硝化1d仅得邻位单取代产物2d; 当1c对位被吸电子基CH3取代的时候,硝化1e主要得到两个邻位双取代产物3e,受位阻效应影响,收率仅为57%。
当以大位阻的富电子的1,3,5-三甲氧基苯1g为原料,即使反应12 h,依旧只检测到痕量的硝化产物,可见位阻对该反应影响很大。
当芳环上有吸电子基的苯甲酸乙酯1h,即使升高反应温度,延长反应时间也得不到对应硝化产物。而有弱给电子基的对甲基苯甲酸甲酯1i和乙酸苯酯1j在该反应条件下,用GC-MS可检测到的痕量硝化产物。富电子杂环化合物苯并噻吩1k、苯并噁唑1l,在此条件下得到了复杂产物,难以分离。因此,本硝化体系仅适用于富电子芳烃底物。
2.3 反应机理
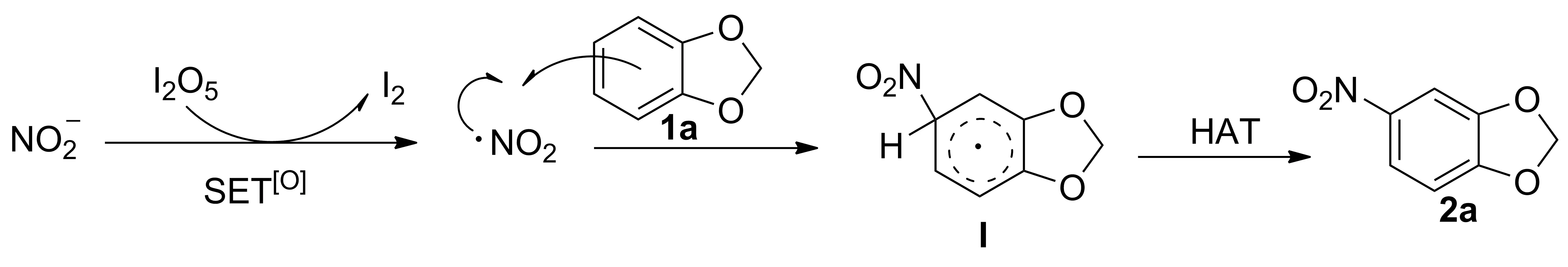
Scheme 3
本文报道了以富电子芳香族化合物为底物,在I2O5和NaNO2作用下合成相应的芳香族硝基化合物的新方法。该方法具有原料易得、条件温和、高效、操作简便和对环境友好等优点。
