RSRC2 影响三阴性乳腺癌细胞增殖迁移及侵袭的初步研究
2020-07-15李勇莉赵秀兰张宁董学易班新超廖诗晗刘铁菊
李勇莉,赵秀兰,张宁,董学易,班新超,廖诗晗,刘铁菊
(天津医科大学基础医学院病理学教研室,天津300070)
乳腺癌是女性最常见的恶性肿瘤之一。在我国,乳腺癌的发病率和死亡率分别高居女性恶性肿瘤的首位和第5 位[1]。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor-receptor 2,HER-2)均为阴性的三阴性乳腺癌是乳腺癌的一种特殊亚型,约15%~20%乳腺癌患者属于此类型[2]。三阴性乳腺癌较其他类型的乳腺癌发病年龄更早,更易复发和发生远处转移,预后最差[3]。富含精氨酸/丝氨酸卷曲螺旋2(arginine/serine-rich coiledcoil 2,RSRC2),又称为食道癌抑制生长蛋白,是近年来新发现的一种肿瘤抑制基因。它位于12q24,基因表达产物由434 个氨基酸组成[4]。RSRC2 在多种正常器官中广泛表达,而在肺中的表达水平明显高于胃、小肠、肾脏、肝脏等。研究表明,RSRC2 可影响细胞生长和增殖,但是它在肿瘤进展中如何发挥作用鲜有研究[5]。本研究旨在通过调控RSRC2 在三阴性乳腺癌细胞系中的表达,探究RSRC2 对三阴性乳腺癌生物学行为的影响。
1 材料与方法
1.1 材料
1.1.1 细胞株 人乳腺癌细胞系MDA-MB-231、人肾上皮细胞系293T 均购自(美国)ATCC 公司。
1.1.2 实验试剂 DMEM、Opti-MEM 培养基购自(美国)Neuronbe 公司,胎牛血清购自(美国)Gibco公司,质粒和慢病毒包装试剂盒均购自(美国)Genecopoeia 公司:RSRC2 过表达质粒(EX-H8692-Lv201),RSRC2 过表达对照质粒(EX-NEG-Lv201),RSRC2 降表达质粒(HSH017340-31-LvRU6GP),RSRC2 降表达对照质粒(CSHCTR001-LvRU6GP),慢病毒包装试剂盒(HPK-LvTR-40)。Transwell 小室购自(美国)FALCON 公司,Matrigel 胶购自(美国)Invitrogen 公司。RSRC2 抗体(R36896)购自(美国)NOVUS 公司,GAPDH 抗体(Sc25778)购自(美国)Santa Cruz 公司,二抗购自(北京)中杉金桥公司。
1.2 方法
1.2.1 细胞培养 人乳腺癌细胞系MDA-MB-231、293T 细胞培养于添加有10%胎牛血清(FBS)、1%双抗(100 U/mL 青霉素,100 U/mL 链霉素)的DMEM培养基中,37℃、5%CO2培养箱中培养。
1.2.2 细胞转染 培养293T 细胞,转染前2 d 换成含10%热灭活血清的DMEM 培养基,转染时按照慢病毒包装试剂盒说明书添加相关转染试剂及RSRC2 过表达、降表达和空载体对照质粒,12~14 h后换成含5%热灭活血清和1%双抗的培养基,继续培养48 h 后过滤细胞碎片,收集上清液。在6 孔板中用含56℃热灭活血清的培养基培养MDA-MB-231 细胞24 h,每孔中添加2 mL 病毒液和12 μL Polybrene,12~14 h 后替换成不含Polybrene 的培养基培养,48h 后镜下观察转染效率,嘌呤霉素进行药筛,并建立稳定转染的MDA-MB-231 细胞系。
1.2.3 Western blot 将培养皿中的细胞裂解后提取其蛋白并测其蛋白浓度,将等量的各蛋白上样于10%聚丙烯酰胺凝胶中电泳,于PVDF 膜湿转90 min,pH 值为7.0 的5%脱脂牛奶中封闭1 h,加入适量的一抗,于摇床孵育1 h 后,4℃孵育过夜。次日于摇床1 h 恢复室温,TBST 洗涤缓冲液洗膜3 次,添加对应的二抗,37℃摇床孵育2 h,再次用TBST 洗涤膜3 次,加入发光液后避光显影,拍照保存。采用Image J 进行蛋白条带灰度值分析。
1.2.4 Transwell 迁移侵袭实验 迁移实验不铺Matrigel 胶,侵袭实验需提前在小室上层铺一层Matrigel胶。消化细胞,制备无血清的细胞悬液,调整细胞数至2×105个/mL,取200 μL 无血清细胞悬液添加至上室,500 μL 完全培养基添加至下室,迁移实验培养12 h 后,侵袭实验培养36 h,之后预冷甲醇固定20 min,结晶紫染色1 h,清水冲洗后,用棉签擦拭未穿过的细胞,镜下观察,随机选5 个视野拍照计数并分析。
1.2.5 划痕实验 适量的细胞接种至6 孔板,当细胞融合度达95%,用100 μL 枪头划一直线,PBS 冲洗划掉的细胞,添加含1%FBS 和1%双抗的低浓度血清的培养基,拍照后继续在37℃、5% CO2培养箱中培养。在0、12、24 h 观察愈合情况,并拍照保存。用Image J 软件测各组的划痕面积。
1.2.6 平板克隆形成实验 消化实验所用细胞,制备细胞悬液,调整细胞数至104个/ mL,吸取30 μL细胞悬液和2 mL DMEM 培养基到6 孔板中,培养箱中培养10 d。PBS 冲洗3 遍,冷甲醇固定25 min,结晶紫染色25 min,自来水冲洗后晾干,观察并拍照。
1.3 统计学分析 采用GraphPad Prism 8.0 软件进行统计学分析。符合正态分布的计量资料采用(±s表示,两组间均数比较分析采用t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 Western blot 法验证转染效果 Western blot法检测MDA-MB-231 细胞过表达RSRC2 及降表达RSRC2 后,RSRC2 在MDA-MB-231 细胞中的蛋白表达量的变化。结果显示:过表达RSRC2 的MDA-MB-231 细胞中RSRC2 的蛋白表达量明显高于对照组,降表达RSRC2 的MDA-MB-231 细胞中的RSRC2 的蛋白表达量较对照组明显降低(均P<0.05),见图1。
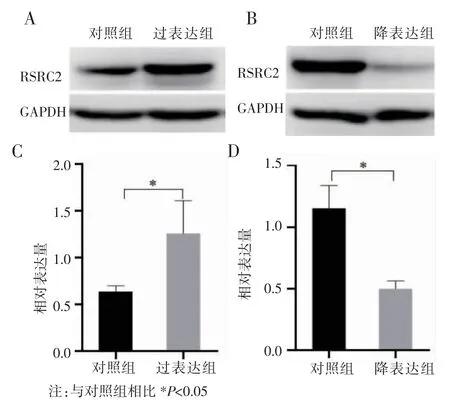
图1 Western blot 法检测RSRC2 转染后的蛋白表达变化Fig 1 Changes in the expression of RSRC2 protein
2.2 RSRC2 对乳腺癌细胞迁移侵袭能力的影响 Transwell 迁移侵袭实验结果显示:迁移实验中,MDA-MB-231 细胞过表达RSRC2 后,与对照组相比,其细胞迁移数目减少,降表达RSRC2 后,与对照组相比,其细胞迁移数目明显增强(均P<0.05),见图2。侵袭实验中,MDA-MB-231 细胞过表达RSRC2 后,其穿过的细胞数较对照组减少,降表达RSRC2 后,其穿过的细胞数较对照组增加(均P<0.001),见图3。
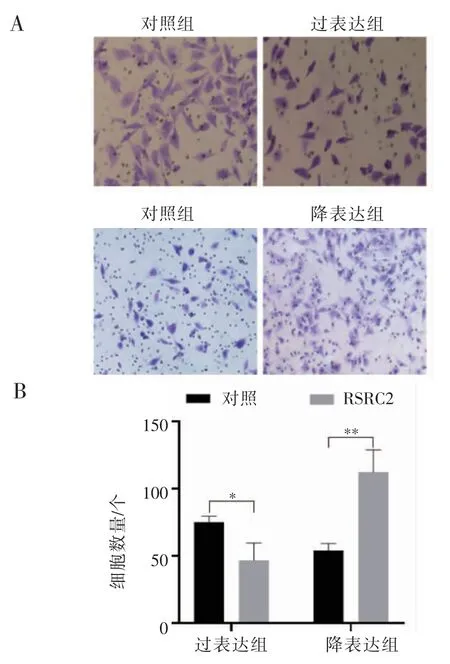
图2 RSRC2 对三阴性乳腺癌细胞MDA-MB-231 迁移能力的影响(100×)Fig 2 Effect of RSRC2 on the migration of MDA-MB-231 cells(100×)

图3 RSRC2 对三阴性乳腺癌细胞MDA-MB-231 侵袭能力的影响(100×)Fig 3 Effect of RSRC2 on the invasion of MDA-MB-231 cells(100×)
划痕实验中,分别于0、12、24 h 进行观察拍照,结果显示,过表达RSRC2 后的MDA-MB-231 细胞较对照组愈合能力减弱,而降表达RSRC2 后,其结果相反(均P<0.01),见图4。

图4 RSRC2 对三阴性乳腺癌细胞MDA-MB-231 愈合能力的影响(40×)Fig 4 Effect of RSRC2 on the healing ability of MDA-MB-231 cells(40×)
2.3 RSRC2 对细胞增殖能力的影响 平板克隆形成实验中,在培养箱培养10 d 后,终止培养,固定、染色、拍照,结果显示RSRC2 过表达、降表达和对照组的细胞都能形成克隆,但是RSRC2 降表达组形成的克隆数目明显多于对照组,而RSRC2 过表达组的结果正好与之相反,差异具有统计学意义(均P<0.05),见图5。
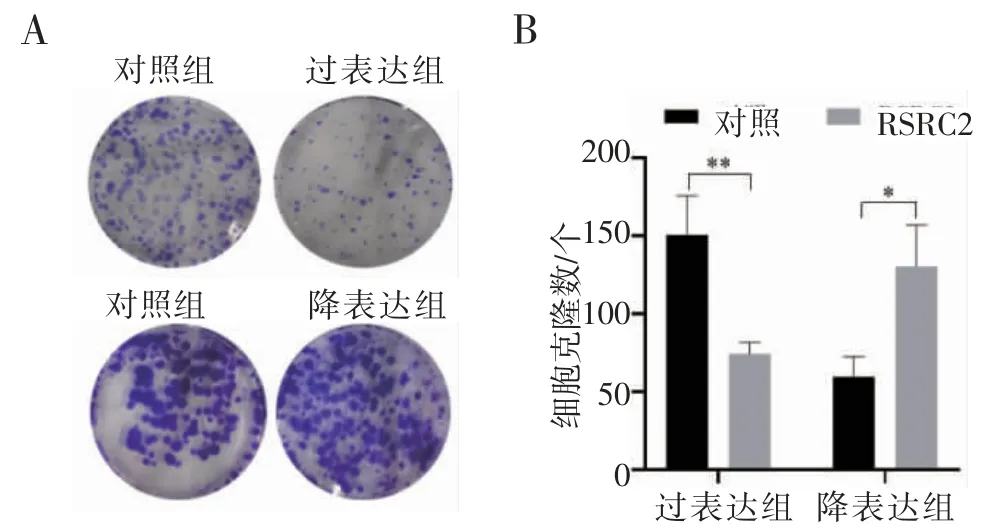
图5 RSRC2 对三阴性乳腺癌细胞MDA-MB-231 增殖能力的影响Fig 5 Effect of RSRC2 on the proliferation of MDA-MB-231 cells
3 讨论
乳腺癌具有异质性,其少见亚型三阴性乳腺癌具有独特的病理、遗传和临床特征[6]。由于缺乏内分泌治疗及抗HER2 治疗的有效靶点,至今仍未有针对性的标准的治疗方案,在临床上,化疗仍是治疗三阴性乳腺癌的主要手段[7]。由于三阴性乳腺癌的高度异质性,使癌细胞对紫杉醇等化疗药物易产生耐药,部分三阴性乳腺癌患者预后不良,因此迫切需要寻找新的分子靶点,为三阴性乳腺癌治疗提供可能的新思路[8-9]。
RSRC2 属于富含精氨酸/丝氨酸家族中的成员,在多种肿瘤中呈低表达。研究显示,RSRC2 过表达后可以显著抑制食管癌细胞系TE8 的增殖能力[5]。在结肠癌中的研究发现,细胞因子信号转导抑制因子3(SOCS3)降表达细胞的增殖、迁移、侵袭等恶性生物学行为增强,同时伴有RSRC2 表达水平的降低[10]。SOCS3 属于细胞因子信号转导家族,它能抑制Janus 激酶(JAK)活性和其下游信号转导及转录激活因子(STAT)蛋白的磷酸化,阻止JAK/STAT 信号通路的激活,进而抑制肿瘤细胞生长、增殖、侵袭和迁移[11-13]。因此,RSRC2 可能是SOCS3 下游效应因子。本研究通过平板克隆形成实验发现,过表达、降表达及对照组的细胞均能形成克隆,但是形成克隆的数量存在差异:过表达组明显少于对照组,而降表达组多于对照组。因此,本研究结果表明RSRC2在三阴性乳腺癌细胞中发挥了肿瘤抑制基因的作用,其表达能够抑制肿瘤细胞的增殖。
另有研究发现,RSRC2 是调控CD40 的调节蛋白,人类B 细胞系BL2 中RSRC2 降表达后,CD40 的蛋白表达量相应的增加[14]。CD40 是Ⅰ型跨膜糖蛋白,在肿瘤侵袭、转移及血管生成中发挥重要作用[15-17]。此外,文献报道,RSRC2 在胰腺导管癌中的表达水平明显低于正常胰腺组织,且与胰腺导管癌的临床分期呈负相关[18]。RSRC2 表达量与食管癌浸润深度、淋巴结转移、血管浸润呈显著负相关,低表达RSRC2的患者预后差[5]。本课题组的前期研究通过免疫组化检测了RSRC2 在三阴性乳腺癌中的表达情况,发现癌组织中RSRC2 的表达量明显低于癌旁组织。RSRC2 蛋白水平的高低与生存率呈正相关,RSRC2 表达阳性患者生存时间长[19]。本研究通过迁移、侵袭实验及划痕实验发现降表达RSRC2 后,三阴性乳腺癌细胞的侵袭、迁移能力增强,这些体外实验结果说明了RSRC2 能够抑制三阴性乳腺癌细胞的迁移及侵袭等恶性生物学行为,从而在三阴性乳腺癌的进展中发挥重要作用。
DNA 甲基化是一种重要的表观遗传调控机制。大量研究已经证实,异常的DNA 甲基化通过沉默抑癌基因的表达而增强肿瘤细胞的恶性行为,因此它与肿瘤的发生、发展密切相关[20]。Kurehara 等[5]提出RSRC2 潜在下调机制是RSRC2 的高甲基化。Hernandez-Vargas 等[21]通过KEGG 通路分析发现在乳腺癌细胞中参与JAK/STAT 信号通路的基因表达降低与显著的高甲基化有关。Dong 等[10]研究表明,SOCS3 调节RSRC2 的表达,且两者表达水平呈正相关,而SOCS3 通过抑制JAK/STAT 信号通路而在肿瘤进展中发挥抑制作用。由此,笔者猜测RSRC2的高甲基化引起其表达下调,下调的RSRC2 通过激活JAK/STAT 信号通路,从而在三阴性乳腺癌发生、发展中起作用。
综上所述,RSRC2 在三阴性乳腺癌组织中呈现低表达,降低RSRC2 表达后,三阴性乳腺癌细胞的恶性生物学行为随之增强,表明RSRC2 在三阴性乳腺癌的进展中可能起肿瘤抑制基因的作用,其抑制作用的发挥可能是通过抑制JAK/STAT 信号通路的激活来实现的。接下来,笔者将进行大量的体内外实验验证RSRC2 通过抑制JAK/STAT 信号通路激活而发挥抑制作用这一猜想的正确性,旨在为三阴性乳腺癌治疗提供一些新依据。
