上海地区猪流感病毒的分离与鉴定
2020-07-13刘健杨显超葛菲菲李鑫杨德全沈海潇鞠厚斌王建赵洪进
刘健,杨显超,葛菲菲,李鑫,杨德全,沈海潇,鞠厚斌,王建,赵洪进
(上海市动物疫病预防控制中心,上海 201103)
猪流感(swine influenza,SI)是由A型流感病毒引起的一种急性、热性、高度接触性呼吸道传染病,典型症状为猪突然发病,短期发热、食欲不振、嗜睡、咳嗽、呼吸困难及鼻腔流出分泌物等[1]。SI一年四季均可发生,但以冬、春和秋季多发,不同年龄、性别和品种的猪对该病均易感染。1930年Shope首次分离鉴定了经典H1N1亚型猪流感病毒(swine influenza virus,SIV)。一般认为人流感病毒具有宿主限制性,很少跨越种间屏障在另外的宿主群内建立稳定的谱系。但由于猪体内呼吸道上皮细胞同时具有人流感病毒受体唾液酸α-2, 6半乳糖苷和禽流感病毒(avian influenza virus,AIV)受体唾液酸α-2, 3半乳糖苷,因此猪既可以感染人流感病毒又可以感染AIV,被认为是禽、猪、人等不同流感病毒基因 重配的“混合器”[2-3]。
目前在猪群中流行的SIV主要有H1N1、H1N2和H3N2三种亚型。其中H1N1亚型SIV主要包括经典SIV、欧亚类禽H1N1 SIV、类人H1N1 SIV和2009 H1N1 SIV[4]。本研究从上海地区某猪场猪群的鼻腔中分离得到6株H1N1亚型SIV,选择其中1株将其命名为A/swine/Shanghai/1205/2017(H1N1),并对分离株进行病毒形态学、红细胞凝集特性、部分理化特性、血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)序列测定等研究。
1 材料与方法
1.1 材料
1.1.1 样品来源
2017年12月12日,从上海某猪场收集到疑似SIV症状猪的鼻拭子18份,冷藏,24h内送至实验室。
1.1.2 试剂
1.2 方法
1.2.1 样品检测
将采集的猪鼻拭子样品经A型流感病毒通用型荧光RT-PCR试剂盒检测,阳性样品用于病毒的分离。
1.2.2 病毒分离
将经荧光RT-PCR检测结果为A型流感病毒阳性的猪鼻拭子样品进行病毒分离。鼻拭子缓冲液5 000 r/min离心10 min,取上清,经0.22 μm微孔滤膜过滤后,置-80 ℃冻存备用。待MDCK细胞长满单层后,将处理好的病料样品接种至细胞单层,置于37 ℃吸附1 h,换上维持液(HDMEM+2%FBS)37 ℃、5 %浓度CO2培养箱中培养5~7 d,冻融3次收集病毒上清液。上清液再接种10日龄SPF鸡胚,尿囊腔接种0.2 mL/枚,每份样品接种3枚鸡胚,37 ℃培养72 h,弃去24 h内死亡的鸡胚,收集剩余未死或死亡鸡胚的尿囊液,并经SPF鸡胚盲传2代。
1.2.3 病毒鉴定
血凝素凝集试验:对收获的第一代细胞上清液、第二代和第三代鸡胚尿囊液进行血凝素凝集试验。
第六项工作是课程评价。在课程评价时,须注意处理好过程与结果、个人与小组、规范与创新、阶段与整体几对关系。
病毒电镜观察:将血凝阳性的第三代病毒尿囊液液经0.22 μm微孔滤膜过滤处理,送至华东师范大学,进行磷钨酸负染、透射电镜观察其形态和大小。
HA和NA序列的测定:参照文献提供的方法扩增分离株的HA和NA片段[1],HA节段的引物序列为:5′-AGCAAAAGCAGGGG-3′/5′-AGTAGAAACAAGGGTGTTTT-3′;NA节段的引物序列为:5′-AGCAAAAGCAGGAGT-3′/5′-AGTAGAAACAAGGAGTTTTTT-3′,其中HA片段大小为1 778 bp,NA片段大小为1 466 bp。将RT-PCR产物电泳,经凝胶回收,按pMD 18-T载体说明书进行连接、转化,阳性克隆送桑尼生物有限公司测序。
HA和NA核苷酸序列同源性分析和遗传演化分析:将HA和NA核苷酸序列经NCBI检索,进行同源性分析;借助DNAStar软件中的MegAlign程序进行进化分析并绘制系统发育树,确定病毒HA和NA亚型。
1.2.4 病毒特性研究
红细胞凝集试验:测定分离株对鸡、人O型、牛、猪、兔、绵羊和马等红血球(10 mL/L)的凝集活性[6]。
血凝素热稳定性试验:将分离株分为9组,分装于9个灭菌离心管中,置56 ℃水浴中分别处理0、5、15、30、60、90、120、150 min及过夜,处理后离心管迅速置于4 ℃冰箱5 min,分别测定其血凝效价[5]。血凝素热稳定性判定方法:设定血凝活性下降2个滴度的时间为T1,当T1≤ 5 min时为热不稳定型;当T1=15 min时为中等热稳定型;当T1≥ 30 min时为热稳定型。
耐热性试验:分离株分为7个组,每组1 mL,于50 ℃水浴作用10 min、20 min、30 min和60 min,60 ℃水浴作用10 min、20 min和30 min,每个处理接种3枚鸡胚,37 ℃培养,收集24~96 h死亡或未死亡鸡胚的尿囊液,测定血凝效价。病毒耐热性判定方法:设定水浴作用的时间为T2,当T2≥30 min病毒存活,则判定为该温度下耐热,否则为不耐热[5]。
乙醚敏感试验:取含SIV病毒的鸡胚尿囊液1 mL,加入0.25 mL乙醚,4 ℃作用24 h,同时用灭菌生理盐水代替乙醚作对照,每个处理接种3枚鸡胚,37 ℃培养,收集24~96 h死亡或未死亡鸡胚的尿囊液,测定其血凝效价[5]。
氯仿敏感试验:取含SIV病毒的鸡胚尿囊液,分为2组,每组1 mL,一组加入终浓度为48 mL/L的氯仿,4 ℃作用10 min;另一组用灭菌生理盐水代替氯仿作对照,每个处理接种3枚鸡胚,37 ℃培养,收集24~96 h死亡或未死亡鸡胚的尿囊液,测定其血凝效价[5]。
耐酸性试验:取含SIV病毒的鸡胚尿囊液,等量分装为2份,一份用0.1 mol/L盐酸调至pH 3.0,室温下作用3 h,再用56 g/L NaHCO3溶液将pH值调至7.0;另一份加入灭菌生理盐水,同样室温下放置1 h,以上2份尿囊液经10倍稀释后,每个处理接种3枚鸡胚,37 ℃培养,收集24~96 h死亡或未死亡鸡胚的尿囊液,测定其血凝效价[5]。
1.2.5 鸡胚半数感染量(EID50)的测定
病毒用PBS缓冲液10倍倍比稀释至10-12,接种10日龄SPF鸡胚,每个稀释度接种6枚,0.2 mL/胚,37 ℃培养,每隔8 h照胚1次,收集24~96 h死亡或未死亡鸡胚的尿囊液,分别测定血凝效价,病毒效价大于等于4 log2的尿囊液判为阳性[8]。按Reed-Muench法[9]计算EID50。
2 结果
2.1 样品检测
经A型流感病毒通用型荧光RT-PCR试剂盒检测,18份猪鼻拭子样品中有6份为SIV阳性。
2.2 SIV分离株血凝试验
将6份SIV阳性猪鼻拭子样品进行病毒分离,其细胞培养液和鸡胚尿囊液均有血凝性,选择其中1株病毒命名为A/swine/Shanghai/1205/2017(H1N1),经测试后其血凝价分别为4 log2、5 log2和5 log2。
2.3 病毒的电镜观察
在电子显微镜下A/swine/Shanghai/1205/2017(H1N1)病毒粒子为圆形、椭圆形及多型性,直径大小为80~120 nm(图1)。
2.4 HA和NA序列的测定及亚型鉴定
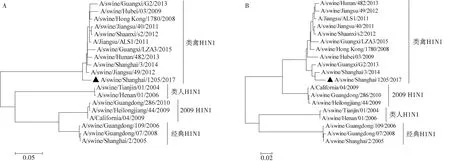
对A/swine/Shanghai/1205/2017(H1N1)进行HA和NA基因的测序,将序列上传至GenBank,登录号分别为MG983997(HA)和MG983999(NA)。利用GenBank中的BLAST工具查找与其HA和NA基因片段开放阅读框核苷酸序列同源性最高的毒株,结果发现该分离株的HA基因片段与分离自中国的A/swine/Jiangsu/49/2012(H1N1) HA基因片段(登录号:KP404348.1)同源性最高,达到98%;NA基因片段与分离自中国的A/swine/Shanghai/3/2014(H1N1) NA基因片段(登录号:KM594558.1)同源性最高,达到97%。
将HA和NA基因的序列分别与来自GenBank的经典型猪H1N1、类人型猪H1N1、类禽型猪H1N1和2009 H1N1分支代表毒株进行比对,绘制系统发育树。结果表明,A/swine/Shanghai/1205/2017(H1N1)HA(图2A)和NA(图2B)基因片段均属于类禽型猪H1N1的进化分支。

图1 A/swine/Shanghai/1205/2017(H1N1)病毒的电镜观察
注:黑色实心三角代表分离株
2.5 红细胞凝集试验
在测试SIV分离株对7种红细胞凝集作用的试验中,连续三代病毒都对鸡红细胞、人O型红细胞和猪红细胞有凝集作用,牛、羊、兔和马红细胞均无凝集作用(表1)。
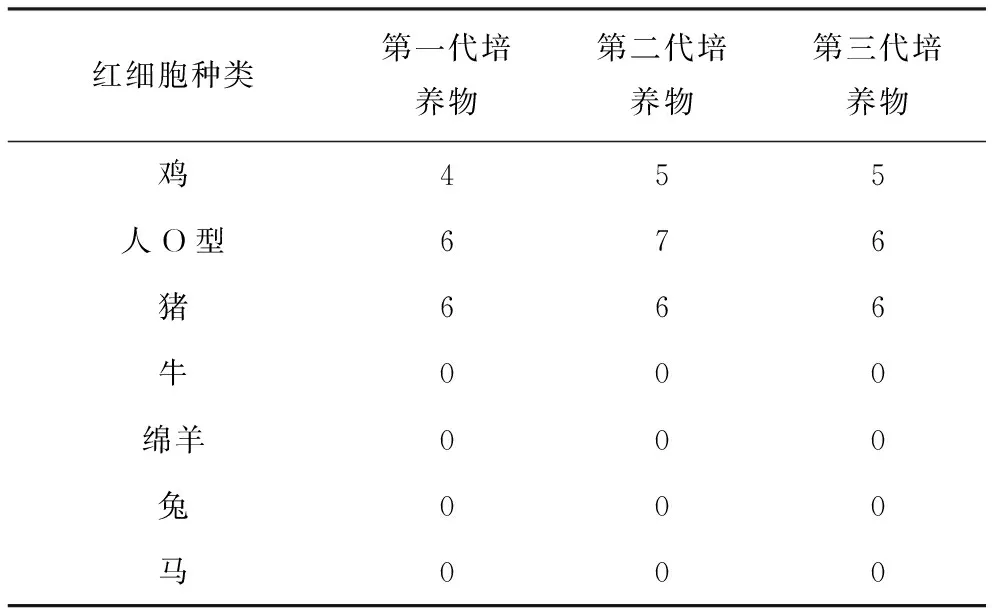
表1 SIV分离株对7种红细胞的凝集作用 log2
2.6 血凝素热稳定性试验
SIV分离株在56 ℃水浴5 min,其血凝价未下降;水浴30 min后,其血凝价下降1个滴度,其血凝素为热稳定型(表2)。
2.7 耐热性试验
对A/swine/Shanghai/1205/2017(H1N1)进行耐热性鉴定,病毒在50 ℃时都表现为耐热型(表3),在60 ℃时表现为不耐热型(表4)。
2.8 有机溶剂试验
病毒经乙醚、氯仿和酸有机溶剂处理,接种鸡胚96 h后,发现SIV分离株对乙醚、氯仿和酸均为敏感(见表5)。
2.9 EID50测定
将SIV分离株稀释后分别接种鸡胚,不能导致鸡胚的死亡。经测定,A/swine/Shanghai/1205/2017(H1N1)第三代尿囊液的EID50为1×10-4.75/0.2 mL。
表2 血凝素热稳定性试验

毒株不同时间血凝素热稳定性/min0515306090120150过夜热稳定性A/swine/Shanghai/1205/2017555420000热稳定型
表3 50 ℃耐热性试验

毒株10 min20 min30 min60 min耐热性A/swine/Shanghai/1205/20173/33/33/33/3耐热型
注:A/B,A表示处理后的分离株接种鸡胚后其尿囊液HA阳性数,B表示鸡胚的接种数。下同
表4 60 ℃耐热性试验
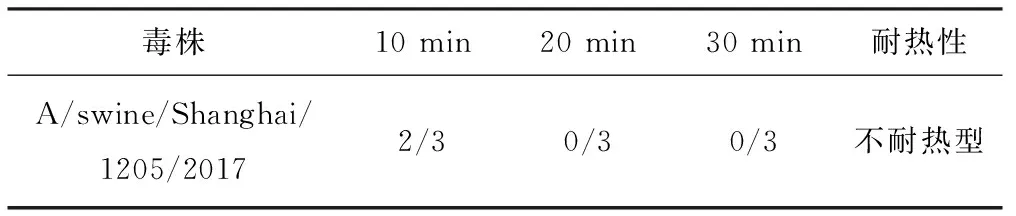
毒株10 min20 min30 min耐热性A/swine/Shanghai/1205/20172/30/30/3不耐热型
表5 经不同方法处理后病毒对鸡胚的感染率
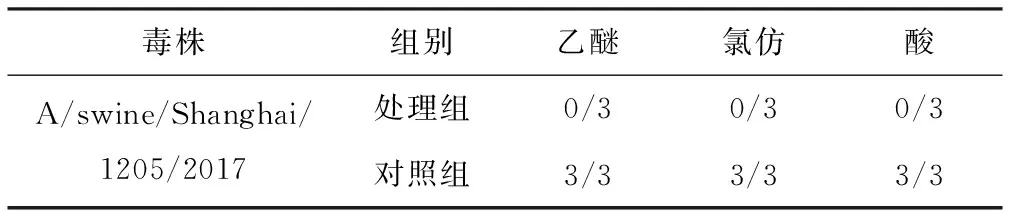
毒株组别乙醚氯仿酸A/swine/Shanghai/1205/2017处理组0/30/30/3对照组3/33/33/3
3 讨论
本研究对上海某疑似感染SIV的猪场猪鼻拭子样品进行了SIV的荧光RT-PCR检测,对阳性样品进行了病毒分离,并分离到6株SIV,选择其中1株将其命名为A/swine/Shanghai/1205/2017(H1N1)。采用血凝试验、电镜观察、血凝素和神经氨酸酶测序等方法对该分离株进行了鉴定和病毒特性研究。分离株在常温下对鸡红细胞、人O型红细胞和猪红细胞具有凝集活性,对牛、羊、兔和马红细胞无凝集活性,符合猪流感病毒特性[10]。A/swine/Shanghai/1205/2017(H1N1)属于血凝素热稳定型,耐50 ℃高温,但对60 ℃敏感;对乙醚、氯仿和酸敏感,一般消毒剂均能将其灭活,与已报道的猪流感病毒特性一致[11]。A/swine/Shanghai/1205/2017(H1N1)对SPF鸡胚无致死性,因此认为其对SPF鸡胚为低致病性[12]。研究结果表明,上海地区猪群中存在对环境具有较强耐受性,且对鸡胚低致病性的A型H1N1亚型猪流感病毒。
根据以往的SIV分离与鉴定的经验,本研究将待分离样本首先进行MDCK细胞培养,再进行SPF鸡胚传代,获得了SIV分离株。临床实践中,猪群SIV感染多为一过性,且10日龄SPF鸡胚购买后还需要继续孵化,样本保存时间较长不利于SIV的分离,使用MDCK进行初步的培养有利于提高SIV分离效率。同时SIV在细胞中增殖滴度没有在SPF鸡胚中高,且病毒的血凝活性容易丢失,因此病毒的增殖和保存都在SPF鸡胚中完成。本研究中SIV病毒分离方法的优化有效地提高了病毒的分离效率,也保证了病毒的滴度,为今后SIV的分离提供了帮助。
猪被认为是禽流感病毒(AIV)对人的适应过程的中间宿主或是作为遗传学上重配病毒的“混合器”[13]。因此,及时掌握我国猪群中SIV的感染情况,加强猪群中流感病毒的检测,制定合理科学的防治措施,具有重要的公共卫生学意义。本研究从上海地区的猪群中分离到类禽型A型H1N1亚型SIV,虽然进行了初步的病毒特性研究,但是病毒是否会在猪群中持续演化和重配进而传染给人,以及是否会对猪造成更严重的致病性有待于进一步的研究。
