Fhit基因在子宫内膜癌增殖、侵袭中的作用和临床意义
2020-07-09黄园莉唐明洋吴礼高
朱 清,李 楠,武 侠,黄园莉,唐明洋,吴礼高
子宫内膜癌是发生于子宫内膜的一种上皮性恶性肿瘤,是最常见的女性生殖系统肿瘤之一[1]。脆性组氨酸三联体(fragile histidinetriad,Fhit)基因是活跃的第一位脆性位点的抑癌基因,它对于肿瘤的发生及进展起着重要的负性调控作用,在多种肿瘤中都有不同程度的表达缺失且具有相关性[2]。RNA 激活(RNA activation,RNAa)系将靶向目的基因启动子区域的双链RNA分子(dsRNA)导入肿瘤细胞,RNAa是小双链RNA引导的Argonaute蛋白参与的转录基因激活机制,这种小双链RNA被称为小激活RNA(saRNA)[3]。本研究检测Fhit基因在子宫内膜癌中的表达及其与临床病理因素的相关性,拟运用 RNA 激活上调人子宫内膜癌细胞株(Ishikawa,ISK)中Fhit基因的表达,探讨其对子宫内膜癌细胞增殖和侵袭、迁移能力的影响。现作报道。
1 材料与方法
1.1 标本来源 实验组为子宫内膜癌组织,术后均经常规病理组织检查证实为Ⅰ型子宫内膜癌(即子宫内膜样腺癌)。选自2018年1月至2019年7月就诊的135例病人,年龄27~81岁。根据2000年FIGO标准,临床病理分期为Ⅰ~ Ⅱ期70例,Ⅲ~Ⅳ期65例。根据2003年WHO标准,病理分级为高分化44例,中分化58例,低分化33例。肌层浸润>50%者69例,≤50%者66例。有淋巴结转移者43例,无转移者92例。术前未接受抗癌性治疗,具有完整临床资料。对照组为正常子宫内膜组织,选自妇科活检内膜组织或因其他良性疾病而行子宫切除的40例病人。所有组织均来自蚌埠医学院第一附属医院病理科。
1.2 免疫组织化学染色 自动切片机将蜡块切成0.4 μm 厚度的切片,脱蜡后在121 ℃枸橼酸盐溶液中进行3 min的抗原修复,自然冷却后在3%的H2O2溶液中静置10 min,加抗Fhit兔抗人一抗60 ℃ 1 h,PBS冲洗3×5 min,二抗37 ℃ 30 min,PBS冲洗后DAB显色,镜下观察。Fhit蛋白主要定位于细胞质,以抗体在细胞质内出现黄色颗粒为阳性信号,对细胞染色强度及阳性细胞百分比综合评分[4]。按染色强度打分:0分为无色,1分为浅黄色,2分为棕黄色,3分为棕褐色,按阳性细胞所占百分比打分:无阳性细胞为0分,阳性细胞≤10%为1分,阳性细胞11%~50%为2分,阳性细胞51%~75%为3分,阳性细胞>75%为4分;染色强度与阳性细胞百分比的乘积≥2分为免疫反应阳性,<2分为表达下降或免疫反应阴性。用Image-Pro Plus软件进行图像分析,积分吸光度(integrated optical density,IOD)/面积值作为判断Fhit 蛋白表达情况。
1.3 细胞株及主要试剂 人子宫内膜癌细胞株ISK、构建Fhit-saRNA表达载体、逆转录试剂盒、PCR 试剂盒(上海吉玛);DMEM(高)培养液、PBS平衡液、胎牛血清(Hyclone);Fhit抗体(Abcam,ab181004);β-actin 抗体(Abcam,ab8229);脂质体转染试剂 LipofectamineTM2000、Trizol 试剂(Invitrogen) ;CCK-8试剂、Transwell小室(碧云天);结合基质胶(Matrigel,BD)。
1.4 细胞培养 将ISK细胞置于37 ℃、5%CO2培养箱中培养,细胞贴壁生长,每2~3天传代一次,传代时弃去旧培养液,用PBS洗涤2~3次,加入胰酶消化,加入培养液吹打细胞,重置细胞液接种于培养瓶。实验取处于对数生长期的细胞。
1.5 saRNA的序列设计及合成 saRNA序列为dsFhit:5′-CGA ATT CGC CCT TGC TTA TTA-3′;5′-AAT TGG CCA TTA GCC GCG GCG-3′;Control:5′-GGC CTT AAG GCC TAA TGC TGC-3′;5′-TTA ACC GGG ATT AGC CGG CAT-3′。
1.6 细胞转染及分组 转染前按2×105个细胞/孔接种6孔板,待细胞密度达 70%~80%时开始转染,转染步骤按 lipofentamineTM2000 试剂说明书进行,dsFhit 的终浓度为50 nmol/L,孵育48 h,将 dsFhit 转染入ISK细胞。实验分组:实验组(转染 dsFhit)、阴性对照组(转染无序RNA)、空白对照组(不转染)。
1.7 Western blotting蛋白免疫印迹法 转染48 h后收集各组细胞提取蛋白,用10% 聚丙烯胺凝胶分离蛋白。配制分离胶和积层胶,每孔加入等量蛋白样本电泳、封闭。将膜放入稀释的一抗(1∶3 000稀释)中,温和振荡2 h后置于4 ℃冰箱中过夜,置于TBST溶液中洗膜3×10 min,在二抗中温和振荡2 h,置于TBST溶液中洗膜3×10 min。将膜用显影溶液处理后曝光,显影,通过凝胶成像系统进行灰度值分析。
1.8 RT-PCR检测 细胞转染48 h后用Trizol试剂提取各组细胞总RNA,用紫外分光光度计准确定量。取5 μg 总RNA进行逆转录反应。Fhit 基因上游引物:5′-AGG ACT CCG AAG AGG TAG CAT-3′,下游引物:5′-TCA CTG AAA GTA GAC CCG CAG-3′;β-actin上游引物:5′-AAC AAG ATG AGA TTG CCA TGC-3′,下游引物:5′-AGT GGG GTG GCT TTT AGG ATA-3′;PCR扩增反应条件为:95 ℃变性3 min后,按下列参数循环35次:95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,最后72 ℃孵育10 min。取 5 μL PCR产物进行凝胶电泳30 min,在紫外灯下观察 DNA 条带,拍照,并用凝胶图像处理系统进行灰度值分析。
1.9 CCK-8法 取对数生长期的细胞,调整细胞密度为5×104个/毫升,接种于96孔板中,每孔种150 μL细胞液,置于细胞培养箱中孵育24 h后转染,于24、48、72、96、120 h向各孔内分别加入20 μL的CCK-8试剂继续培养4 h。酶标仪在450 nm处测定各孔的吸光度(OD)值。实验重复3次。
1.10 细胞侵袭和迁移实验 侵袭实验将结合基质胶每孔50 μL均匀地铺在 Transwell小室膜上,细胞转染48 h后,将各组细胞消化成细胞悬液,调整细胞密度为4×105个/毫升,取200 μL细胞悬液至Transwell小室中,将小室置于24孔板的培养基中,孵育24 h后取出Transwell小室,用棉签擦掉滤膜上层细胞,将滤膜用甲醇固定,加适量结晶紫溶液染色,于400倍目镜下计数每个膜随机不同视野透过膜的细胞数,取平均值,每组平行设3个小室,实验重复3次。迁移实验Transwell小室膜上不铺结合基质胶,细胞转染48 h后,其余步骤同侵袭实验。
1.11 统计学方法 采用t检验、χ2检验、方差分析和q检验。
2 结果
2.1 免疫组织化学染色 结果显示,正常子宫内膜组织中的细胞质内有阳性染色表达,子宫内膜癌组织中的细胞质内阳性染色表达减弱甚至缺失,2组差异有统计学意义(P<0.01)(见图1和表1)。

表1 Fhit在不同组织中的表达
2.2 Fhit的表达与子宫内膜癌临床病理因素的关系 子宫内膜癌中Fhit表达阳性率FIGO分期Ⅲ+Ⅳ高于FIGO分期Ⅰ+Ⅱ、肌层浸润>1/2高于肌层浸润≤1/2、有淋巴结转移高于无淋巴结转移,差异均有统计学意义(P<0.05~P<0.01),阳性率与年龄无明显相关性(P>0.05)(见表2)。
2.3 Western blotting检测 与子宫内膜癌相比,正常子宫内膜中Fhit蛋白表达显著增高(见图2)。2组间差异有统计学意义(P<0.01)(见表3)。细胞转染48 h后与阴性对照组和空白对照组相比,实验组Fhit蛋白表达显著增高(见图3),各组间差异有统计学意义(P<0.01)(见表4) 。
2.4 RT-PCR 检测 细胞转染48 h后实验组mRNA表达水平为0.86±0.15,显著高于阴性对照组的0.34±0.01和空白对照组的0.33±0.01(P<0.01)。
2.5 dsFhit对子宫内膜癌细胞活性的影响 CCK-8检测结果显示,细胞转染 24、48、72、96、120 h 抑制率分别为5.3%、15.6%、37.2%、43.3%和54.8%,与阴性对照组相比,实验组细胞增殖减慢,生长明显受抑制,差异有统计学意义(P<0.05)(见图4)。
2.6 dsFhit对子宫内膜癌细胞的侵袭和迁移的影响 Transwell小室实验显示,与空白对照组和阴性对照组相比,实验组细胞的侵袭和迁移能力有明显下降(P<0.01)(见表5、图5)。
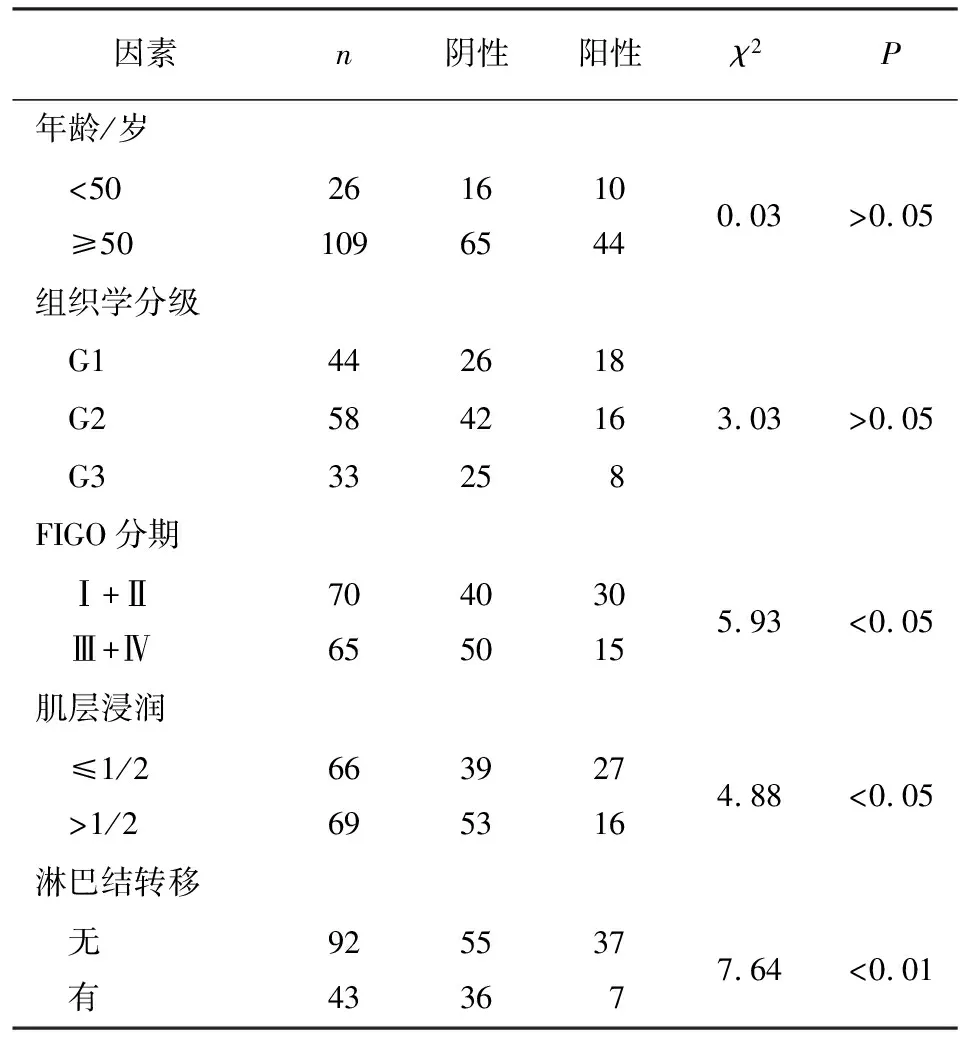
表2 Fhit表达与子宫内膜癌临床病理特征的联系
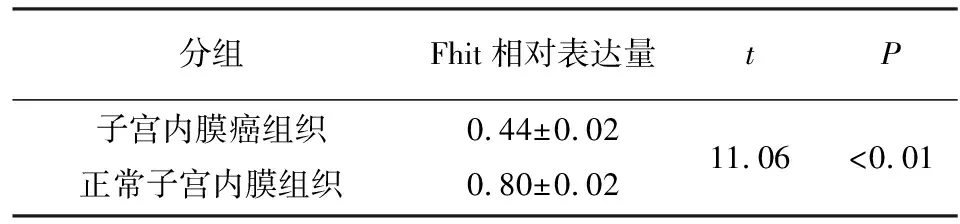
分组Fhit相对表达量tP子宫内膜癌组织正常子宫内膜组织0.44±0.020.80±0.0211.06<0.01
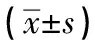
表4 RNAa转染后ISK细胞中Fhit的表达比较
3 讨论
子宫内膜癌在全世界发病率高及治愈率低,科学家们也一直致力于此肿瘤的发病机制研究,希望从分子水平为其诊断、治疗及预后提供帮助。肿瘤的发生、发展与癌基因异常激活、抑癌基因失活及DNA错配修复基因异常密切相关[5]。而RNAa为近年来基因功能和治疗研究领域最热门的技术之一,RNAa通过选择性的激活或增强某个抑癌基因的表达来抑制肿瘤生长,而不需要找到肿瘤特定的致癌基因,RNAa效应不涉及对任何靶序列的降解,而是通过募集转录激活因子导致基因转录过程的活化并引起染色质修饰的激活。因此,RNAa具有几乎无限的靶基因,可以提高靶基因mRNA的总丰度,同时保留mRNA天然拼接异构体的多样性,在转录及表观遗传水平发挥作用,因此能够持久激活靶基因,但不改变基因组。这一发现将开拓性地扩展治疗肿瘤、代谢及遗传性等疾病[6]。
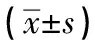
表5 Fhit对ISK细胞侵袭和迁移能力的影响
Fhit基因是1996年OHTA等[7]用差异显示分析探针及外显子捕获法在3p14.2 区分离鉴定出的一个抑癌基因,全长1 095 bp,由10个外显子组成,外显子5~ 9构成开放阅读框,编码1个由147个氨基酸组成的、相对分子质量16 800,起始外显子位于t(3;8)异断裂处的着丝粒侧,t(3;8)的移位可干扰Fhit基因表达。Fhit 基因存在于上皮性组织中,主要通过参与细胞周期调控和凋亡发挥作用,它可使细胞受阻于增殖周期的S期,并激活Caspase酶介导的凋亡级联反应[8]。综合目前的研究,该基因在正常组织如子宫内膜、卵巢、肺等有不同水平的Fhit mRNA表达,在人类部分上皮性肿瘤中表达降低或缺失,且与肿瘤预后差密切相关[9]。
在本研究中,我们通过对135例子宫内膜癌组织和40例正常子宫内膜组织应用免疫组织化学及Western blotting检测,结果显示Fhit蛋白在子宫内膜癌中阳性表达率为21.5%,与正常子宫内膜组82.5%相比,阳性表达率明显降低,Fhit蛋白在2种不同子宫内膜组织中表达差异有统计学意义(P<0.01),说明随着子宫内膜组织向癌组织进展,Fhit蛋白的阳性表达率明显降低,Fhit蛋白与子宫内膜癌的发生及发展有明显相关性;子宫内膜癌中Fhit基因表达与肿瘤组织学分级、临床分期、肌层浸润和淋巴结转移明显相关(P<0.05~P<0.01)。CCK-8试剂盒用于检测人子宫内膜癌细胞中Fhit基因RNA激活后细胞的增殖情况,结果显示实验组细胞生长与阴性组相比较明显减慢,说明Fhit基因被激活后子宫内膜癌细胞倍增时间明显延长。Transwell小室模型实验是研究肿瘤细胞侵袭迁移的一种较好方法,它能模拟肿瘤细胞消化基质并穿越屏障侵袭迁移的过程。实验结果表明Fhit表达激活后,能够穿越屏障的子宫内膜癌细胞与阴性对照组相比较明显减少,这表明子宫内膜癌细胞侵袭和迁移能力受到抑制,进一步证实了Fhit基因与人子宫内膜癌细胞的增殖和侵袭转移存在密切关系。
本文研究发现Fhit基因的表达缺失与子宫内膜癌的发生和发展密切相关,检测其表达水平对子宫内膜癌的早期诊断、临床进展及估计预后有一定的参考价值[10]。通过多因素分析,探讨Fhit基因在人子宫内膜癌中的抑制作用和子宫内膜癌转移的危险因素,为病情监测和高危人群的筛查提供更为确切的手段,它的检测将有助于提高诊断的准确性和客观性,对于子宫内膜癌的预后评估、病情随访及合理治疗具有一定的指导意义[11]。
