群落中捕食者互食的生态与进化:互食的潜在竞争者
2020-07-08黄大明黄宇森张天曦具艾京G.A.Polis
黄大明 黄宇森 张天曦 具艾京 G. A. Polis


摘 要:群落中捕食者互食(Intraguild predation,简称IGP)是指具有生态位重叠的捕食者捕食对方的行为,是一种种间竞争和捕食的综合作用。这种捕食行为在复杂群落中十分常见,并会显著影响群落结构和群落物种丰盛度。群落中捕食者互食可能与多种因素有关,可以是对称或者不对称,也可以能随着个体年龄变化发生逆转。群落中捕食者互食通过干扰和捕食,增加了种间相互作用的复杂性,并且對基础的食物网造成影响。本文将通过分布、数学模型、进化等维度,系统研究群落中捕食者互食及其影响。
关键词:群落中捕食者互食;捕食者;生态位;种群;群落
中图分类号:Q145 文献标识码:A 文章编号:1671-2064(2020)06-0200-07
1 介绍
物种之间的相互作用通常分为竞争(--),捕食/寄生(+-),互惠共生(++),共栖(+0)或偏害共生(-0)。群落中捕食者互食(IGP)是前两种关系的组合,即捕食性物种会捕食利用共同有限资源的潜在竞争者。与单纯的捕食作用不同,它同时降低了资源竞争,丰富了食物资源,比单纯的捕食或竞争关系更复杂。
IGP发生在同一个guild的成员之间。guild定义为:以相似方式利用同类资源的同行物种或同类物种[16,81,119]。本文研究群落中捕食者互食的普遍性和重要性,并分析和研究建立理论框架。IGP是一种广泛存在的相互作用,影响物种的分布,丰盛度和进化。
2种类与分布
根据对称性(对称与非对称)和年龄结构(相对重要与不重要),将IGP进行分类。例如,当一个物种A总是物种B的捕食者时,将其定义为不对称的IGP。而对称的IGP则会表现为A和B之间相互捕食。当IGP受到个体大小、强弱与季节影响时,假定年龄结构在这种IGP关系中相对重要。在所有研究中,互食的捕食者间存在较大资源生态位重叠,要考虑资源竞争关系。
2.1 年龄结构相对不重要,不对称IGP
2.1.1 群落中杂食性捕食者捕食
几乎所有捕食和食物网研究都表明,IGP是普遍存在于小型个体的捕食者群体中。大多数捕食者捕食一定大小范围的猎物,与论猎物的营养水平或食性无关[51,88,105,132]。因此,较大的捕食者在捕食其它营养级的捕食者时经常是杂食性(见图1a)。这种关系可能发生在淡水[51,86,91,92,132],海洋[20,27,83,85,101]和陆地[12,88,105,145]食物网。在大多数情况下,大A捕食较小的B(图1a)。又分为相关的和不相关的群落中捕食者互食。一般捕食者会正常捕食不相关群落的中、小型捕食者。例如昆虫,节肢动物,浮游生物和鱼类。食线虫螨捕食食真菌、食屑、食草和食肉线虫[145]。蝎子(Paruroctonus mesaenis)捕食50多种蜘蛛和昆虫捕食者[105,107](见图2)。15种沙漠脊椎动物的41%会捕食节肢动物。6种寄生蜂的52%会捕食节肢动物。捕食者还会捕食食草动物和食腐动物[105]。食虫的鸟和蜥蜴经常捕食昆虫捕食者和蜘蛛,例如:Anolis蜥蜴捕食蜘蛛[131]。鸟类捕食蜥蜴及其猎物[1,105,144,157]。食肉动物捕食各种脊椎动物:例如:沙漠土狼捕食食草动物(兔子、啮齿动物、地鼠、鸽子、鹌鹑),节肢动物捕食者也会捕食脊椎动物(蛇、蜥蜴、鸟类和哺乳动物),食肉动物会捕食脊椎动物(走鹃、爬行动物和哺乳动物),以及蝎子,昆虫和果实[105]。食肉哺乳动物食物生态位经常发生重叠[30],很容易捕食其它食肉动物[125],例如成年虎捕食熊(黑熊、棕熊、懒熊、狗、狼和獾)[125];豹子捕食狮子,猎豹,野狗和斑点鬣狗,还有猛禽,鳄鱼和蟒蛇[30,125,139]。
Hall等人[51,p.916]总结说,“水生捕食者主要依据大小选择猎物,因此不分辨它们的食物是猎物还是同营养级的个体。”淡水中的例子包括以昆虫为食的鱼类或两栖动物[19,91,92]和食虫昆虫[39,75,83,86,97,128]。以浮游生物为食的杂食性鱼类会捕食各个营养级浮游植物和浮游动物[22,28,51,70,132]。杂食性IGP在海洋生态系统中也很常见。在浮游食物网中,每个营养级都从更低营养级捕食[101,27,47,111,112],例如,三级食肉动物捕食次级和初级食肉动物、杂食者、食草动物、食腐动物。底栖捕食者以适当大小的物种为食,例如63%的底栖捕食者捕食其它捕食者[20]。在浅海,鱼类,螃蟹和鸟类的捕食会影响底栖捕食者的丰盛度[4]。海星捕食食肉螺类和贝类。类似的IGP发生在鱼类,螃蟹,海星和捕食性螺类[84,85]。IGP捕食相关群落猎物常见于海底底栖动物[27,83,84 114]、食浮游生物者[33,47,56,96,112,158],蛛形纲动物[12,41,105,107,115,124],昆虫捕食者[39,86,97,128],蜥蜴[1],蝙蝠,猛禽[15,61]和食肉哺乳动物[30,67,105,121,125,126]。杂食性IGP在蜘蛛,蝎子和蚂蚁中常见繁,每个个体都是自身群体的猎物[107,115,124,153]。在所研究的27种蜘蛛中,异种蜘蛛占食物的1-49%;4种蝎子的8-22%的食物是其它蝎子[107]。毛颚类中的IGP占食物的8%[96]至13%[33]。以上一些例子还与年龄结构相关(图2和图3)。
箭头表示营养关系。 A和B是成体; a和b是幼体。对称IGP未显示,但如果B捕食a,可以在1b,1c或1d中标出。
图中:双尖箭头表示互食。 每个一般类别中都包含多种的IGP关系,例如:昆虫和蝎子之间的相互作用在虚线框中更详细地显示。 所有节肢动物都是其它节肢动物或脊椎动物的猎物。 在蝎子中显示IGP的年龄结构关系(具有明显的食性变化)。 中等水平个体IGP捕食吃一般猎物(例如昆虫,蜘蛛)。没有显示五个蝎子年龄组中的同类相食。
2.1.2 偶然的群落内捕食者互食
许多微生物和小型后生动物以如腐肉,水果,种子,土壤或宿主为食。当较大型捕食者捕食这些相同食物时,会发生IGP。普遍存在的最不受重视的种间竞争是:微生物和大型生物之间的三种资源竞争。如:腐尸、果实和种子[62,p691]。食腐动物会同时捕食食物中的微生物和较小的后生动物及其幼虫[32,52,53,78,100,105,116,129147,154]。食草动物会顺捕生活在植物上或植物内较小的后生动物,幼虫和/或微生物[129]。同样,捕食者在捕食宿主的同时会顺捕病原体,寄生物和寄生蜂等。最后,当一种病原体感染已被感染的宿主时,一些宿主的寄生物也会具有IGP类似关系,有些病原体会被入侵者排除[55]。蚂蚁[13,81,120,143,153],白蚁[75]和食肉动物[30,67,82,126]有资源竞争的IGP关系,通常发生在同类群。一群海螺捕食龙虾[8,9]。一些大型珊瑚在邻近的珊瑚中占主导地位,使用体外刺丝囊的细丝来捕食邻体组织[71,138]。这种行为可以完全排除小珊瑚。
浮游生物间营养关系在虚线框中详示。蓝鳃和鲈鱼间食性变化与年龄结构相关。发生在蟾蜍目、石蒜类)和浮游生物(如,环状桡足类)间。中等水平捕食者IGP捕食一般猎物(昆虫,浮游生物)。
2.2 年龄结构比较重要,不对称
2.2.1 食性不发生显著变化
成熟的和未成熟的A和B捕食相同猎物,A捕食b(图1b)。包括许多食肉动物[23,24,65,74,95,110],食腐动物[142],寄生蜂[6,123],兼性寄生物[31,37,129],体外寄生物[29,114]和食草蜗牛[113]。一些寄生蜂幼虫在同一昆虫宿主中捕食较小幼虫。兼性超寄生物多样且丰富,捕食宿主和宿主的其它寄生物。许多吸血节肢动物是小型寄生物(例如螨虫,恙螨和一些半翅目捕食较小/幼螨,虱子,跳蚤,蜱,苍蝇及其卵)是兼性IGP捕食者(或寄生物)[29,114]。
食量随着生长发育变化,许多捕食者会捕获更大的猎物:即幼鱼捕食相對较小的猎物;成熟个体捕食相同类型的大型猎物[104]。产生A对B的年龄(大小)相关的IGP,尤其是当b与A捕食同样大小的猎物时(图1c)。类似杂食性IGP。多数捕食者中很常见。如蜘蛛[105,107,115,124,141],避日虫[105,107],蝎子[12,105,107],陆食性昆虫[58,105],蜥蜴[1,105,133],海洋捕食
者[33,47,96,111,112,114a],桡足类[5,36,132,158],轮虫[48,134],嗜水淡水昆虫[10,25,35,39,43,44,64,75,86,97,118],两栖动物[50,89,90,135,136,146,156]和鱼类[2,42,63, 72,109,l37,150]。沙漠节肢动物见图2。例如,五种桡足类吃轮虫(除桡足类的无节幼体和桡足类阶段)[5]。大型若虫吃较小的若虫和其它蝗虫[10,25,35,64,86,118],是较频繁IGP捕食者。大鱼吃小鱼的IGP很普遍[149,72,137,42,2]。
2.2.2 食性发生显著变化
一些类群在变态时有显著食性变化(如昆虫,许多海洋无脊椎动物和底栖动物)。有些随着个体发育发生转变(如鱼类,一些爬行动物)[104,150,152]。这些变化拓展了物种的营养生态位并建立有利于IGP的营养结构。如果物种经历多次食性调整,IGP会非常复杂(图3)[150]。如,欧亚鲈鱼和拟鲤都吃浮游动物;成年鲈鱼吃拟鲤[99]。在许多鱼类间会发生类似相互作用。例如黄色鲈鱼和大眼鲷[38],鲈鱼和鲈鱼[18],以及蓝鳃和大嘴鲈[150,149]。这些复杂的相互作用通常包括竞争和IGP。在发育期间,一些石蝇从食草动物转向杂食动物[43]。唇形目和针叶桡足类开始生活吃浮游植物,后来转为浮游动物,包括食草动物和其它桡足类幼虫[22,68,69,79]。许多海洋无脊椎动物的幼体被成体捕食[154,155,100]。珊瑚虫幼体被其它珊瑚虫吃掉[45]。藤壶过滤捕食棘皮动物幼虫,软体动物幼虫,海鞘幼虫其它藤壶幼虫[159]。实验证明:IGP是幼虫定殖软底群落死亡的主要因素之一[32,54,147,100,154,155]。
2.3 对称IGP:相互捕食和循环
2.3.1 年龄结构相对重要的物种
当A和B彼此捕食,对称IGP发生[l05]。捕食的个体发生逆转是最常见的形式:幼年A被相对较大的B吃掉;更大的成熟个体A吃B(或幼年B)。大小和发育阶段是关键决定因素:来自任何物种的较大个体可以捕食其它物种的较小个体;在小型和/或无防备的情况下(如幼虫,卵和蛹),个体最容易受到伤害。在这些情况下,个体A作为B的潜在猎物开始生命并且以B的捕食者结束。如果同时有A和B的大型成体和幼体,则互食是常见的。年龄相关的IGP在陆生和水生种类中很普遍。在食肉动物[24,95,65],蜘蛛[lOS,140,141],蝎子[107],节肢动物捕食者[12,105,106],寄生蜂[6,123]和超寄生蜂[31,37,105]。在四类蜘蛛[140,141]以及12种鸟类组合中的7种之间观察互食。在四类蝎子中的12种[107]中有9种。沙漠蝎子,蜘蛛各自捕食类群中的幼体和较小的物种;在10对物种中观察到年龄相关的对称IGP[106,107]。分析8种沙漠节肢动物之间的营养关系:6种有IGP[12]。相互IGP偶尔会发生在陆生脊椎食肉动物中。例如,地鼠和响尾蛇捕食挖洞猫头鹰的蛋和雏鸟;成年猫头鹰捕食这些蛇[105]。豹是狮子,斑点鬣狗,成熟虎,大型猛禽,鳄鱼和蟒蛇[30,125,126,139]的对称捕食者。幼虫的相互IGP是底栖海洋群落的正常关系[27,32,100,114,147,154,155]。成年鱼类吃幼体和幼虾草虾,成年虾吃鱼[66]。它常常出现在浮游生物群落中[22,47,79,68,96]。夜光藻,桡足类和超过90种的水母和栉水母捕食鱼卵或幼鱼;成鱼捕食许多这类物种[26,47,87,101,112]。桡足类是幼鱼的重要捕食者,但如果鱼类存活下来,鱼类就会成为桡足类动物的重要捕食者。事实上,想象一下小型浮游生物如桡足类,毛颚类等等,即使是非常大的食肉动物,如金枪鱼,它们也是重要的幼鱼捕食者。这在陆地上就相当于成千上万的小虎或狼被蜘蛛、蜥蜴、鸟、树鼠等物种捕食[27,p192]。
2.3.2对称组
群落内捕食在昆虫和食肉动物中也经常发生。蚂蚁参与两种类型的互食[76,81,120,122,143,153]。蚁后经常被来自其它共存物种的工蚁咬死,例如行军蚁捕食100多种蚂蚁;这些物种也会吃行军蚁的蚁后[76]。战争也发生在整个族群之间。在体型相似的蚂蚁中,通常较大族群会赢得战争。群体规模在食肉动物中也很重要,例如个体狮子捕食个体鬣狗;单狮子被鬣狗群捕食;一群狮子捕食鬣狗群体[30,67,126]。豹子和一群野狗可以捕食独行的狮子;两只或两只以上的狮子能捕食猎豹和野狗[30,126,139]。类似的IGP关系有:猎豹和斑点鬣狗[30,126,139];豺和猎豹[14,30];狼和熊[82];海螺和龙虾[8,9]。
2.3.3 其它
对称IGP可以与年龄结构无关。黑寡妇蜘蛛通过网丝捕食三种沙漠蝎子,这三种沙漠蝎子也能捕食在地面行走的黑寡妇蜘蛛[105,106]。珊瑚之间IGP有时是对称的[71,138]。最后,如果对称捕食者不共享资源,则可以在没有IGP的情况下发生互食循环。因此,一些蚜虫吃它们的瓢虫捕食者的卵[7]。藤壶过滤捕食浮游动物,包括棘皮动物幼虫[159];成年棘皮动物是藤壶上的捕食者[83]。在广义对称IGP中,脊椎动物吃掉它们的体外寄生动物[29]。
3 IGP的特点
相对的体型大小和营养结构重叠程度是影响IGP频率和方向的两个最重要因素。许多IGP捕食者对较小的同类会发生同类相食[39,75,103,114a]。IGP有時会随着猎物丰盛度减少而增加,例如在蝎子[107],豺蜘蛛[140],蚂蚁[81],蝇幼虫[142],食肉动物[23],涡虫属[11],桡足类[79,56,158]和食肉动物[30,67,126]。有时会随着IGP猎物密度的增加而增加。密度制约性IGP似乎在食肉动物[23,65,74],桡足类[22,69],两栖动物[135]和鱼类[99]中较多。最后,IGP有时优先选择最相近的潜在竞争者(即资源重叠最多的竞争者)。这可能是由于资源竞争提高了相遇机会。广泛存在于陆地节肢动物[13,81,107,115,120,140,143,153],食谷动物[65,95],陆地食肉动物[30,67,126]和淡水[69,79,158]和海洋[96,114a,155,159]无脊椎动物中。
4 IGP对个体的影响
下面讨论同群落IGP对个体适应性,行为,形态和生活史特征的影响。
4.1 行为,形态和生化影响
IG(intraguild)猎物经常表现出对IG捕食者的逃避行为[36,83,107,129,133]。此外,母本会减少对蛋和幼体的IGP。例如许多寄生蜂和超寄生蜂有效地避免在含有潜在IG捕食者的宿主上产卵[6,37,31,123]。一些蟹爪蜘蛛在特定的灌木中觅食排卵,因为这些灌木中含有相对较少的IG捕食者[140]。抚育幼体的海洋无脊椎动物比不抚育种类更少捕食同类幼体[32,154]。海胆幼虫对成虫产生的一种生化物质,减少其它大量甲壳类动物对海胆的IGP[54]。还有一些其它情况[13,34,66,114a]。
一些食肉动物的形态明显增加IGP。一些拟寄生物的早期具有特殊的镰刀形下颌,不适合以软宿主组织为食,但非常适合IGP和同类相食[6,123]。而后,下颌骨变小,没有硬化,然后更适合吸收宿主组织。同样地,高度进化的同类相食蝌蚪无法成为食植动物,但十分擅长捕食其它种类的蝌蚪[108]。另一些IG猎物的形态降低了IGP[34.134]。毒素代表一种防御。蝾螈成年后会产生毒素,从而避免被捕食[89]。腐肉、果实和种子中的微生物毒素抑制大型动物的IGP[62,117]。
4.2 生活史特征
幼体大小,生长速度,寿命,生殖物候等生活史特征通常会影响IGP作用的强度和方向。例如在螳螂[58],蜘蛛[140,141],蝎子[107]和淡水浮游动物[5,132]之间。例如,两个相互作用的食肉动物之间的不同步的生活史。IGP在寄生动物复杂生活史进化中非常重要。选择将有利于寄生动物抵抗宿主肠道内的消化,使寄生虫可以完全适应宿主肠道生活。
4.3 对个体健康的影响
群落内捕食者有利于捕食者生长,繁殖和生存。对于食植IG捕食者尤其重要。动物的蛋白质含量超过50%(按重量计为7-14%N),植物组织大多数是碳水化合物,只有0.03-7%的氮。在草原土壤中,23%的食真菌和藻类的微型动物也会捕食线虫。线虫猎物对一些节肢动物的存活至关重要,并可能大大增加产卵量[145]。IGP可以为食蜜和食虫鸟类补充氮[52]。颊囊鼠属袋鼠的夏季食物中,有时蚂蚁和昆虫等IGP能占到40%,显著减少对植物的采食[116]。IGP也可以作为水资源(例如鹌鹑吃蚂蚁[46])。IG猎物占一些桡足类摄入能量的25%[68,69],占大型毛颚类摄入能的18-51%[33,96]和占一些蝎子摄入能的4.9-10%[107]。在猎物短缺时,蚂蚁物种之间的战争会使超过10,000只蚂蚁去对方巢中捕食[81]。许多捕食浮游动物的鱼类也捕食其它鱼类。有些物种(例如长矛梭鲈)在没有鱼类食物的情况下无法维持正常生长,即使浮游动物丰富[109]。
5 种群水平的影响
IGP可能会影响IG捕食者,IG猎物和群落中的其它种群大小,稳定性和弹性。
5.1种群数量减少
在某些情况下,IGP可以严重减少甚至移除群落中部分种群。例如,在陆地类群中,IGP可以减少食腐昆虫[142],食肉动物[24,65]和蚂蚁[120,143]的种类。寄生蜂通常会移除共享宿主中的其它寄生蜂[6,31,37,123]。限制种群数量低于其环境容量。也是主要的死亡因素,例如在蝎子[107],蜘蛛[115,124]和昆虫[13,75,76,153]。野外试验中,当大型IG捕食性蝎子被移除时,两种较小蝎子的种群增加了150%和600%(相对于对照),并且蜘蛛丰度增加了一倍[106,107]。在没有蜥蜴的加勒比海岛屿上,蜘蛛的数量增加10倍[131]。在岛屿上,蜥蜴的移除导致蜘蛛丰度增加3-20倍,主要是由于捕食性而非竞争性释放。狮子能增加斑点鬣狗50%以上的死亡[67]。红狐是北极狐最重要的捕食者[17]。幼猎豹死亡率可能达到95%,一半以上是由狮子和鬣狗等其它捕食者IGP产生[14,30]。IGP是限制猎豹种群数量的主要因素。例如,在非洲野生动物保护区和公园(例如在内罗毕公园和南非)维持大量其它食肉动物(如狮子,鬣狗,豹子,野狗)会大大抑制猎豹种群数量(这些食肉动物也会和猎豹竞争食物)。在纳米比亚,通过狩猎大大减少其它食肉动物的数量,猎豹现在非常丰富,以至于它们经常被牧场主称为“害虫”,因为它们捕食家畜。在海洋环境中也观察到一些IPG种群的减少和局部灭绝[2,3,22,27,32,47,54,56,66,68,79,112,113,147,154,159]。成虫对幼虫的IGP是在软沉积物底栖生物群落中保持密度低于承载能力的主要因素[l00]。通过IGP是限制底栖捕食者种群数量的一个因素[3,4]。
5.2 群内竞争与捕食之间的相互作用
竞争和捕食对种群动态的联合影响。曾向加拿大湖泊中引入一种红色小鱼,虹鳟鱼是土著种群。成年鳟鱼吃的很好,从中受益。然而,由于与红色小鱼的竞争,幼鳟鱼变得不那么顺利(胃中的食物较少,生长缓慢)。总体效果减少了鳟鱼数量[72,150]。类似地,引入鲥鱼作为黑鲈的食物,引入增加了食鱼鲈鱼(由于IGP)的存活率,但减少了较小鲈鱼的生长和存活[150]。鲈鱼还表现出与蓝鳃的捕食性和竞争相互作用[149,150]。其中,IG猎物是更有效的竞争者时,发育限制很常见。成年鲈鱼的捕食可能反过来减少蓝鳃种群。类似方式,通过拟鲤的竞争[99]限制鲈鱼的数量。糠虾已被引入北美和斯堪的纳维亚的许多湖泊,通过为中型鲑鱼提供新的饲料来增加鱼类产量[73]。然而,糠虾对浮游动物的捕食常常会改变湖泊的营养结构,从而损害目标鱼类。复杂的影响包括糠虾和幼鱼之间的竞争:糠虾消耗了共同的猎物。一些研究表明:在以下情况,捕食因素对种群动态更重要:蜥蜴和蜘蛛[131],蝎子和蜘蛛[106],猛禽蜘蛛[140],网蛛[115],蝎子[107]和蝾螈[50]。在以下情况,捕食和竞争因素同等重要:食虫鸟[1,144]和蜥蜴[157];粉虱[142]和寄生蜂[31,37];绿蝇属和金蝇属,其幼虫为食腐动物[142]。
5.3 种内和内部竞争的影响
IG捕食者可能增加其IG猎物的丰度,因为该猎物对种内竞争的减少有一定的补偿反应。相反,IG捕食者的存在可能增加IG捕食者间对隐蔽场所的竞争。导致幼体数量的减少,限制了成体数量[133]。如,沿岸植被能增加小型蓝鳃鱼的隐蔽场所,增加种内竞争[149]。捕食者-猎物系统通常表现出阻尼或持续振荡动态,因此IGP系统应该表现出明显的种群数量波动。IGP通过补充食物,减缓捕食者下降速度,稳定种群数量。
6 种群数量模型
经典种群模型一般研究资源竞争的物种共存问题,资源利用相似性限制,密度制约的种内种间竞争。捕食者-猎物相互作用周期振荡的极限环理论[93]。归纳为:(1)如果IGP可以差别影响不同捕食者,可以增强共存。否则,尤其是当捕食者有复杂食性和强大竞争力时,IGP可能降低共存[57]。(2)IGP可以允许竞争捕食者共存,但通常以中间营养级的杂食捕食者形式存在[102,121]。
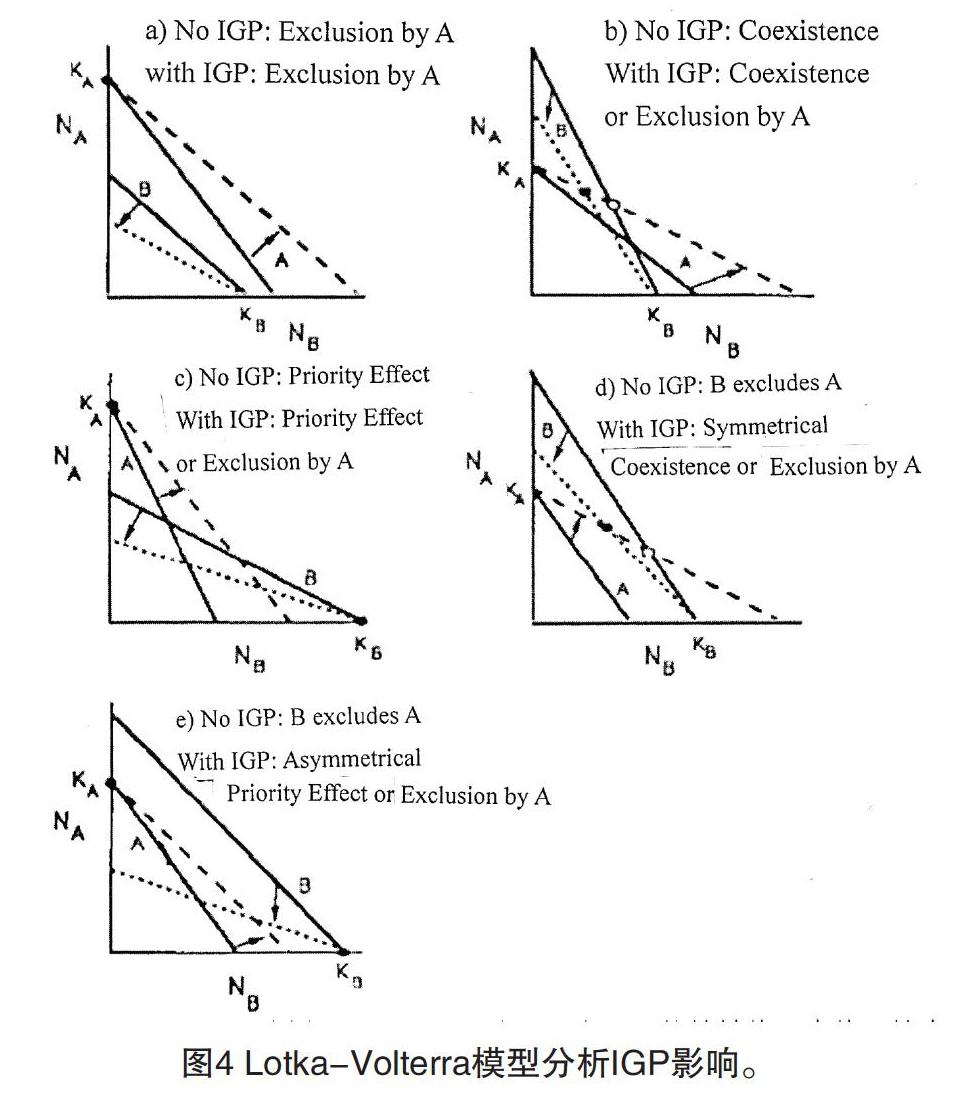
图4 Lotka-Volterra模型分析IGP影响。
实线:没有IGP的等轴线。虚线:捕食者的等倾线,包括IGP的有益效果。虚线:猎物的等倾线,包括IG捕食者施加的额外死亡率。该模型是dNA / dt= NAr(1-NA / K-αNB / K]+ aNANB;dNB / dt= NBr(I-NB / K-αNA / K)= aNANB。其中r和k是物种的内禀增长率和环境容量;a和a是竞争系数,a是IGP提供给A的益处,a是由IGP引起的B所带来的额外死亡率。IGP不改环境容量。(1)没有IGP,A单方面捕食B;IGP增强了它的竞争优势(2)没有IGP,竞争对手共存。IGP增加A并减少B;如果IGP足够大,这可能会导致被捕食和竞争排除。(3)没有IGP,会产生优先效果。使用IGP,可能仍然存在优先效应,或者产生A的单边支配。(4)没有IGP,B排除A。由IGP效应的大小大致相等,IGP可能排除共存。(5)没有IGP,B排除A。对于强大的,不对称的IGP,有优先效果。
图4是利用Lotka-Volterra模型分析IGP的结果。如果A是没有IGP的竞争优势,那么增加IGP只会增加其优势(图4a)。如果这两个物种在没有IGP的情况下共存,则增加IGP会增加A的密度,并且会降低B的密度。可能会降低到排除点(通过竞争和IGP的组合)(图4b)。如果没有IGP时存在优先效应,IGP仍然存在优先效果(A单方面获胜,图4c)。最丰富的效应出现在B本质上是竞争优势方。如果IGP对A具有强烈的正面影响,以及对B的负面影响,它可以允许A、B两物种共存(B中的密度降低)(图4d)。相反,如果IGP对A的有益效果很小,但对B的负面影响很大,IGP可能产生优先效应,其中任一物种都可能排除另一物种(图4e)。因为B占有主导竞争地位,且A捕食B获益不大,所以A很难增加。IGP对A帮助不大。
假设资源的固定输入I在竞争者之间划分。A获得可用资源的分数eNA /(eNA + eNB),剩余部分属于物种B。模型为dNA / dt= NA ebI/(eNA + eNB)-mNA + aNA NBdNB / dt = NB ebl /(eNA + eNA)-m NB -aNA NB其中aj测量物种的资源获取率i,bi将获得的资源转换为消费者的出生率,mi是一个非率密度制约死亡率,a和a表示A和B之间的IGP相关性。模型的等值线是双曲线。B的等倾线总是具有负斜率。 A的等倾线在B的低密度下可能具有负斜率,但在高密度下显示正斜率。在所有示例中,e = I,e= 2,b =1,b= 2,m = 1,m=0.5,a =0.5。在没有IGP的情况下,A和B的平衡密度分别为1和4,A被竞争排除。(1)I = 1,a=0.6。對于A和B,IGP效应的大小是可比较的。A的等斜线由两个分离部分组成:一个在原点附近,具有负斜率,并且一个远离原点,具有正斜率。这两条线之间的密度组合,A具有负增长率。在B的等倾线之外,B具有负增长率;在其中,B具有正增长率。两个等倾线的交点给出一个独特的平衡点。在该平衡附近,相互作用基本上是捕食者-猎物相互作用,显示扰动后的阻尼振荡。然而在全范围内,B抑制了A的丰度。对于(2)到(5),a = 6(IGP效应的强烈不对称性)。这些数字按照增加的资源投入I(衡量环境生产力)的顺序排列:(2)0.25;(3)1;(4)1.5;(5)2.0。(2)显示B的单边支配地位。(3)和(4)显示其他稳定状态:系统坚持单独出现B竞争排除的现象,或者A和B持续存在于捕食者-猎物组合中。在(5)中,B被排除。
[2] Alheit,J.Egg cannibalism versus egg predation: their significance in anchovies[J].S.Afr.J.Mar.Sci,1987(5):467-470.
[3] Ambrose,W.Influences of predatory polchaetees and epibenthic predators on thestructure of a soft-bottom community in a marine estuary[J].J.Exp.Mar. Biol.Ecol,1984(81):115-145.
[4] Ambrose,W.Role of predatory infauna in structuring marine softbottom communities[J].Mar.Ecol.Prog.Ser,1984(17):109-115.
[5] Anderson,R.Predator-prey relationships and predation rates for crustacean zooplankters from some lakes in western Canada[J].Can.J. Zool,1970,48:1229-1240.
[6] Askew,R.Parasitic Insects[M].NY: Am. Elsevier,1971:316.
[7] Banks,C.Cannibalism and predation by aphids[J]. Nature,1968,218:491.
[8] Barkai,A.Biologically induced alternate states in two rocky subtidal benthic communities[PhD thesis]. Univ.Cape Town, S.Afr. 1987,231.
[9] Barkai,A., McQuaid,C.Predator-prey reversal in a marine benthic ecosystem[J].Science,1989(242):62-64.
[10] Benke,A.1978.On the significance of interactions among coexisting predators: a field experiment with dragonfly larvae[J].J.Anim.Ecol,1978(47):335-350.
[11] -[159]文獻略
