探究钴卟啉模拟结肠发酵对肠道菌群的调控
2020-07-07冯潇包璇向沙沙沈宇标应轩宇应剑纪伟朱炫
冯潇,包璇,向沙沙,沈宇标,应轩宇,应剑,纪伟,朱炫*
1(浙江工商大学 食品与生物工程学院,浙江 杭州,310000)2(浙江清华长三角研究院,浙江 嘉兴,314000) 3(中粮营养健康研究院有限公司,北京,100000)
钴卟啉(又称钴胺素、VB12)是唯一一种含有金属元素的维生素。钴卟啉的核心为中心咕啉环(图1),由4个相连的吡咯和螯合在中心的3价钴离子构成。环上方的Coβ配基不同则会形成不同形式的钴卟啉,例如,和钴离子相连的是—CN,则称为氰钴胺,—CH3则为甲钴胺。

图1 钴卟啉的结构图
Fig.1 The structure of vitamin B12
钴卟啉是唯一一种需要肠道分泌物(内源因子)帮助才能被吸收的维生素。因此肠道健康对钴卟啉的代谢利用非常重要。氰钴胺是钴卟啉中口服吸收最快的化合物,但不能被机体直接利用,需要在体内经过转化生成甲钴胺和腺苷钴胺后方可起效。与氰钴胺相比,甲钴胺能够较好地分布到神经组织,因此在治疗周围神经病变方面,甲钴胺临床应用的安全性及疗效均优于氰钴胺;而氰钴胺的主要适应症为巨幼红细胞性贫血。
许多研究认为,钴卟啉之所以能调节肠道微生态,是因为钴卟啉是原核生物和藻类生长的限制性因子[1]。大多数微生物体内存在不可替代的钴卟啉依赖通路,却缺乏合成钴卟啉的基因。由于外界环境中可获得的钴卟啉水平有限,因此钴卟啉的摄入影响肠道菌群的生长及代谢。在肠道细菌从环境中获得钴卟啉的过程中,Btu家族蛋白具有核心作用[2],其不同的家族成员负责不同结构钴卟啉的转运[3]。BERTRAND等[4]发现在低VB12的环境中,VB12转运蛋白的表达量会上升以便摄取更多VB12。由于不同肠道菌群之间对VB12存在竞争,很可能改变菌群的组成和功能表达的变化[5]。例如,钴卟啉刺激肠出血性大肠杆菌的Stx2基因表达,从而促进志贺毒素的产生[6]。
体外模拟结肠发酵模型是一种体外微生物培养体系,可以模拟人体肠道菌群的生长和代谢,适用于研究人体肠道微生态和食品微生物消化。该模型尤其适用于考察食品中的营养素与肠道微环境的相互作用。ALEXANDRA等[7]在体外单相连续发酵模型中接种固定化的儿童粪便菌群,结果发现铁缺乏会削弱微生物群的屏障作用,对肠道健康产生负面影响。BOTHE等[8]利用计算机控制的大肠近端模型TIM-2系统评估了不同剂量乳果糖的益生作用,结果发现每天摄入5 g乳果糖,连续5 d后,能提高肠道中双歧杆菌属和乳酸菌丰度,增加丁酸和乳酸的含量。
本研究的目的,是在现有体外结肠发酵模型的基础上,优化培养基和发酵气体环境;开发电子鼻快速检测方法判定肠道菌群的稳定性,从而建立可用于体外快速评价的多相连续结肠发酵模型。利用优化的系统,探讨甲钴胺和氰钴胺这2种不同结构的钴卟啉对肠道微生态的调控作用,考察对肠道菌群及其代谢产物的影响,为开发预防肠道疾病和治疗肠病的药物及功能性食品提供科学参考。
1 材料与方法
1.1 材料与试剂
PBS缓冲液、蛋白胨、酵母提取物、胰蛋白胨、L-半胱氨酸盐酸、猪胆盐、3号胆盐、血红素、果胶、淀粉、葡萄糖、黏液素、NaCl、KCl、NaHCO3、K2HPO4、KH2PO4、MgCl2·6H2O、CaCl2·6H2O、MgSO4·7H2O、FeSO4·7H2O、CaCl2·2H2O、MnCl2·4H2O、七水硫酸钴、ZnSO4·7H2O、六水氯化镍、CuSO4·5H2O、N2(纯度≥99.999%)、 CO2(纯度≥99.999%)、甲钴胺、氰钴胺、DP320 TIANGEN细菌基因组提取试剂盒,TIANGEN公司。
1.2 仪器与设备
CP413电子精密天平,上海奥豪斯仪器有限公司;AW400SG/TG厌氧工作站,英国Electrotek公司;TGL-16台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;CHA-S恒温振荡培养箱,常州国华电器有限公司;NanoDrop ND2000超微量分光光度计,Gene Company Limited;合作设计四联玻璃发酵罐上海百伦生物科技有限公司;DK.8D恒温水浴锅,上海精宏实验设备有限公司;电子鼻由实验室自主研发。
1.3 实验方法
1.3.1 发酵装置的优化
1.3.1.1 实验对象与样品采集
选择5名健康青年的粪便5 g,混合后在厌氧工作站中将粪便溶解于200 mL的PBS缓冲液, 600 r/min离心1 min,得到粪便细菌提取液。
1.3.1.2 正交实验探究静态发酵最佳培养基成分
对无机盐、胆盐、果胶、淀粉、葡萄糖、胰酶、黏液素这7个因素设计正交实验,共得到8种培养基,如表1所示。
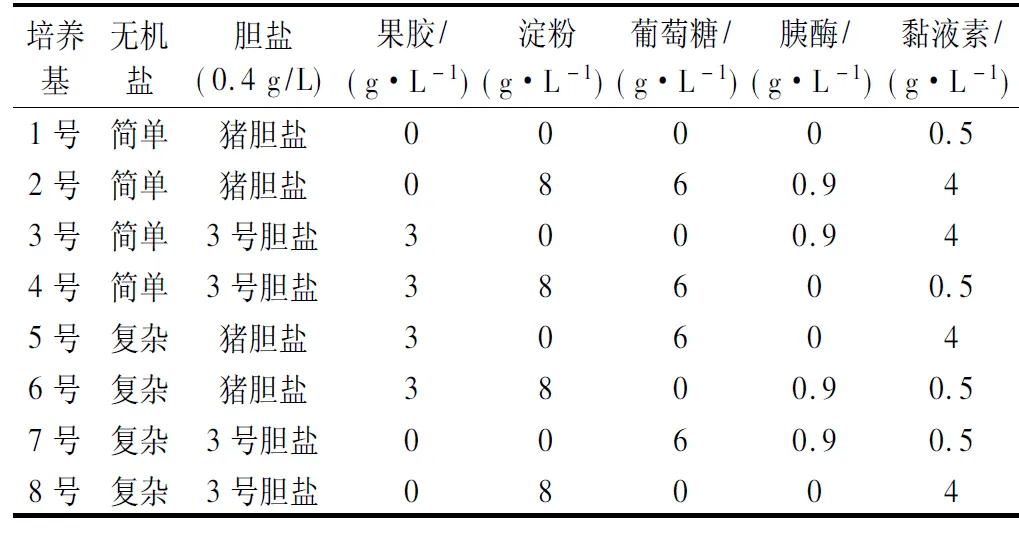
表1 正交实验设计Table 1 Orthogonal experimental design
其中,简单无机盐配方(g/L):NaCl 0.1、K2HPO40.04、KH2PO40.04、MgSO4·7H2O 0.01、CaCl2·6H2O 0.01、NaHCO32.0;复杂无机盐配方(g/L):NaCl 4.5、KCl 2.5、KH2PO40.4、MgCl2·6H2O 4.5、CaCl2·6H2O 0.2、MgSO4·7H2O 3.0、FeSO4·7H2O 0.1、CaCl2·2H2O 0.1、MnCl2·4H2O 0.32、七水硫酸钴0.18、CuSO4·5H2O 0.01、ZnSO4·7H2O 0.18、六水氯化镍0.092;不变的基础成分(g/L):蛋白胨 3.0、酵母提取物4.5、胰蛋白胨3.0、L-半胱氨酸盐酸盐0.8、胆盐0.4、血红素0.05。
配制8种培养基各200 mL,接种10 mL的粪便菌,通N25 min后密封, 37 ℃恒温振荡培养48 h,每24 h取样并测定OD600吸光值。取发酵样液后用DP320 TIANGEN细菌基因组提取试剂盒提取细菌DNA并送至联川生物公司进行16S rRNA测序分析[9]。
1.3.1.3 体外发酵气体环境
搭建5组体外模拟单相发酵系统,初始培养基为300 mL,接种15 mL的粪便菌悬液后,先进行24 h的静态发酵以稳定菌群。24 h后设置流速为12.5 mL/h,37 ℃、pH 6.8恒温发酵7 d。5个发酵罐内分别通100%N2(纯度≥99.999%)、80% N2和20% CO2(纯度≥99.999%)混合气、50%N2和50% CO2混合气、20%N2和80% CO2混合气、100% CO2以保持发酵罐内的厌氧环境。每天收集发酵液样品提取DNA和做16S rRNA测序分析[9]。
取发酵液样品15 mL装于250 mL的锥形瓶中,保鲜膜封口,40 ℃水浴5 min。电子鼻实验参数:清洗时间120 s,测定时间75 s,洗涤气体为标准空气。由SmartNose软件每秒采样10次,测量结束后保存各个传感器的数据。
1.3.2 基于优化的模型探究两种钴卟啉对肠道菌群的调控作用
1.3.2.1 体外模拟发酵过程
搭建3组单相发酵系统,培养基900 mL接种90 mL的粪便菌。通过每日电子鼻测定,判断发酵进入稳定期后,将大发酵罐中900 mL发酵液均匀分装到a、b、c 3个小发酵罐中,在b和c中分别添加甲钴胺和氰钴胺使质量浓度达到1.25 mg/L。a、b、c分别为对照组(CON)、甲钴胺组(MECBL)和氰钴胺组(CNCBL),进行7 d的连续发酵。搅拌转子转速为120 r/min,温度37 ℃, pH 6.8,每日早、中、晚对每个发酵罐通5 min N2保持厌氧。每天收集发酵液样品,提取DNA和16S rRNA测序分析[9]。
1.3.2.2 气质联用测定短链脂肪酸
取一定量的发酵液样品8 000 r/min离心2min,取上清液再经0.45 μm的滤膜过滤。预处理和色谱条件参照文献[10],其中检测器为电喷雾离子源,离子源温度350 ℃。
1.3.2.3 酶活力的测定
取一定量的样品摇床120 r/min振摇30 min,4 000 r/min 离心5 min,收集上清液即为酶液[11]。采用DNS比色法测定纤维素酶活力[12],采用福林-酚试剂法测蛋白酶活力,碘-淀粉比色法测淀粉酶活力[13]。
1.3.3 数据分析
将16S rRNA测序后得到的数据,利用SPSS Statistics 20软件对16S rDNA测序结果所有类群的相对丰度和多样性指数进行数据前处理。将菌属、菌门丰度表用SPSS计算出Z值,并导入MeV4.9.0创建热图。用SPSS计算出菌属之间的Spearman相关性,后导入Cytoscape软件绘制相关性网络图。将菌属丰度表和短链脂肪酸(short chain fatty acid, SCFA)质量浓度表导入Canoco_2249软件进行典型相关分析并绘图。利用Origin 8.5将菌属和菌门丰度表绘制成柱状图。选择Chao1指数和Shannon指数导入Origin 8.5绘制箱线图表现α-多样性。利用Galaxy网站在线对OTU表的基因功能进行PICRUSt预测。
2 结果与分析
2.1 发酵装置的优化
2.1.1 最优静态发酵培养基
结果表明,经过48 h发酵后,7号培养基的菌门结构与粪便原样最为相近,变形菌门(Proteobacteria)相对丰度很大,其他菌门丰度很小(图2)。

m1~m8-1号~8号培养基的菌门结构;feces-粪便 原样的菌门结构
图2 菌门层面热图和聚类分析
Fig.2 Heatmap and Hierarchical clustering
在菌属层面经过热图聚类发现(图3),菌属结构与粪便原样最为接近的是4号培养基,两者的菌群结构中,埃希氏属(Escherichia)所占的丰度最高,乳杆菌属(Lactobacillus)次之。7号和4号培养基的具体组成成分见方法1.3.1.2。

m1~m8-1号~8号培养基的菌属结构;feces-粪便 原样的菌属结构
图3 菌属层面热图和聚类分析
Fig.3 Heatmap and Hierarchical clustering
此外,根据在OD600下测得的吸光度值,细菌生长速度最快且没有出现衰退的培养基是8号培养基(图4)。

图4 各组在发酵24 h和48 h的菌群相对生长速度
Fig.4 The relative growth rate of bacteria after 24 h and 48 h fermentation in each group
2.1.2 最优发酵气体环境
对5组不同气体环境的发酵样品的菌群结构进行热图聚类分析(图5)。C20、C50、C80组都聚为一类, C100和N100聚为一类,但组间代表菌丰度的色块相差不大。总体上,气体环境对模拟系统内的菌群影响很小。

C100、C80、C50、C20分别表示CO2体积分数为100%、80%、 50%、20%,剩余体积分数为N2的实验组,N100表示 100%N2的对照组
图5 菌属层面的热图和聚类分析
Fig.5 Heatmap and hierarchical clustering
2.1.3 微生物检测方法的优化
将电子鼻各个传感器数据与16S rRNA测序的菌门丰度数据分别进行热图聚类分析,再将这2种方法的聚类结果进行比较。由附件1(kns.cnki.net/kcms/detail/11.1802.TS.20200317.2015.011.html)可知,2种方法的聚类结果基本一致。
在电子鼻和菌门数据之间建立矩阵,在所有样品数据中随机选择40组导入,以传感器1为例,建立回归模型为y=5.047Firmicutes-0.057Bacteroidetes-0.066Actino-bacteria+0.043Fusobacteria+61.727+0.183Bacteria(R2=0.836),该回归模型预测率高达70.0%。由于电子鼻具有准确的定性与定量能力,且测定速度快,操作方便经济,因此将其作为快速判定不同时间点发酵罐内的菌群结构是否相似的标志,即发酵罐是否进入稳定期的标志。
2.2 钴卟啉对菌群结构和代谢的影响
2.2.1 菌群结构差异和Alpha多样性
选取对照组、氰钴胺组、甲钴胺组第4天、第7天的样品16S rRNA测序结果进行微生物谱图分析,16S rRNA测序结果为352 403 reads,平均样本深度为19 577.9 reads,标准差为9 002.1 reads。经97%的相似度聚类,共得到了2 422个OTU。
如图6所示,在体外模拟结肠发酵体系中加入甲钴胺后,微生物的物种多样性较其他2组都显著下降。在物种均匀性方面,甲钴胺和氰钴胺Shannon指数都显著下降,说明结肠不同种类的微生物均匀性下降。这些结果表明钴卟啉对肠道菌群具有选择性作用。血红素含有1个卟啉环结构,具有同样的效果[14]。

a-3组微生物多样性指标Chao1值;b-3组微生物多样性 指标Shannon值
图6 对照组、甲钴胺组和氰钴胺组的alpha多样性指数
Fig.6 Alpha diversity of CON, MECBL and CNCBL
注:*代表P<0.05,**代表P<0.001,***代表P<0.000 1
当持续7 d分别加入2种钴卟啉后,不动杆菌属占比都显著上升,而拟杆菌属、肠杆菌科某属、瘤胃球菌科某属等占比均有显著下降(图7),梭菌属(ClostridiumXIVa)、大肠埃希氏菌(Escherichia)占比发生了相对较小的下降。大肠埃希氏菌的减少可能是因为在钴卟啉高浓度情况下,其btuB的VB12核糖体开关与VB12的结合呈关闭状态,从而截断下游基因表达[15]。
由LEfSe分析发现氰钴胺提高了梭菌科(Fusobacteriaceae)、瘤胃球菌、Brevundimonas等细菌的相对丰度,而甲钴胺促进了Clostridiumsensustricto、Clostridiaceae1、Clostridiale-IncertaeSedisⅪ等细菌的相对丰度(附件2, kns.cnki.net/kcms/detail/11.1802.TS.20200317.2015.011.html)。梭菌科、瘤胃球菌、Brevundimonas等与炎症和癌症相关,可见补充氰钴胺存在引发肠道炎症的风险,并且会加重炎症性肠道疾病(inflammatorybowl disease,IBD)患者的炎症[16]。甲钴胺促进了产丁酸盐细菌的相对丰度,而丁酸盐具有包括抗炎、抗肿瘤活性、增强结肠屏障的作用[17]。此外,许多研究表明,缺少钴卟啉与IBD有关[18-20],因此及时补充钴卟啉很有必要。而比起氰钴胺,甲钴胺是更好的选择,能在补充钴卟啉的同时减轻肠道炎症。

a-对照组;b-甲钴胺组;c-氰钴胺组
图7 发酵7 d后对照组、甲钴胺组和氰钴胺组的菌属分布柱状图
Fig.7 Bacterial genus histogram after 7 days fermentation of CON, MECBL and CNCBL
2.2.2 短链脂肪酸和酶活变化
在甲钴胺组中,丁酸含量在第1天远高于其他2组,随后下降;丙酸和异戊酸随时间增多(图8)。丙酸可以抑制胆固醇的合成,通过平衡乙酸与丙酸的比例可以降低心血管疾病的风险[21]。因此摄入甲钴胺有益于脂代谢健康。丁酸在甲钴胺组发酵第1天的占比最高,可能是因为在发酵过程中,Roseburia、Blautia以及Lachnospira的丰度在减少,这几种菌主要参与丁酸的产生。由此可见,摄入甲钴胺还有利于人体对蛋白质的吸收利用。
由图9可知,甲钴胺组的蛋白酶活力第2天迅速上升随后又迅速下降(P<0.05)。除此以外,钴卟啉组和对照组之间无显著性差异。氰钴胺组的淀粉酶活性在第2、3、5天显著高于对照组,而甲钴胺组第2、3、4、7天显著低于对照组 (P<0.05)。对照组与钴卟啉组的羧甲基纤维素酶活性没有显著性差异。其中,甲钴胺组的蛋白酶活力迅速上升又迅速下降,可能与甲钴胺组丁酸占比下降有关。结合有机酸结果,甲钴胺组异戊酸日益增加,而蛋白质发酵主要产生支链脂肪酸[22],蛋白酶的结果验证了这一点。

a-对照组短链脂肪酸占比;b-甲钴胺组短链脂肪酸占比; c-氰钴胺组短链脂肪酸占比
图8 对照组、甲钴胺组和氰钴胺组短链脂肪酸的占比
Fig.8 SCFA composition ratio in CON, MECBL and CNCBL

a-蛋白酶活力变化;b-淀粉酶活力变化;c-羧甲基纤维素酶活力变化
图9 蛋白酶、淀粉酶和羧甲基纤维素酶活力随发酵时间的变化
Fig.9 The change of protease, amylase and cellulose activity with fermentation time
2.2.3 典型关联分析
由图10可知,甲钴胺和假单胞菌(Pseudomonas)、丙酸、丁酸皆呈正相关,说明加入一定量的甲钴胺可以提高假单胞菌的相对丰度,促进丙酸和丁酸的产生。不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacteriaceae)以及埃希氏杆菌属(Escheriehia)与异戊酸和异丁酸含量呈正相关,其原因可能是甲钴胺和氰钴胺大大增加了不动杆菌属的丰度,相比之下肠杆菌属和埃希氏杆菌属的减少并不重要。甲钴胺组的异戊酸和异丁酸含量在增加,氰钴胺组不变,可能还存在其他影响因素。脱硫弧菌属(Desulfovibrio)等与乙酸正相关,甲钴胺组的发酵过程中乙酸含量日益减少,这表明甲钴胺族脱硫弧菌属的丰度可能在减少。

图10 三组菌群典型关联分析
Fig.10 Canonical correspondence analysis of microbiota in three groups
2.2.4 肠道菌群功能分析
通过PICRUSt预测得到24个二级代谢通路,262个三级代谢通路。由图11可知,大多数二级代谢没有受到钴卟啉的影响。钴卟啉能促进肠道菌的脂质代谢、萜类化合物和聚酮类的代谢、外源性物质降解代谢,抑制转录和其他次生代谢产物的合成。选取三级代谢中钴卟啉组与对照组有显著性差异的前10个代谢途径作图,如图12所示。
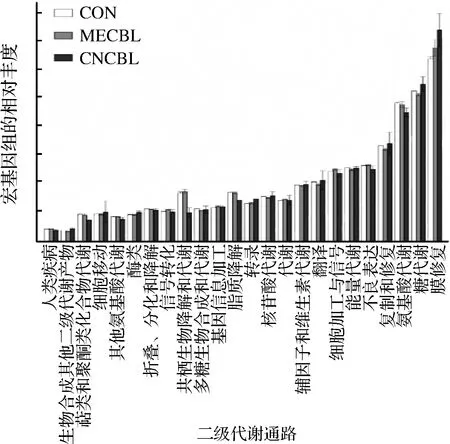
图11 菌群主要二级代谢通路的比较
Fig.11 Comparisons of the predominant secondary metabolism pathways of the microbiota

图12 菌群主要三级代谢通路的比较
Fig.12 Comparisons of the predominant third-level metabolism pathways of the microbiota
在三级代谢层面,与对照组相比,在卟啉组中ABC转运蛋白(ko02010)通路、DNA修复和重组蛋白(ko03400)通路、氮代谢 (ko00910)、磷酸转移酶系统(ko02060)表达量均显著下降,氰钴胺组比甲钴胺组的代谢通路表达量更低。
3 结论
本研究首先对体外肠道模拟体系进行优化。通过正交实验得到与粪便菌群菌门、菌属相似度最高的培养基以及菌生长最快的培养基。气体环境对模拟系统内菌群的影响较小。针对目前微生物检测方式耗时长的局限性,本研究提出可利用电子鼻快速评估肠道菌落的方法。该方法具有较好的定性能力,定量检测准确度为70%,可用于判定菌群结构是否进入稳定期。
本研究考察了不同钴卟啉对肠道菌群的调控作用。结果表明,甲钴胺和氰钴胺都降低了肠道菌群α-多样性。在菌属的相对丰度层面,加入2种钴卟啉后不动杆菌属占比都显著上升,而拟杆菌属、肠杆菌科某属、瘤胃球菌、大肠埃希氏菌都下降。氰钴胺提高了梭菌科(Fusobacteriaceae)、瘤胃球菌、Brevundimonas等与炎症和癌症相关细菌的相对丰度;而甲钴胺促进了Clostridiumsensustricto、Clostridiaceae1、Clostridiale-IncertaeSedisⅪ等产丁酸细菌盐的相对丰度,从而具有抗炎、抗肿瘤、增强结肠屏障等作用。在消化酶方面,氰钴胺促进淀粉消化,甲钴胺抑制淀粉消化,2种钴卟啉对蛋白质、纤维素的消化无显著影响。通过对代谢通路的预测,2种钴卟啉都促进脂质代谢、萜类和聚酮类代谢、外源性物质降解,同时抑制转录因子等次生代谢产物的合成、ABC转运蛋白、DNA修复和重组蛋白代谢、氮代谢以及磷酸转移酶系统代谢,且氰钴胺组抑制作用比甲钴胺组更强。鉴于本课题的研究结果,建议在将钴卟啉作为膳食补充剂时,将甲钴胺代替常用的氰钴胺作为首选,这有利于人体肠道菌群产生更有益的代谢产物,使宿主更健康。
