香芹酚对H2O2诱导神经细胞突触损伤的修复作用
2020-07-04艾立瑶秦东旭王力波
艾立瑶,秦东旭,王力波,宋 英
(浙江工业大学药学院,浙江杭州310014)
神经退行性疾病为慢性进行性疾病,其特征在于中枢神经系统的感觉或认知系统中神经元和轴突的丧失.神经退行性疾病包括阿尔茨海默氏病(AD)、帕金森病(PD)、亨廷顿病(HD)、精神分裂症和肌萎缩侧索硬化症(ALS)虽都具有不同临床表型和遗传病因的疾病,但都是由神经变性过程形成的[1].现有的针对这些疾病的药物只能通过缓解症状来延缓疾病进展;然而,这些药物不能对神经元进行治愈,也无法预防神经元的潜在退化.所以需要新的策略预防由神经炎症和神经变性引起的进行性神经元损失.
香芹酚(CA)是在许多芳香植物中发现的酚类单萜,包括牛至和百里香[2].已经发现其具有抗癌、抗氧化、抑菌、调节血糖、抗炎等多种生物学活性[3].进一步研究发现 CA容易穿过血脑屏障(BBB)并调节中枢神经递质和神经调节剂,如多巴胺[4-5].以前的研究已经证明了CA在不同动物模型中的神经保护作用,这些作用与抗氧化和抗炎作用相关[6].但是,CA在神经退行性疾病中潜在的药理学应用需要进一步研究.本研究应用H2O2处理PC12细胞制作体外神经元损伤模型.由于PC12细胞具神经内分泌细胞的一般特征,因其具有可传代培养的特点,广泛的被作为神经元细胞模型,应用于脑缺血损伤[7]、化学性缺氧损伤[8]、神经元分化[9]以及轴突生长[10]等神经系统疾病、神经生理和神经药理学的体外研究.CA已被证明在抗氧化和抗凋亡方面有较好作用,而主要研究CA对于神经细胞损伤的修复作用和对神经突生长的作用.
1 材料与方法
1.1 试剂与仪器主要试剂:DMEM培养基(吉诺生物医药科技有限公司)、PBS(吉诺生物医药科技有限公司)、质量分数0.25%胰酶(吉诺生物医药科技有限公司)、胎牛血清(碧云天)、马血清(Gibco)、B27 添加剂(Gibco)、N2 添加剂(Gibco)、二苯基四氮哇澳盐(MTT,Sigma)、多聚赖氨酸(PLL,Sigma)、Hoechst 33341(碧云天)等.
主要仪器:酶标仪(型号:speetramaxMZe)、垂直流超净台(ESCO,SCV-4A1)、CO2培养箱(Thermo Scientific系列8000)、显微镜(Nikon)等.
1.2 细胞培养
1.2.1 PC12细胞培养 PC12细胞培养于质量分数10%胎牛血清的DMEM培养基中,置于37℃体积分数5%的CO2一定饱和湿度环境条件下连续培养,倒置显微镜观察细胞形态.
1.2.2 神经元细胞培养 从新生SD乳鼠的脑中提取原代皮质神经元,皮质与大脑分离,置于预冷的Hank缓冲液中冲洗.再用质量分数0.125%胰蛋白酶-EDTA在37℃下消化组织25 min.将细胞悬浮液以1 000 r/min离心5 min.然后将细胞沉淀物首先置于含多聚赖氨酸预涂盖玻片的培养基中(DMEM,质量分数10%胎牛血清、质量分数10%马血清),并在体积分数5%的CO2浓度的37℃培养箱中培养.4 h时,将培养基更换为神经元基础培养基(DMEM,质量分数10%马血清和质量分数2%的B27),并且每2~3 d更换1次.3 d后更换阿糖胞苷培养基抑制神经胶质细胞生长.
1.3 PC12细胞模型的建立与观察为了观察H2O2对细胞的损伤情况,将PC12细胞接种于96孔板.在培养液中加入不同浓度的H2O2,正常对照不加H2O2,仅加入等量的培养液,放在37℃体积分数5%的CO2培养箱孵育.药物处理24 h后,倒置显微镜下观察PC12细胞形态和生长情况.
1.4 细胞活性检测
1.4.1 细胞存活率检测 采用MTT法检测细胞存活率.96孔板每孔加入10 μL MTT(质量浓度5 mg/mL溶于磷酸盐缓冲液(PBS)),置于37℃体积分数5%的CO2,培养箱继续孵育4 h,弃去上清液,每孔加入 150 μL 二甲基亚砜(DMSO),震荡10 min,待结晶完全溶解后,酶标仪测定波长490 nm处吸光值.以正常组所测的MTT吸光值为100%,损伤组及药物处理组与正常组的比值百分比,计算存活细胞数的百分率.
1.4.2 细胞凋亡检测 Hoechst 33342核染色用来检测细胞凋亡率.将PC12细胞接种于24孔板上,经药物处理后,加入Hoechst 33342,使其终体积浓度达到10 μL/mL,在荧光显微镜下观察细胞形态并拍照.
1.5 细胞突起长度分析PC12细胞以3×104/孔的密度接种于6孔板,荧光显微镜下观察并拍照,每组随机选取5张图,应用Image J图像分析软件分别测量每张图片中所有PC12突起的总长度及神经元的总数目,计算PC12细胞神经元突起的平均长度.
1.6 统计学分析通过均数±标注差(x±s)表示实验数据,单因素方差分析采用 Graphpad Prism 5.0软件进行,多组间比较Tukey检验.
2 结果
2.1 H2O2诱导PC12细胞损伤
2.1.1 H2O2诱导PC12细胞活力降低 用不同浓度H2O2作用于PC12,光镜显微镜下观察细胞形态.显微镜拍照结果可见对照组细胞胞体饱满,以长梭形为主,部分呈圆形或三角形,突起光滑粗大,交互成网状.随着 H2O2浓度上升,可见实验组PC12细胞胞体大部分萎缩变圆,突起明显变短甚至消失,细胞损伤严重(图1A).MTT法检测细胞存活率.结果提示,与对照组相比,损伤组MTT吸光度随H2O2浓度升高逐渐降低,证明细胞存活率随H2O2浓度升高不断下降(图1B).
2.1.2 H2O2诱导PC12细胞凋亡增加 Hoechst 33342荧光染色发现,空白对照组罕见凋亡小体,损伤组随着H2O2浓度增加,凋亡小体比例逐渐增加(图1BC).
2.1.3 H2O2诱导PC12细胞突起减少 通过图像软件分析统计得出随着H2O2浓度上升,细胞突起长度发生短缩(图1E).(A)PC12的形态学观察.(B)MTT测定(n=3).(C)Hoechst 33342染色.(D)PC12细胞凋亡率的分析.数据表示平均值±SD.P<0.000 1与对照组相比.(E)PC12细胞的神经突长度分析.数据表示平均值±SD.P<0.000 1与对照组相比.
2.2 香芹酚对H2O2诱导损伤PC12细胞的保护
2.2.1 香芹酚降低H2O2诱导损伤PC12细胞凋亡MTT法检测细胞存活率.检测结果显示浓度0.01 mmol/L CA能明显改善细胞活力,差异具有统计学意义,P<0.05(图2B),而浓度较高时对细胞生长活力有较大影响,说明CA对细胞有一定的毒性.Hoechst 33342荧光染色发现,空白对照组少见凋亡小体,CA给药组(浓度0.001和0.01 mmol/L)的凋亡小体较损伤组都有较明显的减少,差异有统计学意义(P<0.001),而浓度0.1 mmol/L的CA凋亡小体减少趋势较小(图2CD).
2.2.2 香芹酚对H2O2诱导损伤PC12细胞突起的保护作用 显微镜拍照结果可见损伤组较对照组PC12细胞胞体萎缩变圆,突起明显变短(图2A).测量对照组及损伤组PC12细胞突起长度,结果显示,和对照组比较,损伤组PC12细胞突起明显变短,差异有统计学意义(P<0.000 1).CA组和损伤组比较,PC12细胞突起明显延长,浓度 0.001 mmol/L CA和0.01 mmol/L CA有较明显趋势,差异明显,具有统计学意义,P<0.000 1(图2E).
(A)PC12的形态学观察.(B)MTT测定(n=3).(C)Hoechst 33342染色.(D)PC12细胞凋亡率的分析.数据表示平均值±SD.P<0.001,与对照组相比.P <0.001,与 H2O2组相比.(E)PC12细胞的神经突长度分析.数据表示平均值±SD.P<0.000 1,与对照组相比.P<0.000 1,与H2O2组相比.
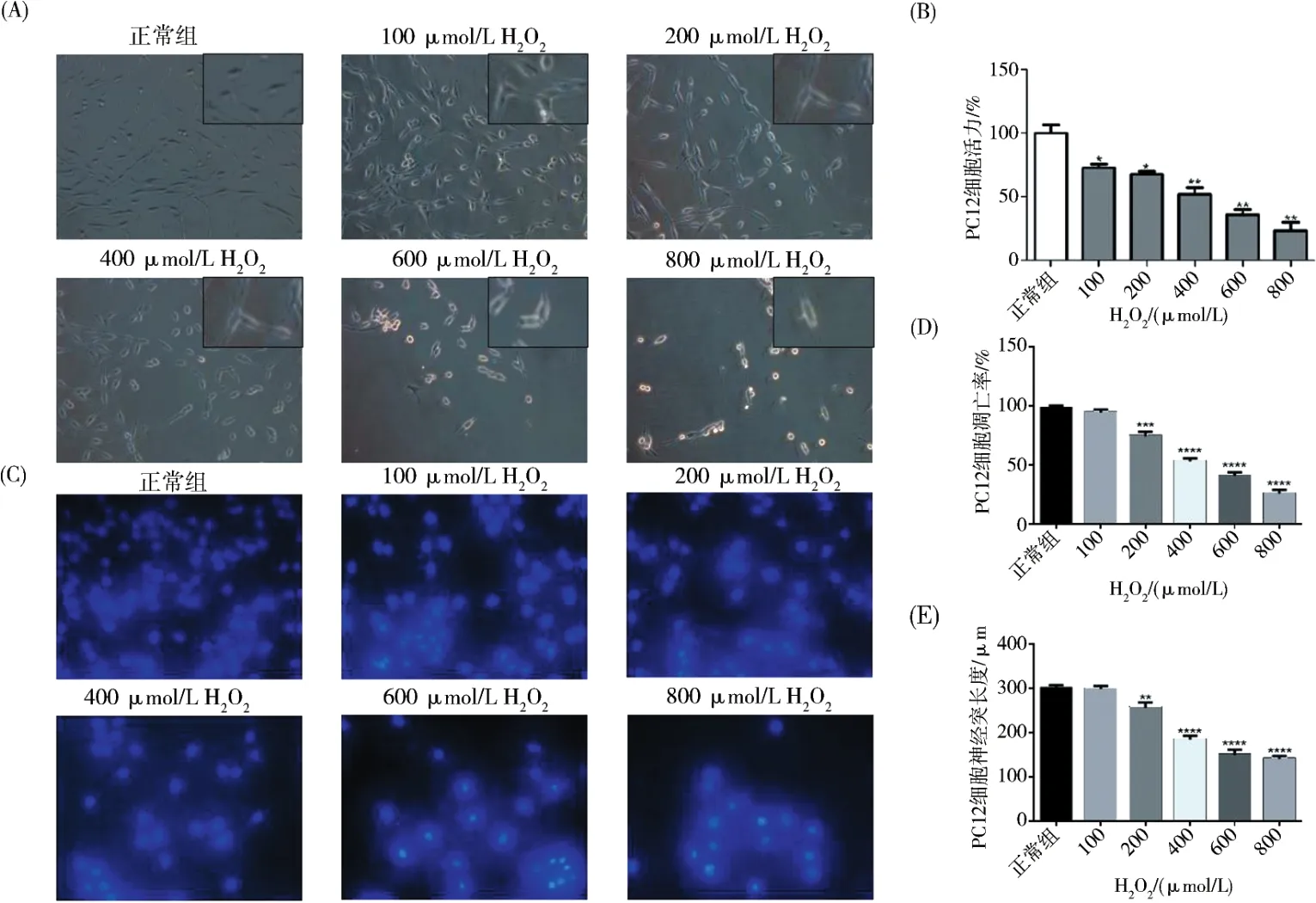
图1 细胞损伤检测Fig.1 Cell damage detection
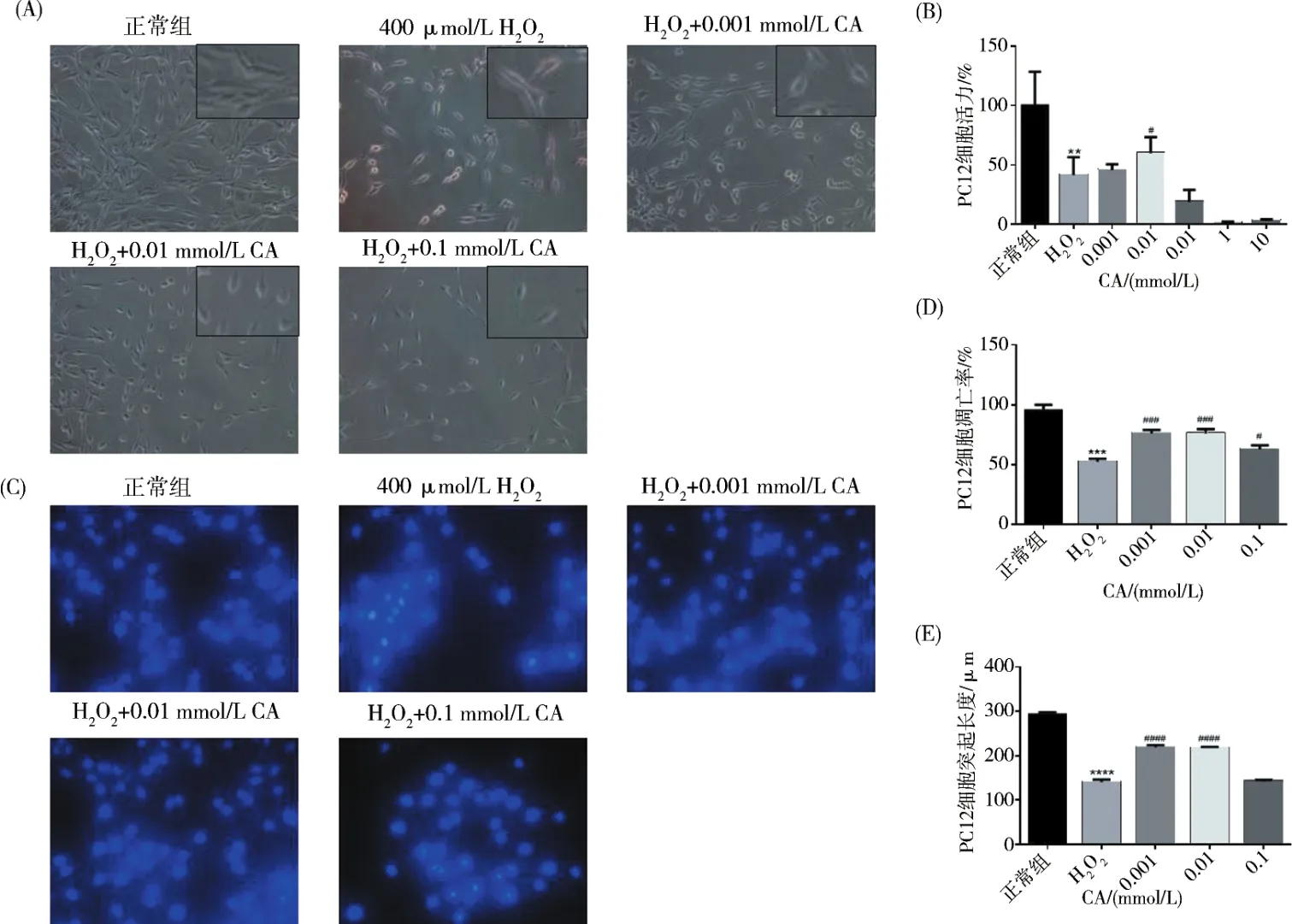
图2 CA对PC12细胞的作用Fig.2 Effect of CA on PC12 cells
2.3 CA对神经元细胞神经突起的作用检测结果显示,神经生长因子(NGF)组较对照组有神经突延长趋势,差异P<0.01(图3A).另外CA组和正常组比较,神经突变长,差异P<0.01(图3B).
(A)神经元的形态学观察.(B)加入CA后一天神经元的神经突长度分析.数据表示平均值±SD.(C)加入CA后两天神经元的神经突长度分析.数据表示平均值 ±SD.P<0.01,与对照组相比.(D)加入CA后3 d神经元的神经突长度分析.数据表示平均值±SD.P<0.01,与对照组相比.

图3 CA在神经元细胞的影响Fig.3 Effect of CA on neurons
3 讨论
氧化应激是由活性物质(过氧化物和氧自由基)的产生与清除之间的不平衡引起的.导致ROS大量积累,造成钙稳态的失调、脂类的过氧化和神经细胞的死亡[11].研究表明,阿尔兹海默症(AD)[12]等神经退行性疾病都与氧化应激损伤有关,其特征在于中枢神经系统感觉或认知系统中神经元和轴突的丧失.PC12细胞为鼠肾上腺髓质嗜铬瘤分化而来的神经细胞株,与神经细胞在发生学上均来源于神经脊,在结构、功能上与神经元有很多相似之处,是一种常用的神经细胞株.而过氧化氢(H2O2)是氧化应激模型常用的损伤药物,通过氧化应激作用可能诱导多种细胞的凋亡.本文通过H2O2损伤PC12细胞24 h建立氧化损伤模型,随着H2O2浓度增加,细胞损伤程度逐渐加重,100 μmol/L浓度H2O2组细胞损伤较轻,而800 μmol/L浓度引起的细胞损伤较重,因此确定400 μmol/L为H2O2最适损伤浓度.随着H2O2浓度增加,细胞凋亡率也随之增加,细胞活力减少,细胞突起缩短.
香芹酚作为较有应用前景的临床药物,除了抗炎、抗氧化应激反应、抗细胞凋亡以及抗肿瘤等生物学效应[13].因其能通过血脑屏障,较多在不同动物模型的神经保护进行研究,已被证实CA具有神经保护作用.本实验在细胞水平上设立了不同浓度CA对H2O2诱导损伤细胞的作用进行研究,发现浓度0.01 mmol/L的CA组对照H2O2损伤组细胞活力有明显增强,细胞凋亡率明显下降.另外H2O2降低了神经突长度,而在存在CA的情况下,PC12细胞可以将神经突长度恢复到一个较高的水平.证明CA可对损伤神经细胞突触进行修复,使神经细胞突触较损伤组有一定的延长.
神经元是神经系统的结构单元,神经系统中神经元之间通过突触紧密联系.突触是将一个神经元的冲动传到另一个神经元或另一细胞间的相互接触的结构,包括突触前膜、突触间隙和突触后膜三部分.通过突触完成神经元之间的信息传递与加工处理,这一过程中神经元个体也需要通过突触来完成自我的信息反馈,所以突触传导对神经元活动的影响也有着重要的意义[14].神经元中的神经突向外生长是神经退行性和神经保护的标志[1].神经突生长是神经元发育,突触形成和神经再生的重要前提.所以促进神经突的生长和神经细胞损伤后的修复在中枢神经系统疾病中的治疗显得尤为重要.在我们的研究中,发现CA对经H2O2诱导的神经损伤细胞的活力增强、细胞凋亡减少、神经细胞突起增长.所以确定了CA对于神经细胞损伤后的修复作用.另外将CA作用于神经元细胞,发现突起较正常组有一定的延长,能够促进神经突的生长,进一步证明了CA对神经细胞突起的增长作用.这也为香芹酚应用于神经系统疾病提供一定的理论基础,为进一步临床应用提供依据.
综上结果表明,CA可对神经细胞起到一定的保护作用,对神经损伤具有一定的修复作用.并且CA对神经元生长发育、神经突向外生长都有一定的促进作用,因此CA应用于中枢神经系统疾病需要进一步研究.
