经皮神经电刺激对去卵巢骨质疏松大鼠血清IGF-1含量和骨生物力学的影响
2020-07-01柏中喜方兴刚乔昱音王梦崔林
柏中喜 方兴刚 乔昱音 王梦 崔林
绝经后骨质疏松症(PMOP)是绝经后女性雌激素水平急剧下降而引起的最突出的慢性疾病之一[1]。因此,由于骨吸收增加,骨形成减少,导致骨重构失衡。在与年龄相关的骨形成损伤的机制方面,生长激素(GH)/胰岛素样生长因子(IGF)系统的缺乏症(GH)和IGF系统的缺失已被认为是一个重要的机制[2]。虽然许多动物和临床研究为IGF系统中的组分的潜在应用增加骨量提供了实验证据,但由于我们对IGF系统中组分的生产和作用的调节认识不全,这些成分在治疗骨质疏松症中的临床应用尚未取得成果[3]。长期以来,针灸一直与人体内的稳态(阴阳)调节有关,并具有促进中枢神经系统(CNS)释放神经肽、激发深远的生理效应,甚至激活自我愈合机制等作用。在临床上,针灸被广泛应用于治疗PMOP所致疼痛,是一种有用的替代和补充疗法。针刺能改善骨矿含量(BMC)、骨密度(BMD)及与PMOP相关的各项指标[4]。本研究采用动态过滤双能X线骨密度仪(DFDE-X)观察BMC和BMD,并测定血清雌二醇(E2)、胰岛素样生长因子-1(IGF-1)、胰岛素样生长因子-BP1(IGF-BP1)和胰岛素样生长因子-β3(IGF-BP3)水平,为临床治疗提供理论依据。
1 材料与方法
1.1 实验动物 从复旦大学医学实验动物中心购买85只12月龄雌性Sprague-Dawley大鼠(200~220 g),发情周期为4 d。将动物饲养在12/12(光/暗)的温度控制(22.0±1.0)℃和12/12(光/暗)的条件下,每组饲养1次。大鼠随机分为5组:完整组(INT组,n=16),假手术组(Sham组,n=18),模型组(Model组,n=18),雌激素组(E组,n=16),经皮神经电刺激组(EA组,n=17)。
1.2 实验方法 卵巢切除在乙醚麻醉 (吸入麻醉,中国医学和化学公司)下进行。(中国)模型大鼠,E组和EA组。在假动物中,只有卵巢周围的脂肪在相同的麻醉下被切除。所有大鼠行阴道涂片每日脱落上皮检查,连续2个发情周期(8~9 d)。INT和SHAM显示正常的4 d发情周期,而去卵巢大鼠阴道涂片脱落上皮细胞无明显变化。大鼠在相同条件下饲养16周。实验程序均严格按照复旦大学上海医学院的指导方针进行。
1.3 口服与经皮神经电刺激治疗 尼尔雌醇(北京四环制药厂,1 mg/片)溶于蒸馏水(0.01 mg/ml)。E组大鼠口服尼尔雌醇0.9 ml/周/100 g(体重),这是一种转化剂量。用双侧“宣中穴(GB 39)”和“明门穴(DU 4)”于上午8∶00~12∶00,Q.D左右给EA组大鼠30 min,4周。针头直径0.22 mm,长度10 mm,插入压力标准。选穴原则遵循“实验针灸学大鼠标准”。玄中(GB39)位于后肢外侧,比外踝顶高约5 mm。明门(DU 4)位于第二腰椎的下方。针头用橡胶水泥固定在穴位上。G 6805-Ⅱ型治疗性刺激器的电脉冲频率为2 Hz(120 r/min),强度为1 mA,可产生轻微的肢体抽搐。所有大鼠均清醒,只被研究人员用手轻轻固定。大鼠在治疗过程中没有表现出任何疼痛或不适。在上一次实验结束时,用DFDE-X骨密度仪在麻醉下扫描动物,然后处死,提取血清。
1.4 BMC、BMD的测定 BMC和BMD用DFDE-X骨密度仪(NorlandXR-36美国)在麻醉下对小动物进行测量。扫描参数为1.0 mm×1.0 mm,60 mm/s,12.00 cm,REV.3.9.3/2.1.0。腰部脊柱采用箱形法,右侧大腿采用随机法进行分析。计算腰椎1~6椎体和右股骨的平均值。
1.5 RIA和ELISA法测定血雌激素和IGFS浓度 在处死时,与相应的完整对照动物一起,在发情期间收集血样(1 ml)。血浆经离心分离后,保存在-70℃冰箱中,待测定。血雌激素的浓度采用从国家原子能研究所(北京,中国)购买的双抗体里亚试剂盒测定。样品一式两份,所有样品一起测定。该试剂盒的灵敏度为2 pg/ml,批内、批间变异系数为4.74%~7.7%。通过ELISA(Diagnostic Systems Laboratories,DSL,USA)检查IGF-1,IGF-BP1和IGF-BP3。该试剂盒对IGF-Ⅰ、IGF-BP 1和IGF-BP3的灵敏度分别为30 ng/ml、0.25 ng/ml和0.04 ng/ml。所有程序都严格按照复旦大学的标准和要求进行。

2 结果
2.1 腰椎1~6和右股骨的BMC和BMD比较 摘除卵巢后12周,随机抽取大鼠进行BMC和BMD检测,以判断模型的成功与否。此后,用雌激素或EA治疗4周后,在DFDE-X骨矿物质密度仪器下检查所有大鼠。Model组大鼠腰椎1~6和右股骨的BMC和BMD明显低于INT组和Sham组,差异有统计学意义(P<0.05)。雌激素使右股骨的BMC和BMD略有增加,而EA则使腰部1~6的BMC和BMD有增加的趋势。见表1。
2.2 5组大鼠IGF-1、IGF-BP1、IGF-BP3水平比较 Model组IGF-1和IGF-BP1水平明显低于INT组和SHAM组(P<0.05)。E组和EA组IGF-1水平提高,EA组IGF-BP1的含量提高(P<0.05)。不同组间IGF-BP3差异无统计学意义(P>0.05)。见表2。
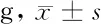
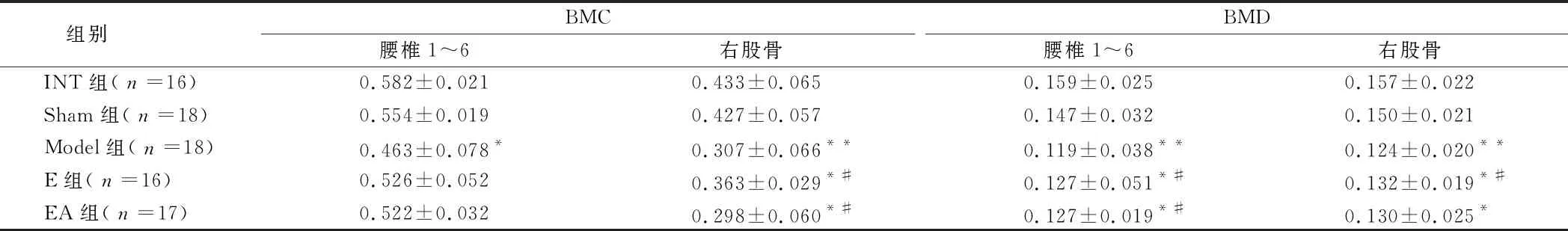
组别BMC腰椎1~6右股骨BMD腰椎1~6右股骨INT组(n=16)0.582±0.0210.433±0.0650.159±0.0250.157±0.022Sham组(n=18)0.554±0.0190.427±0.0570.147±0.0320.150±0.021Model组(n=18)0.463±0.078*0.307±0.066**0.119±0.038**0.124±0.020**E组(n=16)0.526±0.0520.363±0.029*#0.127±0.051*#0.132±0.019*#EA组(n=17)0.522±0.0320.298±0.060*#0.127±0.019*#0.130±0.025*
注:与INR组比较,*P<0.05;与Model组比较,#P<0.05


组别IGF-1IGF-BP1IGF-BP3INT组(n=16)4 260.65±378.9835.26±8.9719.43±3.23Sham组(n=18)3 766.90±91.8835.78±5.9519.80±0.97Model组(n=18)2 881.67±520.56*15.79±5.66*18.28±2.82E组(n=16)4 078.60±478.72#24.05±9.2317.90±0.48EA组(n=17)4 401.13±724.52#35.78±11.37#17.53±0.64
注:与INR组比较,*P<0.05;与Model组比较,#P<0.05
2.3 5组大鼠血清E2水平比较 与INT组比较,Model组和EA组血清E2水平显著降低(P<0.01),而Sham组和EA组差异无统计学意义(P>0.05)。E组E2水平高于Model组,差异有统计学意义(P<0.01)。见表3。


组别E2INT组(n=16)110.02±11.54Sham组(n=18)91.87±20.30Model组(n=18)46.98±11.04*E组(n=16)98.00±11.02#EA组(n=17)41.20±18.22*
注:与INR组比较,*P<0.05;与Model组比较,#P<0.05
2.4 5组大鼠骨生物力学特性比较 与Sham组比较,Model组的骨最大载荷以及骨断裂载荷的值均显著降低(P<0.01)。与Model组比较,EA组、E组的骨最大载荷量以及骨断裂载荷的值均有显著性升高(P<0.01)。见表4。
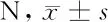

组别骨最大载荷骨断裂载荷INT组(n=16)114.87±4.02104.74±5.60Sham组(n=18)121.47±3.20*120.76±3.74*Model组(n=18)79.20±5.1760.11±5.47E组(n=16)117.54±3.57#102.30±3.98#EA组(n=17)108.13±4.27#87.62±5.47#
注:与INT组比较,*P<0.05;与Model组比较,#P<0.05
2.5 5组大鼠不同骨参数比较 与Sham组相比,E组的卵巢切除术降低了最大功率和刚度(P<0.05)。经皮神经电刺激可以逆转这些降低(P<0.05),但不一定是非穴位(P<0.05)。与Sham组相比,E组的BMD显著降低(P<0.05)。INT组的经皮神经电刺激显着增加BMD。然而,Model组没有表现出显著变化(P>0.05)。见表5。
3 讨论
PMOP是一种以低骨量和骨组织微结构恶化为特征的疾病,导致骨脆性增加,随之而来的骨折风险增加。绝经后骨质疏松症的发病机制尚不清楚,但普遍认为骨吸收率大于骨形成率,从而导致净骨丢失。早期识别有骨折风险的绝经后女性,然后进行有效的治疗干预,可以极大改善患者的预后。有效的药物治疗已经证明减少了椎体和非脊椎骨折的风险[5]。一些疗法,如选择性雌激素受体调节剂和双膦酸盐,能够在治疗过程中尽早起作用,以降低椎体和非椎骨骨折的风险[6]。然而,由女性健康倡议(WHI)进行的最大一次激素替代疗法(HRT)随机临床试验的结果表明,长期使用雌激素和孕激素HRT(EPRT)可以增加癌症风险,甚至可能增加心血管疾病的风险。同时,流行病学研究证实了HRT与女性生殖器官癌风险的关系。现有证据表明,HRT使用者患乳腺癌或子宫内膜癌的风险增加,且风险随着使用时间的延长而增加[7]。此外,由于诊断不足和骨质疏松治疗引起的疼痛,患者常寻求针刺治疗。针灸也被认为是预防骨质流失的一种方法。据报道采用经皮神经电刺激配合耳穴治疗女性骨质疏松症。患者经过9次治疗后完全康复,7个月后BMD明显增加[8]。有研究者采用了对百会(GV20),大椎(GV14),志阳(GV9),明门(GV4)等经络的取消。分别从关元穴(CV4)、气海穴(CV6)、肾舒穴(BL 23)、脾舒穴(BL 20)、宣中穴(BB 39)、太溪穴(KI3)、足三里穴(ST 36)、三阴交穴(SP6)、柴胡穴(BL32)中选取四、六穴,在“德气”后留针40 min,1次/d[9]。同时,用艾灸2~3穴,持续15 min。治疗前及治疗后3个月,测量尺骨、桡骨、椎骨及骨盆的骨密度。结果表明,针灸治疗骨质疏松症是一种有效的药物治疗的替代和补充疗法,是更积极主动治疗骨质疏松症的一部分[10]。


组别最大功率(N)刚性(N/mm)INT组32.16±2.8958.51±2.26Sham组20.66±4.07*45.76±3.11*Model组30.27±4.0155.32±2.69E组28.31±5.12#54.11±3.98#EA组23.67±4.2447.96±5.21
注:与INT组比较,*P<0.05;与Model组比较,#P<0.05
IGF-1在BMD中起着重要作用。近年来,人类IGF-1基因P1启动子区上游多态性与不同民族人群血清IGF-1水平、BMD及骨折危险性有关[11]。基因工程导致IGF-1缺乏小鼠和具有靶向过度表达IGF-1的小鼠强化了IGF-1在胚胎和出生后阶段骨发育中的重要作用。对骨内IGF调控系统及其信号通路的分子解剖,为骨质疏松症的治疗提供了新的治疗靶点[12]。
在6种IGF-1结合蛋白中,IGF-BP1和IGF-BP3对IGF-1的大部分生物活性起调节作用[13]。有证据也显示了IBF BPs的重要调控作用,包括增强和抑制IBF效应。IGF-BP3与90%以上的循环IGF-1结合,结合一个不稳定的酸性亚基,形成稳定的高分子量三元复合物(150 kDa),延长IGF-1的半衰期,防止IGF-1越过毛细血管壁[14]。IGF-1还与其他BPs,主要是IGF-BP1(30~40 kDa)形成较小的二元配合物,可穿过毛细血管,从而促进IGF-1向靶组织的转运。在我们的研究中,EA可能增加IGF-1和IGF-BP1,促进IGF-1和IGF-BP1与PMOP的结合,而雌激素主要影响E2和雌激素受体(ERs)。雌激素不仅对生殖组织功能很重要,而且还影响包括骨和心血管组织在内的外周组织[15]。雌激素对幼龄和老年动物骨密度的保护作用是公认的[16]。因此,与雌激素相比,经皮神经电刺激可能具有抑制PMOP的独特机制。
针灸长期以来一直与体内平衡(阴阳)调节相联系,而针灸疗法在今天的生殖和代谢医学中的应用,在过去的10年里已经在西方建立起来,这是通过坚实的科学数据来支持的[17]。我们观察到经皮神经电刺激可显著提高去卵巢大鼠的血E2水平。然而,在本研究中,我们没有发现EA对PMOP大鼠e2的影响,这可能是因为12个月的雌性大鼠被使用并经历了去卵巢手术。此外,经皮神经电刺激可能通过IGF系统而不是雌激素来增加PMOP大鼠的骨密度,这也解释了为什么EA出现较少的不良反应和癌症风险。
经皮神经电刺激还能提高机体的免疫功能和代谢功能。白介素-6、转化生长因子-β、骨形态发生蛋白等可能参与了经皮神经电刺激对胰岛素样生长因子系统的影响[18]。然而,所有这些推测都需要在进一步的研究中得到证实。
综上所述,经皮神经电刺激可增加PMOP大鼠骨密度,增加IGF-1和IGF-BP1的含量,其作用途径与雌激素不同。
