真核延伸因子-1A2基因在宫颈癌侵袭和迁移中的作用研究
2020-07-01靳馥源潘泽民辛慧珍者湘漪张春贺李洪涛潘贞贞李冬妹郑威楠
靳馥源,潘泽民,辛慧珍,者湘漪,张春贺,李洪涛,潘贞贞,李冬妹,郑威楠
(1 石河子大学医学院生物化学与分子生物学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002;2 石河子大学医学院人体解剖学与组织胚胎学教研室,新疆 石河子 832002;3 成都医学院人体解剖学与组织胚胎学教研室/发育与再生四川省重点实验室,四川 成都 610500)
在世界范围内,宫颈癌是女性常见的癌症[1],宫颈癌在发展中国家尤为普遍,超过80%的宫颈癌病例发生在低收入和中等收入国家,因获得一级和二级预防机会有限[2]。宫颈癌在女性恶性肿瘤中发病率居第二位,死亡率居第三位[3]。宫颈癌的发生涉及诸多因素,其中持续性感染高危型人乳头瘤病毒HPV16,已被公认为是引起宫颈癌,以及发展成为浸润性宫颈癌最主要的因素[4]。肿瘤转移是粘连,迁移和侵袭的过程[5],宫颈癌与其他恶性肿瘤一样,晚期预后不良以及晚期肿瘤浸润和转移对患者的生存率有很大影响,侵袭和转移的发生,导致治疗失败,并且是大多数宫颈癌患者死亡的主要原因。
前期研究发现真核翻译延伸因子1 A2(eukaryotie translation elongation factor 1 alpha 2,eEFlA2)基因在宫颈癌组织中mRNA表达水平增高[6]。真核延伸因子1 A(eEF1A)蛋白质已成为人类许多实体肿瘤和血液癌发生和发展的潜在预测因子。eEF1A2是eEF1A蛋白质家族(eEF1A1和eEF1A2)的两个成员之一,eEF1A1基因位于6q13,eEF1A2基因位于染色体20q13.3上,eEF1A同源物的差异表达在胚胎发生过程中受到调节,其中在最初描述的细胞类型中,首先实现了eEF1A1表达,但一旦达到终末分化,其表达就会被eEF1A2取代[7]。它们结合氨基酰tRNA并促进它们在翻译延伸期间募集到核糖体A位点,主要在脑,心脏和骨骼肌中表达,参与蛋白质翻译过程中的肽链延伸,因此在蛋白质合成中发挥关键作用。eEF1A蛋白质具有与翻译无关的其他功能,如诱导肌动蛋白和微管蛋白细胞骨架后移,eEF1A2通过与锌指蛋白1的相互作用以及随后与具有酪氨酸激酶能力的一组受体相互作用将信号从细胞质传递至细胞核,从而促进有效的细胞增殖。除细胞增殖和细胞凋亡调节外,eEF1A2还参与细胞骨架重排,与Factin相互作用,缩短微管,从而在肿瘤侵袭和迁移中发挥重要作用[8]。为了进一步探讨eEF1A2在宫颈癌细胞发生和发展的作用,我们通过RNA干扰实验将eEF1A2基因表达水平降低,分析对细胞增殖、侵袭和迁移的影响。
1 材料与方法
1.1 细胞及试剂
宫颈癌SiHa、HeLa和C33 A细胞株由本实验室保存提供。DMEM培养基、胎牛血清购自Gibco公司;FuGENE HD转染试剂购自美国Promege公司;transwell聚碳酸酯膜嵌套购自美国Corning公司;兔单克隆抗体E-cadherin购自美国Cell Signaling公司。
1.2 siRNA干扰片段来源
eEF1A2基因的siRNA干扰片段由上海吉玛基因公司设计合成,详细信息见表1。

表1 siRNA引物设计
1.3 宫颈癌细胞的培养及siRNA干扰
宫颈癌SiHa、HeLa和C33 A细胞在5% CO2,37 ℃恒温培养箱中常规培养,培养基为含10%胎牛血清(FBS)和1%青霉素、链霉素的DMEM培养基,待细胞融合度达85%左右时胰酶消化离心。待转染的细胞接种至6孔板中,6孔板接种密度控制在5×105个细胞/孔,培养箱培养24 h,约60%~80%融合度时采用FuGENE HD转染试剂进行转染。待转染的细胞共分4组:空白组为常规培养的宫颈癌细胞;阴性对照(negative control,NC)组为转染Si-NC的宫颈癌细胞;转染Si-eEF1A2-1和Si-eEF1A2-2的实验组。培养箱中培养用于后续实验。
1.4 Western blot 实验
细胞转染48~96 h内提取细胞总蛋白,上样SDS-PAGE电泳分离并转移至PVDF膜,转好的PVDF膜移至含有5%脱脂奶粉中封闭2 h,然后分别移至单克隆兔抗人E-cadherin抗体和小鼠多克隆抗GAPDH抗体中4 ℃孵育过夜。辣根过氧化物酶标记山羊抗兔IgG(H + L)及辣根过氧化物酶标记山羊抗小鼠IgG(H + L)室温下孵育2 h。化学发光仪拍照或暗室曝光检测蛋白质表达量。
1.5 划痕实验
用记号笔在6孔板背面横向划线(转染前一天细胞接种时用空的6孔板操作),横线间隔约1 cm左右,至少保证5条线过6孔板背面。用200 μL无菌移液吸头垂直培养皿划线,不能倾斜,用力要轻,用1×PBS洗细胞3次,去除划掉的细胞,计为0 h并拍照记录。更换无血清培养基继续培养,在24、48 h拍照,拍照时做好相关记录。
1.6 细胞迁移实验
Transwell小室(24孔Transwell小室,8.0 μm孔径;Corning)用于迁移测定。待细胞长至对数期,消化离心细胞,用1×PBS和无血清培养基先后洗涤细胞,计数并调整细胞密度至2×105/mL。在下室(24孔板底部)加入600 μL含10%血清的培养基,上室加入100~150 μL细胞悬液,继续培养24 h。用镊子小心取出小室,吸干上室液体,移至4%多聚甲醛中,室温固定30 min,然后移至0.1%结晶紫染液中,室温30 min。清水冲洗浸泡数次,棉棒小心擦去上室底部膜表面上的液体。显微镜拍照,每个小室随机取5个视野,计数细胞数量。
1.7 平板克隆
在6孔板中每孔接种3 000个细胞,将细胞置于37 ℃ 5%CO2培养箱中培养,每3~5 d换液1次,培养2周。当皿中出现肉眼可见的克隆时,终止细胞培养,弃去培养基,用预冷1×PBS洗2~3次,用4%多聚甲醛固定液,4 ℃固定20 min。0.1%结晶紫染色15 min。用蒸馏水缓慢清洗细胞,将染液洗除,自然干燥。将显微镜调节至低倍镜,对大于50个细胞的克隆进行计数。
1.8 CCK8实验
细胞转染24 h后,消化离心后制成细胞悬液,接种时细胞悬液混匀,避免细胞沉淀,导致盘孔的细胞数量不等,用细胞计数板计数,计数后按2~3×103个细胞/孔100 μL接种至96孔板中,培养箱孵育培养,待细胞贴壁后分别在0、24、48、72 h时间点,每孔加入10 μL CCK8试剂(CCK-8的量按每孔培养基总体积的10%加入),倾斜贴壁加CCK-8试剂,避免插入培养基液面下,否则容易产生气泡,干扰OD值读数。加CCK-8的速度要快,减少试剂在移液器上残留。加入CCK8后,左右轻轻晃动培养板数次,使培养基和CCK8试剂充分混匀,在培养箱内继续培养3 h。用酶标仪测定在450 nm处的吸光值,注意避光。
1.9 统计学分析
使用SPSS 20.0 软件对所得数据进行统计分析,每个实验重复3次,组间比较均采用t检验,计量资料用均数±标准差表示,P<0.05为差异有统计学意义。划痕实验结果计算分析采用:24 h值=0 h宽度-24 h宽度/0 h宽度,即0 h与24 h的宽度差值比上0 h宽度所得的结果;48 h值=0 h宽度-48 h宽度/0 h宽度,即0 h宽度与48 h宽度的差值比上0 h宽度所得的结果。
2 结果
2.1 Western blot实验分析eEF1A2和E-cadherin蛋白质的表达
通过RNA干扰eEF1A2基因,eEF1A2基因的蛋白质表达水平明显降低。同时,上皮-间质转变的相关分子E-cadherin蛋白质表达水平明显升高,提示由于eEF1A2基因表达水平降低,而使上皮-间质转变降低,降低细胞侵袭和迁移(图1)。
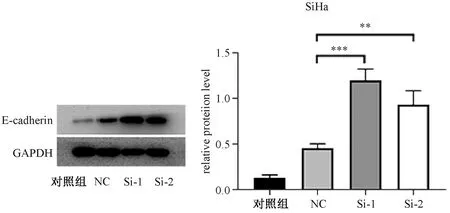

NC:阴性对照;Si-1:Si- eEF1A2-1;Si-2:Si- eEF1A2-2*P<0.05,**P<0.01,***P<0.001。图1 eEF1A2在宫颈癌SiHa细胞蛋白质表达
2.2 划痕实验检测宫颈癌细胞侵袭
RNA干扰eEF1A2基因的细胞培养24 h后划痕,分别在划痕后的0、24、48 h后拍照,与未做任何处理的空白组和阴性对照组相比,干扰后的宫颈癌细胞之间的间隙明显比对照组宽,差异具有统计学意义(图2)。提示通过RNA干扰实验使eEF1A2基因表达水平降低,从而减小宫颈癌细胞侵袭和迁移能力。
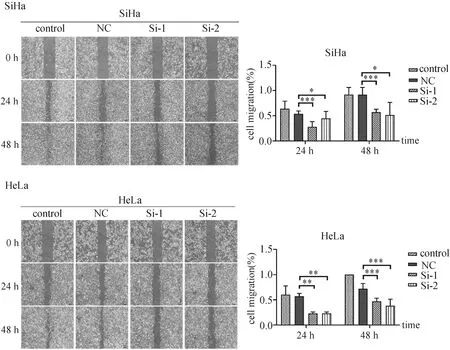
NC:阴性对照;Si-1:Si- eEF1A2-1;Si-2:Si- eEF1A2-2*P<0.05,**P<0.01,***P<0.001。图2 细胞划痕实验检测eEF1A2基因对宫颈癌细胞侵袭的影响
2.3 Transwell
宫颈癌细胞转染24 h后消化离心,制成细胞悬液后计数,传至24板孔上室,培养箱中培养24~36 h,固定、染色后在显微镜下拍照。如图所示,与对照组相比,实验组穿过24孔板小室底部膜的细胞明显减少,差异具有统计学意义(图3)。
2.4 CCK8增殖实验分析RNA干扰eEF1A2基因后细胞的增殖
RNA干扰eEF1A2基因后,SiHa、HeLa细胞的增殖能力明显低于对照组(图4)。
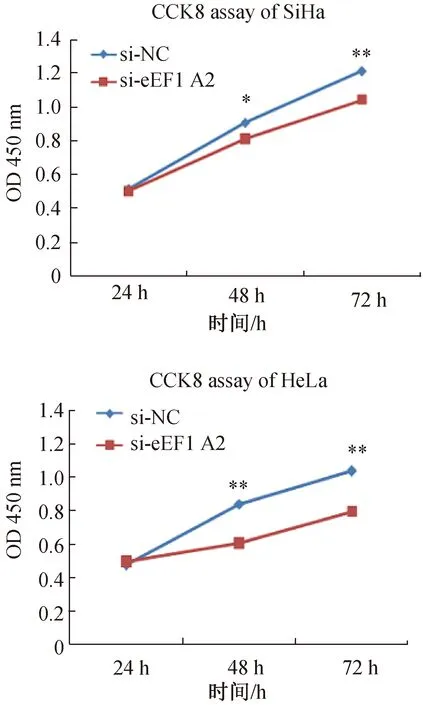
图4 CCK8实验检测宫颈癌SiHa和HeLa细胞增殖能力
2.5 细胞集落形成实验分析RNA干扰后细胞克隆生长
SiHa和HeLa细胞RNA干扰eEF1A2基因后,实验组细胞克隆数明显低于对照组(图5)。

图5 RNA干扰eEF1A2基因对宫颈癌SiHa和HeLa细胞集落形成的影响
3 讨论
通过实验可以证明eEF1A2基因在宫颈癌增殖、侵袭和迁移中发挥重要作用,降低eEF1A2基因表达显著抑制宫颈癌细胞增殖。RNA干扰eEF1A2基因后,通过Western blot实验验证了eEF1A2在宫颈癌细胞中表达下调,EMT标志蛋白质E-cadherin在宫颈癌SiHa细胞中显著上调。通过划痕实验发现eEF1A2基因表达降低后可以显著降低SiHa和HeLa细胞的侵袭。Trnswell实验结果表明eEF1A2基因表达降低后宫颈癌细胞迁移能力降低。在不同的癌中,转移是恶性肿瘤的典型特征[9],转移性癌难于治疗,癌细胞转移过程包括局部浸润、血管内移植、血液循环转移、外渗和定植[10]。尽管宫颈癌诊断和治疗策略有所改善,但晚期宫颈癌患者的5年生存率仍然很低[11]。因此,全面了解影响宫颈癌侵袭和迁移的相关分子可能有助于发现宫颈癌患者的有效治疗方式。
eEF1A2蛋白质有利于肿瘤发生,对于很多人类肿瘤,eEF1A2因其异常表达而确定为癌基因。eEF1A2基因在癌症发展中发挥促增殖、抗凋亡和促转移的功能,eEF1A2在哺乳动物细胞中的表达增加了细胞的生长速度,促使细胞在软琼脂中生长,并增强细胞在异种移植瘤模型中的致瘤性[12]。eEF1A2在多发性骨髓瘤的某些病例中也高表达,有助于小鼠和人类浆细胞肿瘤的诱发[13]。eEF1A2基因作为不同癌的癌基因引起了研究者的关注[14]。2002年Anand等人证实在30%的卵巢肿瘤中eEF1A2基因高表达[15]。eEF1A2基因在正常人乳腺组织中几乎检测不到,但eEF1A2基因的表达在大多数乳腺肿瘤中明显上调,在60%的原发性乳腺肿瘤和转移灶中检测到高水平的eEF1A2表达,但在正常上皮中未检测到,eEF1A2的表达足以刺激BT549人乳腺癌细胞和未转化的Rat2细胞中膜蛋白的形成,在乳腺癌细胞系BT549中,eEF1A2表达大部分以PI3K和Akt依赖性方式刺激细胞迁移和侵袭,表明eEF1A2基因通过Akt和PI3K依赖性细胞骨架重塑来调节肿瘤发生[16],高表达eEF1A2基因可诱导乳腺癌细胞产生丝状伪足,增强其迁移和侵袭能力[17]。侵袭性和转移性是癌症死亡的主要原因,特别是在胰腺癌中显著,显示出惊人的高侵袭性和转移潜能,最近的一项研究表明,eEF1A2基因通过Akt活化上调MMP-9的表达促进了胰腺癌细胞的侵袭[18]。本研究发现eEF1A2基因在宫颈癌细胞中表达水平增高,与癌的增殖、侵袭和迁移相关,通过RNA干扰实验使eEF1A2基因表达水平降低,可以降低宫颈癌细胞的增殖、侵袭和迁移,提示eEF1A2基因可能作为一个潜在的靶标,用于宫颈癌的治疗。
