光诱导作用对木霉菌产孢量的影响研究
2020-06-30旷文丰毛伟力
旷文丰,糜 芳,陈 晨,毛伟力
(上海万力华生物科技有限公司,上海 200203)
为减少化学农药的使用,越来越多的微生物被用作生防制剂中的活性成分,在作物病虫害防治中发挥着重要作用[1]。在已经商业化生产和广泛使用的生防制剂中,生防真菌因具有广谱的生防作用、产量高、货架期长等特性,已成为除芽孢杆菌外应用最为广泛的生防制剂,如木霉菌(Trichodermaspp.)、白僵菌(Beauveriaspp.)、绿僵菌(Metarhizumspp.)等[2]。木霉菌是目前使用最广泛的一种微生物杀菌剂,可以通过重寄生、营养竞争、产酶、诱导植物抗性、代谢产物等多种途径防治植物的根部和叶部病害[3]。美国ABM公司和康奈尔大学研究发现,木霉菌能影响作物根系微生物菌群的变化,提高养分的吸收,稳定土壤养分,促进根系发育及根毛形成[4]。木霉菌在自然界的生长、繁殖和传播主要是通过3种菌体形态进行:菌丝、分生孢子和厚垣孢子,菌丝在脱水干燥时容易失活,分生孢子和厚垣孢子对外界环境更具耐受性。因此,在木霉菌生防制剂的工业化生产过程中,选用分生孢子或厚垣孢子作为其主要活性成分[5-7],而孢子主要是通过液体或固体发酵获得的[5]。通过优化发酵和后处理工艺最大限度地提高孢子产量,是提高木霉菌生防制剂产业化生产能力的重要策略[8]。提高木霉菌液体发酵的产孢量,除考虑培养基的营养成分、pH值、温度、转速、装液量和接种量等因素外[9-10],光照也是影响木霉菌生长发育和产孢能力的重要因素。研究[11]表明,光照可以促进木霉菌分生孢子的分化和形成,350~440 nm的可见光可以诱导绿色木霉分生孢子的形成。然而,研究光诱导作用对木霉菌产孢量的影响多集中在木霉菌固体发酵,有关光诱导作用对木霉菌液体发酵产孢量的影响鲜有报道。作者选择8株生防效果较好的木霉菌菌株为研究对象,测试白光(全光谱)、蓝光、红光、绿光对这8株菌株固体发酵和液体发酵产孢量的影响,以期为木霉菌生防制剂产业化研究提供新的思路与方法。
1 实验
1.1 光源
KW-T8ZW-7W型LED灯,宸华节能照明有限公司。通过数字照度计调节不同光源照度,不同光源的频段如图1所示,其中白光源(全光谱)为400~780 nm,蓝光源最强波长为460 nm、绿光源最强波长为515 nm、红光源最强波长为660 nm。
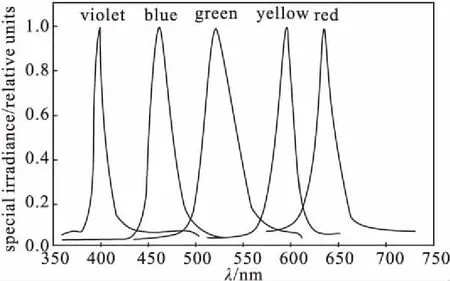
图1 不同光源的频段图Fig.1 Band of different light sources
1.2 仪器
SW-CJ-1CU型洁净工作台,苏州净化工作台设备有限公司;JA2003型电子天平,上海舜宇恒平科学仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;SY-3010B-2型发酵罐; KMC-1300V型涡旋振荡器,VISION;MCC-450BP型光照培养箱,上海一恒科学仪器有限公司;SKY-2112B型摇床;BX51型显微镜,Olympus;红光LED灯管;蓝光LED灯管;Testo 540型数字照度计,德国Testo;HSS3000智能型生物发酵工程系统(带插入式LED灯管),无锡汇森生物设备有限公司。
1.3 菌种与培养基
哈茨木霉(T.harzianum,Tr121,CGMCC5202)、橘绿木霉(T.citrinoviride,Tr673,CGMCC8723)、绿色木霉(T.virens,Tr34,CGMCC7.282)、长枝木霉(T.longibrachiatum,TL02,CGMCC7.280)、棘孢木霉(T.asperellum,Tr266B,CGMCC7.283)、拟康宁木霉(T.pseudokoningii,Tr25,CGMCC7.284)、毛簇木霉(T.velutinum,Tr1111B)、深绿木霉(T.atroviride,Tr775,CGMCC7.281)等均由上海万力华生物科技有限公司实验室分离、进行生理生化和分子遗传学鉴定后保存。
PDA培养基:200 g马铃薯切成小块,加水煮烂,纱布过滤,加热,加15 g琼脂,继续加热搅拌混匀,待琼脂完全溶解后,加入20 g葡萄糖,搅拌均匀,稍冷后用水补足至1 000 mL。
PDB培养基:200 g马铃薯切成小块,加水煮烂,纱布过滤,5 000 r·min-1离心10 min,取上清液,加入25 g葡萄糖,搅拌均匀,稍冷后用水补足至1 000 mL。
1.4 菌种活化
将保存于-40 ℃冰箱中的20%甘油菌种保存液取出,置于37 ℃恒温水浴锅中水浴2 min,摇匀,无菌吸取20 μL孢子悬液置于PDA培养基平皿中央,置于菌种培养箱中28 ℃、日光灯下培养144 h。
1.5 光诱导作用对木霉菌固体发酵产孢量的影响
1.5.1 不同光源的影响
用无菌打孔器自Tr121、Tr673、Tr34、TL02、Tr266B、Tr25、Tr1111B、Tr775菌落边缘打取直径5 mm的菌块,分别接种到同批次同体积的PDA培养基平皿中央,分别置于装有白光、蓝光、红光、绿光的培养箱中,以避光处理(平皿用两层锡箔纸完全包裹)为对照,各组均设6个重复。培养温度28 ℃,照度200 Lux。培养至36 h时,各组取出3个平皿,用十字交叉法测量菌落直径;培养至144 h时,取出剩余3个平皿,刮取平皿中孢子,重悬于10 mL 0.1%吐温-20溶液中,用血球计数法测定孢子量。
1.5.2 蓝光照度的影响
用无菌打孔器自Tr673、TL02、Tr25、Tr775菌落边缘打取直径5 mm的菌块,分别接种到同批次同体积的PDA培养基平皿中央,以避光处理为对照,每组设3个重复。置于蓝光(照度分别为500 Lux、200 Lux、100 Lux、50 Lux、25 Lux)培养箱中28 ℃培养144 h,按1.5.1方法测定孢子量。
1.5.3 蓝光光照时长的影响
用无菌打孔器自Tr673、TL02、Tr25、Tr775菌落边缘打取直径5 mm的菌块,分别接种到同批次同体积的PDA培养基平皿中央,用两层锡箔纸完全包裹,置于培养箱中避光培养,分别在培养12 h、24 h、36 h、48 h、72 h时,除去锡箔纸,将每个菌株的一组平皿置于100~200 Lux的蓝光培养箱中28 ℃培养至144 h,按1.5.1方法测定孢子量。各组设3个重复,对照组直接置于照度为100~200 Lux的蓝光培养箱中28 ℃培养。
1.6 光诱导作用对木霉菌液体发酵产孢量的影响
1.6.1 不同光源的影响
用无菌接种铲分别刮取Tr121、Tr673、Tr34、TL02、Tr266B、Tr25、Tr1111B、Tr775活化平皿中的孢子,置于50 mL无菌0.1%吐温-20溶液中,振荡分散成孢子悬液。吸取1 mL孢子悬液,接种于装有120 mL PDB培养基的摇瓶中;分别将摇瓶置于装有白光、蓝光、红光、绿光的摇床(为避免外界光源影响,用锡箔纸封闭摇床视窗和缝隙)中,照度100~200 Lux;将摇床置于封闭黑暗培养室中28 ℃、200 r·min-1培养144 h,用血球计数法测定孢子量。未安装LED灯的摇床作为对照,每组设3个重复。
1.6.2 蓝光对木霉菌液体发酵产孢量的影响
15L发酵罐中内置石英管,管中插入LED光源,使发酵液面的蓝光照度为100~200 Lux,发酵罐自动控制培养温度30 ℃、转速200 r·min-1、空气流量50 L·min-1、罐压0.002 MPa,自动记录pH值、DO值变化。用锡箔纸封闭发酵罐视窗,作为避光培养对照。
具体过程如下:刮取Tr673、TL02、Tr25、Tr775活化平皿中的孢子,置于装有500 mL无菌0.1%吐温-20溶液的补料瓶中,振荡分散成孢子悬液作为种子液。通过血球计数法计数,使种子液浓度达到2×107个·mL-1。15L发酵罐中PDB培养基为10 L,121 ℃灭菌15 min,待降至30 ℃后,将种子液经火焰口无菌接入发酵罐内,培养144 h,期间每隔8~12 h无菌取样1次,用血球计数法测定孢子量,采用DNS法测定发酵液中还原糖含量[12],按细胞干重法计算生物量(g·mL-1)[6]:

2 结果与讨论
2.1 不同光源对木霉菌固体和液体发酵产孢量的影响
在避光及光照(白光、蓝光、红光、绿光)条件下,菌株Tr121、Tr673、Tr34、TL02、Tr266B、Tr25、Tr1111B、Tr775在PDA培养基上固体发酵的菌落形态见图2,菌落直径见图3。

图2 不同光照条件下各菌株在PDA培养基上生长的菌落形态Fig.2 Colony morphology of eight strains growing on PDA medium under different light conditions

注:相同菌种柱状图上不同小写字母表示相互之间差异显著(P≤0.05)
从图3可知,各种光源对菌株Tr673、Tr34、TL02的菌落直径无显著影响;相对于避光处理,光照培养可显著增大菌株Tr121、Tr266B、Tr25、Tr1111B、Tr775的菌落直径。
在避光及光照(白光、蓝光、红光、绿光)条件下,菌株Tr121、Tr673、Tr34、TL02、Tr266B、Tr25、Tr1111B、Tr775固体发酵和液体发酵的产孢量见表1。
从表1可知:(1)固体发酵时,菌株Tr673、TL02、Tr25、Tr775在避光处理下的产孢量显著低于200 Lux白光和蓝光照射下的产孢量(P≤0.01);菌株Tr673在绿光照射下的产孢量显著高于在避光处理和红光照射下的产孢量(P≤0.01),但显著低于在白光和蓝光照射下的产孢量(P≤0.01);菌株Tr121、Tr34、Tr266B、Tr1111B在避光处理和光照条件下的产孢量无显著差异。(2)液体发酵时,菌株Tr673、TL02、Tr25、Tr775在100~200 Lux白光和蓝光照射下的产孢量显著高于在避光处理和其它光照条件下的产孢量(P≤0.01);菌株Tr121、Tr34、Tr266B、Tr1111B在不同光照条件下的产孢量无显著差异。
表1 不同光照条件下各菌株固体发酵和液体发酵的产孢量
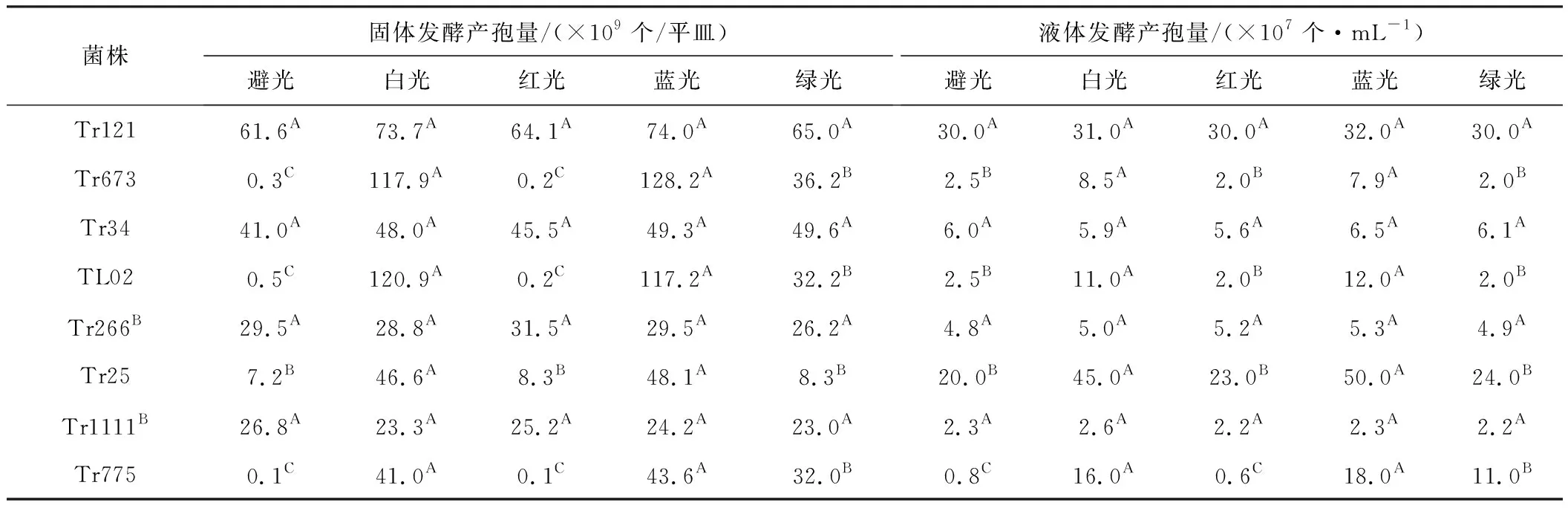
Tab.1 Spore production of eight strains by solid and liquid fermentation under different light conditions
注:同行不同大写字母表示相互之间差异极显著(P≤0.01)。
2.2 蓝光对木霉菌固体发酵产孢量的影响
蓝光照度和光照时长对菌株Tr673、TL02、Tr25、Tr775固体发酵产孢量的影响见表2。
从表2可知,菌株Tr673、TL02、Tr25、Tr775在25 Lux微量的蓝光照射下就能通过固态发酵产生分生孢子;菌株Tr673、TL02、Tr25在50~200 Lux蓝光照射下的产孢量显著高于在避光处理和25 Lux、500 Lux蓝光照射下的产孢量(P≤0.01);持续蓝光照射可以显著提高菌株Tr673、TL02、Tr25、Tr775固态发酵产孢量(P≤0.01);当菌株避光处理超过36 h后再进行蓝光照射,其产孢量显著低于在36 h前就开始蓝光照射时的产孢量(P≤0.01)。
2.3 蓝光对木霉菌液体发酵产孢量的影响
在避光处理和蓝光照射下,菌株Tr673、TL02、Tr25、Tr775在15L发酵罐中液体发酵曲线如图4所示。
从图4可知,仅菌株Tr25在避光处理和蓝光照射下的产孢量没有差异,菌株Tr673、TL02、Tr775在蓝光照射下的产孢量数倍高于避光处理的产孢量;菌株Tr673、TL02、Tr25、Tr775均在生物量达到最高点且还原糖降至低点后方开始产孢,伴随着产孢的过程,生物量逐步下降,待产孢恒定后生物量和还原糖趋于稳定值;蓝光照射对生长较快的菌株Tr673、TL02的糖代谢速率没有明显影响,但是可以加快菌株Tr25、Tr775的糖消耗过程,产孢在还原糖处于低值时出现,产孢完成后糖不再消耗;蓝光照射可以加速菌株Tr673、TL02、Tr25、Tr775生物量的累积,在生物量累积到最高值时只有菌丝无孢子或仅有少量孢子产生,随后随着生物量的下降,分生孢子产生,产孢完成后,生物量处于稳定状态;蓝光照射可以促使菌株Tr673、TL02、Tr25、Tr775产孢时间较避光处理提前,能较快达到产孢恒定状态;蓝光照射的最终生物量和残糖量都略高于避光处理。
表2 蓝光照度和光照时长对木霉菌固体发酵产孢量的影响/(×109个/平皿)
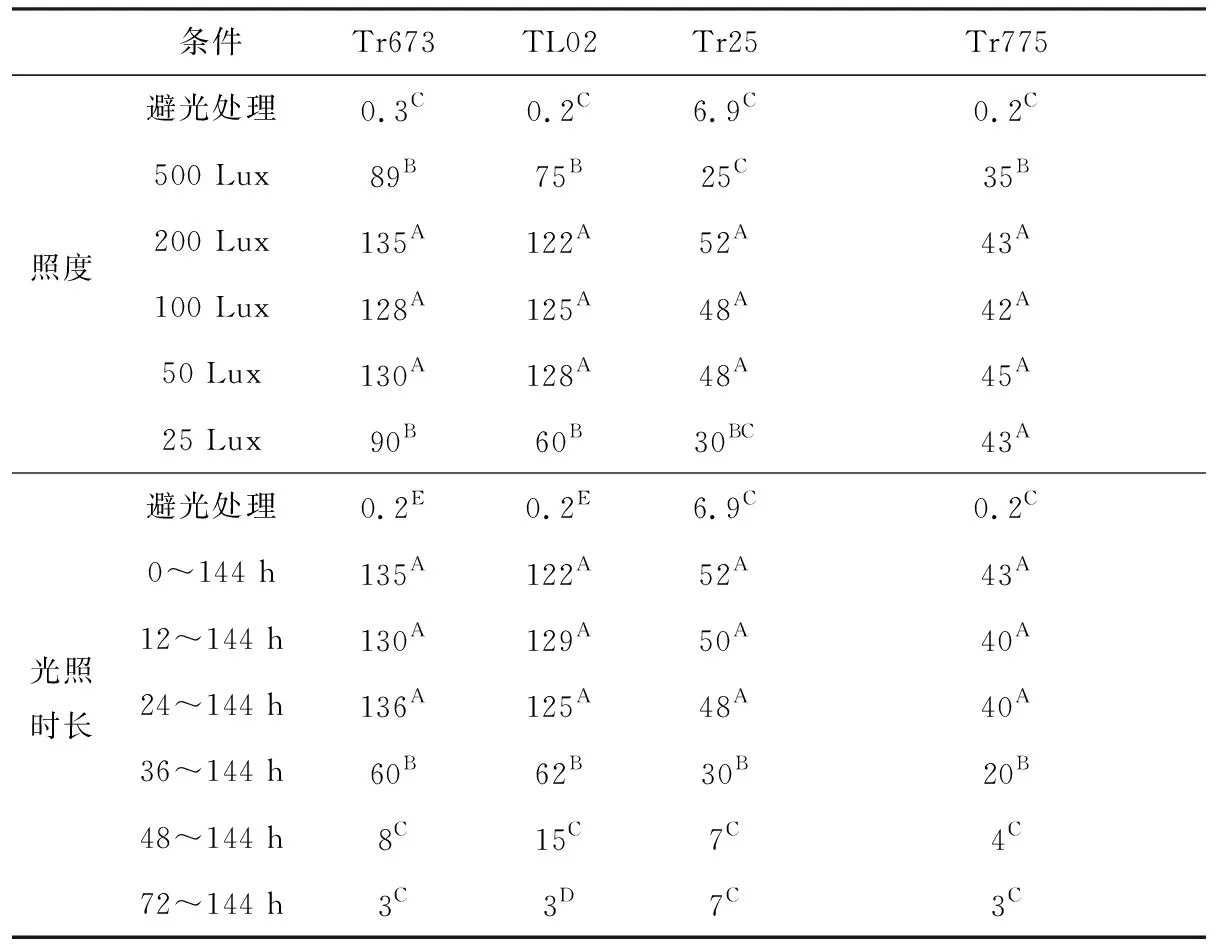
Tab.2 Effect of blue light intensity and irradiation time on spore production of Trichoderma spp. by solid fermentation/(×109 spore per plate)
注:同列不同大写字母表示相互之间差异极显著(P≤0.01)。
2.4 讨论
本研究通过平皿培养实验证明,3种单色光源中只有蓝光可以诱导Tr673、TL02、Tr25、Tr775产生分生孢子,该结果与Betina等[13]对绿色木霉产孢研究结果相同:光诱导产孢的最有效光源为380~500 nm的蓝光。本研究发现,木霉菌小种之间对不同光源的反应存在一定的差异性,不同光源对Tr121、Tr775、TL02、Tr25在PDA培养基上的生长影响显著,从而印证了段庆虎等[14]的推断:光质对真菌的生长发育有调控作用,真菌对光质有选择性,最佳光质因种类而定。本研究发现,Tr673、Tr775在避光处理超过36 h后,无法通过光诱导产生孢子,Tr25产孢量显著下降,这与Gutter[15]的研究结论相同:绿色木霉在黑暗条件下培养超过48 h后,无法通过光诱导产生孢子。本研究结果表明,蓝光对木霉菌的孢子诱导是一个非常敏感的过程,低照度50~200 Lux的蓝光能诱导Tr673、TL02、Tr25、Tr775在PDA培养基中产生分生孢子;而当照度为500 Lux时,Tr673、TL02、Tr25、Tr775的产孢被显著抑制;高照度的近紫外区的蓝光会对真菌造成损伤,从而抑制了产孢过程[16]。
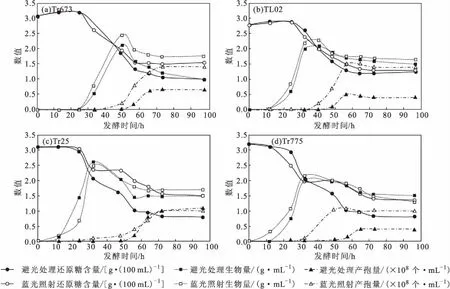
图4 在避光处理和蓝光照射下,菌株Tr673、TL02、Tr25、Tr775的液体发酵曲线Fig.4 Liquid fermentation curves of Tr673,TL02,Tr25,and Tr775 under conditions of dark and blue light irradiation
本研究通过摇瓶培养实验表明,蓝光可以诱导Tr673、TL02、Tr25、Tr775产生大量分生孢子,这个结果与平皿实验结果相一致。在15L发酵罐的深层液体培养中,得到了与摇瓶发酵近似的结果。只有Tr25在深层液体发酵时产孢时间提前,产孢量与避光处理相同,有可能是因为搅拌桨的剪切力对Tr25的菌丝造成损伤,触发了新的产孢诱导过程[17-18];同时表明,Tr25在深层液体发酵中可以通过机械损伤和营养饥饿协同作用诱导孢子生成而不依赖于光诱导作用。 Chovanec等[19]和Friedl等[20]对深绿木霉和绿色木霉的产孢研究也表明,光诱导和营养诱导对两种木霉菌产孢有着交互的影响,碳源被认为是光诱导产孢和营养饥饿诱导产孢的主要因素。营养饥饿诱导产孢是深层液体发酵中孢子产生的重要途径。本研究结果表明,木霉菌液体发酵产孢过程发生在生物量达到最高点而碳源急速下降之后。
木霉菌的固体发酵和液体发酵的产孢途径和产孢机理不同。木霉菌固体发酵的产孢途径是孢子萌发10 h后,菌丝特化现象明显,形成气生菌丝,部分气生菌丝分化形成分生孢子梗最后形成分生孢子[21];木霉菌液体发酵的产孢途径主要为营养菌丝直接断裂产生孢子、分生孢子囊破裂产生孢子、微循环产孢产生孢子[22]。本研究结果表明,在液体发酵产孢中,分生孢子的产生同样受到蓝光和饥饿诱导的调控。在大规模工业化生产中,可以通过增加低照度蓝光诱导的方式提高橘绿木霉、长枝木霉、深绿木霉的产孢量,缩短产孢发酵周期,达到降低成本的目的。
3 结论
通过平皿培养和摇瓶培养,对比研究了避光处理和不同光照条件对8株木霉菌菌株产孢量的影响。结果显示,在固体发酵条件下,50~200 Lux蓝光照射能显著提高菌株Tr673、TL02、Tr25、Tr775的产孢量(P≤0.01);将菌株避光处理36 h后再进行蓝光照射,其产孢量较持续光照的显著降低(P≤0.01)。在液体发酵条件下,菌株Tr673、TL02、Tr25、Tr775在100~200 Lux白光或蓝光照射下的产孢量较避光处理提高数倍(P≤0.01),较其它光源照射提高2~8倍;通过15L发酵罐进行深层发酵发现,100~200 Lux蓝光照射较避光处理能显著提高Tr673、TL02、Tr775的产孢量(P≤0.01),但对Tr25的产孢量增加不明显。
