低分子肝素的制备技术及临床应用进展
2020-06-24侯德坤李书胜巩腾飞
侯德坤,李书胜,巩腾飞
(1.威海市产品质量监督检验所,山东 威海 264210;2.威海市食品药品检验检测中心,山东 威海 264210)
低分子肝素(Low molecular weight heparins,LMWHs)是20世纪80年代在研究未分级肝素(Unfrationated Heparin,UFH)分子构效时发现的,为一组分子量不均一的硫酸多糖混合物,分子量一般为3000~8000道尔顿。英国药典和欧洲药典规定LMWHs的重均分子量不得大于8000道尔顿,多数产品平均分子量约为5000道尔顿[1]。LMWHs与UFH的性质有所不同,这主要与其分子量分布有关。近年来随着对LMWHs研究的不断深入,低分子肝素的优点不断显现出来: 抗FXa活性高,抗血栓作用强,抗FIIa活性低,出血副作用低[2-3];在动物研究中有较为合适的利弊比率,皮下注射吸收好,半衰期长,生物利用度高[4-5];具有较好的药物代谢动力学的性质,不与血小板结合,具有更为稳定的量效关系[6-11],引起了研究者的极大兴趣。
目前,LMWHs的临床应用不断扩大,成功用于防治深部静脉血栓(Deep Venous Thrombosis,DVT)、血液透析(Hemodialysis,HD)、心脏手术体外循环(Cardiopulmonary Bypass,CPB)和肝素诱导的血小板减少症(Heparin-Induced Thrombocytopenia,HIT),治疗播散性血管内凝血(Diffuse Intravascular Coagulation,DIC)、静脉炎症综合症、心肌梗塞及引起的局部缺血性疾病、放疗引起的血液高凝状态等[12]。因此低分子肝素的研究与开发制备越来越受到重视,成为国内外专家研究的热点。
1 LMWHs制备技术的研究进展
低分子肝素的制备方法有多种,不同的制备方法得到的LMWHs生物功能和分子量也有差异(表1[13-18])。LMWHs的制备方法主要是物理降解、化学裂解和化学合成三种方法[13,19],目前采用最多的是化学裂解法。

表1 部分LMWHs的制备方法和主要特点
1.1 物理分离法
物理分离是一种高效、绿色的分离方法,操作简单,可控性好。其中研究较多的是超声波法。超声波是一种弹性机械波,利用机械性断键作用和自由基氧化还原反应来降解大分子化合物,常用于多糖的降解研究。陈胜军等[20]利用超声波辅助酶解法提取罗非鱼眼透明质酸,分析了超声波功率、超声处理时间等对透明质酸提取的影响,得出高超声频率是对降解影响的主要因素。张翠玲等[21]利用超声波辅助木瓜蛋白酶降解壳聚糖,通过正交试验得出了超声波功率是影响降解反应的重要条件。
此外,物理分离法还包括层析法、凝胶色谱法、超滤法等,其中以层析分离法最为重要。凝胶过滤层析(gel filtration chromatography,GFC)是利用具有网状结构的凝胶的分子筛效应来分离不同分子量大小LMWHs的一种方法,最常用是葡聚糖凝胶,该方法常配合其他方法使用[22]。离子交换层析法(ion-exchange chromatography,IEC) 是通过DETE-纤维素等阴离子交换剂与UFH上的负电荷离子根据交换时的结合力大小不同而将LMWHs分离出来。物理分离法制备LMWHs所用的原料一般是UFH或未分级肝素经过裂解后的初级产物。通常UFH中低分子片段的含量较低,仅为1%~2%,因此利用物理分离方法制备LMWHs时产率较低,但物理分离不破坏LMWHs的原有结构,生物活性较高,适用于LMWHs结构测定和生物活性研究。
1.2 化学裂解法
化学裂解法包括亚硝酸盐降解法[23]、过氧化氢降解法[24]、β-消除降解法[25]、臭氧解聚法、光化学解聚法等和酶降解法[26]。化学降解法具有生产工艺简单、成本低、质量易控等优点,常用于工业生产。但化学降解会改变肝素的易原有结构,有些降解反应发生在生物活性点位,影响了肝素的抗栓活性。不同的降解反应得到的LMWHs末端结构不同,产物的生物功能也有所不同。
1.2.1 亚硝酸控制降解法
亚硝酸控制解聚法制备低分子肝素的生产工艺如图1所示。其制备机理是在酸性环境下,亚硝酸与UFH中的N-硫酸葡糖胺反应生成-NH2,-NH2与亚硝酸发生重氮化反应,使糖苷键断裂,缩环生成2,5-脱氢甘露糖或脱氢甘露糖醇[27]。在制备过程中,亚硝酸浓度、pH 值、温度和反应时间等因素都会影响LMWHs 的分子量。亚硝酸浓度太低会导致肝素解聚不充分,浓度过高又会导致肝素在不适宜的位置断裂,结构发生变化。通常亚硝酸的用量依赖于LMWHs的分子量,可在0.01%~1.0%范围内调整[23]。反应温度应控制在-5~30℃范围内,温度过低,反应溶液会发生凝固,导致反应时间过长;温度过高,则会导致亚硝酸分解,破坏LMWHs。溶液酸碱度与反应时间有较大关系,反应时间随pH值降低逐渐减少,当pH值 为2.5时反应最短,因此溶液pH值应控制在2.5左右。张万忠等[28]以猪肠粘膜肝素钠为原料,通过亚硝酸降解、凝胶色谱柱分离,制备了9组分子量在4000~8000 道尔顿之间的LMWHs。杨立波等[29]以肝素生产的副产品-低抗凝肝素为原料,经亚硝酸降解制备和凝胶层析分离低分子肝素,抗凝效价为30.33U/mg,平均分子量为5200道尔顿,其氨基葡萄糖、己糖醛酸、总硫酸基的含量及特性粘度均低于低抗凝肝素,氮、磷含量及炽灼残渣则无明显差异。张丽萍等[30]以肝素为原料,利用亚硝酸盐降解法,通过单因子实验和二次旋转回归组合实验,对亚硝酸降解法制备LMWH的工艺参数进行了优化,得出在pH值2.6、反应温度25℃、亚硝酸浓度为0.6%、反应时间为4h时,得到LMWHs的相对分子量小于8000道尔顿的成分含量达到89.95%。
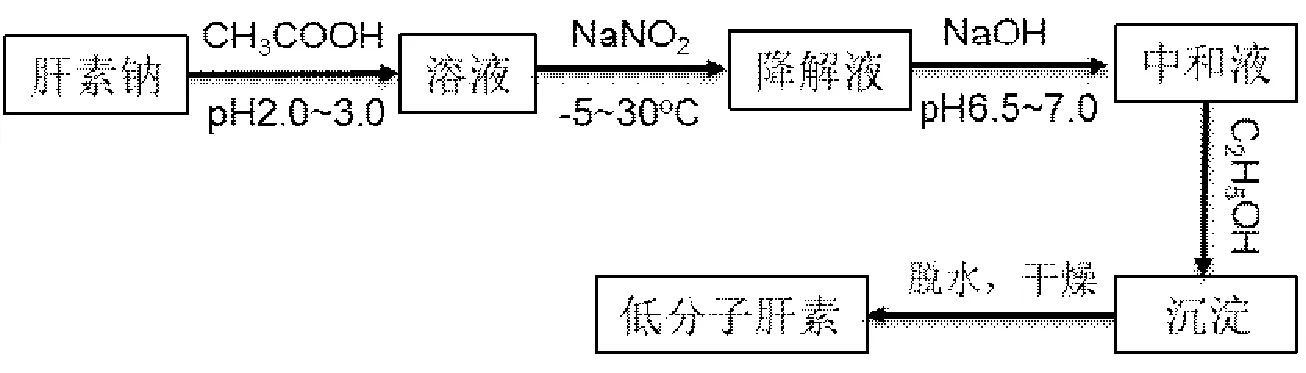
图1 亚硝酸解聚法制取低分子肝素工艺流程图
1.2.2 过氧化氢降解法
过氧化氢降解法制备LMWHs的生产工艺如图2所示。从反应机理上看,过氧化氢解聚法属于氧化解聚,因反应产物无残留,易处理,成本低,是研究较多一种解聚UFH和Hepariosan等多糖的方法。过氧化物含有化学反应性极强的不配对电子氧自由基,它能使肝素分子中非硫酸化糖醛酸C2、C3之间的化学键断裂,生成相对分子量较小的LMWHs片段[23,31];有些还原糖需要在金属催化剂存在或碱性条件下,才能被自由基解聚。过氧化氢解聚法主要特点是生成的LMWHs产物的硫酸化程度较高,实际生产成本低。Bianchini[24]用抗坏血酸、乙酸铜及3%的过氧化氢成功地对肝素进行降解,采用加入EDTA的方法去除残留的铜离子,得到平均分子量为3946道尔顿的LMWHs,产率达到了88%。李良玉等[32]以精品肝素为原料,利用超声波结合过氧化氢制备低分子肝素,在超声时间76min、超声功率405W、过氧化氢含量5.8%、超声温度61℃条件下得到了平均分子量为3900±50道尔顿的LMWHs。刘冬[33]利用过氧化氢降解与GPC色谱相结合的方法来制备分离LMWHs,在过氧化氢浓度2%、pH值7.0、温度60℃条件下,反应1 h,得到LMWH产物重均分子量为3773D,分子量大于8000D的组分仅占2.1%。

图2 过氧化氢降解法制取低分子肝素工艺流程图
1.2.3 化学β-消除降解法
β-消除降解法主要包括肝素季铵化和降解两步处理。肝素分子中糖醛酸的酯化反应增强了α-H的酸度,使其在溶液中与亲和基团更易发生β-消除反应;肝素分子中的季铵盐和烷基卤在二氯甲烷或二甲基甲酰胺存在的情况下,发生酯化反应生成肝素酯,在碱性条件下水解生成LMWHs。利用该方法制备LWMH时,如在非水介质中进行,降解点位不在肝素活性部位,也不发生脱硫反应。有研究指出[34],在氯苯和碱存在条件下,肝素的季铵盐可加热生成肝素苄酯,温度为20~80℃时,肝素苄酯可形成不饱和糖醛酸。
1.2.4 臭氧解聚法及光化学解聚法
有研究发现臭氧既可解聚Heparosan 和普通肝素,又可消除Heparosan和LMWHs的糖醛酸残基[35-36]。比如,臭氧分解的洛集帕林、依诺肝素及Heparosan的多糖和寡糖都消除了非还原性末端的不饱和糖醛酸。1H-NMR检测发现:多糖用臭氧处理过以后,除了不饱和糖醛酸的C4-C5双键被破坏以外,其他结构没有发生改变。Higashi等[37]利用TiO2催化光化学反应解聚Heparosan,成功将Heparosan 从15000D解聚成8000D左右。1H-NMR检测证明,光化学解聚Heparosan是一个随机过程,可发生在Heparosan多糖中的葡萄糖醛酸或N-乙酰胺残基,且解聚前后结构无变化。Higashi等[37]进一步研究利用TiO2催化光化学反应解聚肝素,发现使用硼硅玻璃灯过滤器可以解聚肝素,并能显著降低解聚过程中的造成的硫酸化基团的丢失。
1.2.5 其他制备LMWHs的化学降解法
除以上几种化学降解方法可以制备LMWHs外,其他化学降解的方法还有次氯酸降解法[38]、高碘酸降解法[39]、γ-照射和硫酸-氯磺酸降解法[40]及酶法降解法等。高碘酸降解肝素最初是用于分析肝素化学结构,后逐步用于LMWHs的制备。次氯酸产生的氧原子可使肝素中的糖苷键断裂,降解生成LMWHs。采用硫酸-氯磺酸降解法制备的LMWHs分子量在2000D~9000D之间,但LMWHs的硫酸化程度较高,约为原料肝素的1.2倍。这三种制备 LMWHs 方法的机理与过氧化氢降解法制备 LMWHs 的机理相似,都是利用生成的氧自由基使肝素中非硫酸化糖醛酸的C2和C3键断裂,进一步作用生成LMWHs。
酶解法是通过利用能特异性裂解肝素和类肝素主链糖苷键的肝素酶来制备LMWHs的一种方法[41]。肝素酶是一类能降解肝素类物质的裂解酶,最初从肝素黄杆菌(Flavobacterium heparinum)发现并分离,后在一些其他的微生物和真核生物中也有发现,比如拟杆菌属、棒杆菌属、芽孢杆菌属等,但肝素黄杆菌是商品肝素酶的唯一来源。任重等[42]利用肝素黄杆菌固定化细胞裂解大分子肝素制备LMWHs,得到了相对分子质量为5000D左右的LMWHs,活性也较好。
1.3 合成法
利用化学合成法制备LMWHs,首要步骤是合成类似于天然肝素分子的戊糖序列骨架结构,随后再合成其他的寡糖并在体外测试其生物活性,证明合成的肝素比普通肝素具备更好的抗血栓疗效和更低的出血倾向[43]。但纯化学合成法人工合成肝素,成本较高,合成步骤繁琐,成本昂贵,产出率较低,不适于市场化。化学酶合成法是近些年发展的一种利用化学酶催化、化学合成相结合来制备低分子肝素的新方法,具备选择性高、特异性强、合成产率高等优点。徐咏梅等[44]报道了一种利用化学酶法合成两种结构确定的超低分子量肝素的方法,以简单的二糖为原料,借助糖基转移酶和硫酸根转移酶催化方法,将天然葡糖胺、葡糖醛酸及硫酸根有机“结合”,合成了分子量为1778.5和1816.5道尔顿的超低分子量肝素,产率分别达到了45%和37%,而且这两种超低分子量肝素具有与Arixtra肝素相当的抗凝活性及药代动力学特性。张成盈[45]以对硝基苯-β-D-葡萄糖醛酸苷为原料,以糖基转移酶KFiA或PmHS2的催化下,得到纯度高于90%的寡糖骨架,以PAPS为硫酸基供体,有N-硫酸基转移酶(NST)催化合成N-硫酸化肝素寡糖,得到两种肝素寡糖产率分别为40%和80%,纯度均高达92%以上。Wang 等[46]研究了化学酶法合成肝素过程中,最关键步骤是Heparosan 的N-去乙酰化,N-去乙酰的程度直接影响到肝素中N-乙酰/N-磺酸的比例及合成肝素的分子量。因此在化学酶合成肝素的过程中,控制好N-去乙酰化的程度能直接改进合成产物的性能。
综上,不同的制备方法有各自的优缺点。物理分离法制备LMWHs,操作过程简单,分离纯化容易,但产量有限,可适用于实验室研究,不适合规模生产。光化学解聚法制备LMWHs,能保持解聚样品的内部结构不变,显著降低解聚反应时丢失硫酸基团,进而更好的保持肝素的抗凝血活性。化学酶合成法的合成过程简单,容易控制,合成的产品药理特征与动物来源相当,利于大规模生产。因此,目前乃至今后较为理想的制备LMWHs方法是光化学解聚和化学酶合成法
2 LMWHs在临床上的应用
2.1 预防和治疗血栓性疾病
血栓性疾病分为静脉血栓和动脉血栓二类。静脉血栓栓塞临床上包括深部静脉血栓(deep vein thrombosis,DVT)和肺栓塞(pulmonary embolism,PE)。DVT形成系血液在深静脉内不正常凝结,属静脉回流障碍性疾病。因其可继发远期下肢深静脉功能不全和致命性的肺栓塞、脑栓塞,被公认为是一种严重的术后并发症。何俊等[47]比较了UFH和LMWHs对抑制全髋或全膝关节置换术后出血及静脉血栓有效性与安全性,结果显示LMWHs在治疗中具有优越性,疗效确切。目前,以依诺肝素为代表的LMWHs已成为一种主要的静脉血栓栓塞治疗药物,在深静脉血栓发生率、患者的死亡率及血栓复发率等事件发生率上明显低于肝素[48]。一项入选了1362例患者的对照研究表明,在恶性肿瘤化疗中使用依诺肝素的观察者在深静脉血栓发生率上明显低于对照组[49]。LMWHs 对于腰椎退行性疾病患者尤其适用[50],对于这类患者,LMWHs的抗凝治疗可以显著降低DVT发生,具有良好的安全性。
2.2 防治心脑血管疾病
对于急性冠状动脉综合症(acute coronary syndrome,ACS)患者,内科治疗药物是阿司匹林、氯吡格雷、血小板糖蛋白IIb/IIIa受体拮抗剂,以UFH和LMWHs辅助治疗。James等[51]临床研究发现阿昔单抗联合LMWHs治疗ACS的副作用发生率低于阿昔单抗联合UFH治疗,二者的安全性相同。与普通肝素相比,LMWHs能更有效地减少不稳定性冠状动脉综合症病人发生死亡、心力衰竭或复发性心绞痛等严重后果[52-55],这与LMWHs具有生物利用度高,血小板减少症发生率低,可以皮下给药优点有关。Gurfinkel 等[56]发现,ACS患者皮下注射LMWHs制剂Enoxaparin与静脉输注UFH相比,Enoxaparin明显具有高抗FXa活性。 此外,经皮冠状动脉介入(pereatoneous coronary intervention,PCI)术后使用LMWHs可降低心脏事件发生,预防PCI术后亚急性血栓形成,改善心肌缺血,且出血并发症少。兰丹[57]对比了低分子肝素对147例常见各类心脑血管疾病患者的临床疗效,试验组显效率和总有效率达到61.84%和96.05%,效果明显好于对照组。一项研究把74例非急诊介入治疗患者随机分为普通肝素对照组(125U/kg)、依诺肝素1.0mg/kg试验组进行治疗临床试验,结果依诺肝素组术中有效抗凝达标率为90.6%[58]。
中老年人脑梗死发病率约占全部急性脑血管病的50%~60%,主要发病原因是动脉缺乏弹性导致粥样硬化、感染性大动脉炎和多发性大动脉炎等。宋绍斌等[59]探讨了低分子肝素治疗脑梗死的疗效及对凝血功能的影响,将112例患者随机分为治疗组和对照组,对照组采用常规治疗,治疗组在常规治疗的基础上加用低分子肝素5000U,结果发现治疗组总有效率达到87.5%,比对照组高12.3%,表明LMWHs治疗急性脑梗死起效快,疗效好。由于LMWHs对血小板及凝血酶原时间影响较小,在治疗过程中未发生颅内出血及其他脏器出血等副作用和不良反应。
2.3 LMWHs的抗炎作用
上世纪八十年代一些学者发现,肝素除了抗凝作用外还具有抗炎作用。韩红等[60]实验表明LMWHs的抗炎作用一方面可能通过抗凝途径的介导而发挥作用,另一方面通过下调炎症介质IL-8、TNFa的表达实现。张园[61]指出低分子肝素在子痫前期样孕鼠模型应用后,发现可以减少Th1型促炎细胞因子IL-2及INF-γ,增加抗炎细胞因子IL-10的分泌,从而发挥了抗炎作用。于萍[62]将96名患有难治性溃疡性结肠炎的病例随机分为2组,对照组接受常规治疗,观察组在常规方法基础上加以低分子肝素治疗。结果观察组患者治疗总有效率97.92%,比对照组高18.75%,表明低分子肝素在治疗难治性溃疡性结肠炎时效果明显。Ceccarelli 等[63]建立卡拉胶诱发胸腺炎大鼠模型,发现给予LMWHs治疗的胸膜炎大鼠IL-1、TNFa等促炎因子明显减少,认为LMWHs具有明显的抗炎作用。Civelek 等[64]则将LMWHs应用于切口愈合大鼠模型,发现LMWHs可以抑制因巨噬细胞浸润和组织水肿导致的早期炎症反应,有利于切口愈合,表明对于术后使用LMWHs不仅具有预防深静脉血栓形成,还可能抑制切口炎症反应,促进手术切口愈合。
2.4 在肾脏病中的应用
治疗急慢性肾衰竭有效方法之一是血液透析(hemodialysis,HD),但在血液透析中长期使用UFH抗凝,会引起组织中脂蛋白酶减少、血清脂活性降低,导致高血脂症;还会抑制成骨细胞,导致骨质疏松。而采用LMWHs抗凝血液透析,输血量少,对血小板影响小,出凝血时间恢复快,比UFH更适合有出血倾向的患者。曹磊等[65]对100例急性肾功能衰竭者在血液透析中应用LMWHs抗凝,结果显示研究组患者无出血、穿刺点压迫止血时间7.43±1.25min;参照组患者有4例出血,穿刺点压迫止血时间(12.64±1.56)min。表明低分子肝素应用于急性肾功能衰竭患者血液透析效果明显,可有效防止血液凝固。
2.5 其他应用
根据文献报道,LMWHs还对呼吸系统疾病[66-68]、妊娠高血压[69-70]、肿瘤患者[71]、癌症手术后血栓[72]、新生儿硬肿症[73]、胎儿生长受限[74]等疾病的治疗也有一定效果。
3 展望
近年来,随着对LMWHs的药理学越来越深入,其在临床上的应用范围也日趋扩大。多项研究证明,LMWHs已取代UFH成为急性冠脉综合征的首选抗凝药物,但目前LMWHs给药途径大部分为皮下注射,且有皮下注射LMWHs的不良反应的报道。另外LMWHs和UFH存在同样的缺点,停药后会出现血栓复发,联合其他药物治疗已成为近年来许多学者研究的重点和热点。此外,在LMWHs的基础上制备超低分子肝素也是近年来的发展趋势,开发和研制分布均一、具有理想分子量的低分子肝素和超低分子量肝素,发展前景广阔。
