高密度脂蛋白与系统性红斑狼疮关系的研究进展
2020-06-24严巧巧狄亚珍
严巧巧 狄亚珍
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种高度异质性的自身免疫性疾病,以各种自身抗体的产生为特征,并可发展为免疫系统失调和全身多脏器系统损伤。近几十年来,随着诊治水平的提高,SLE患者早期病死率下降[1],但与一般人群相比,其缺血性心脏病患病风险率仍增加了10倍,而处于生育年龄的年轻女性心血管疾病(cardiovascular disease,CVD)风险增加了近50倍[2]。据统计CVD造成SLE患者晚期死亡的病死率占总病死率的1/3以上[3],可见CVD对SLE患者依旧是一个重大的威胁。
高密度脂蛋白(high-density lipoprotein,HDL)是所有脂蛋白中相对密度最高、体积最小的脂蛋白,有介导胆固醇外流、抑制脂质氧化、抗感染、抗血栓、抗细胞凋亡和保护内皮细胞等作用。HDL水平降低与CVD风险增加相关。SLE患者氧化应激和慢性炎性等反应导致HDL颗粒大小、蛋白质组学及脂质组学发生变化,进而引起上述作用减弱,导致SLE患者CVD的发生和发展。本文就HDL与SLE之间关系的研究进展作一综述。
1 HDL的结构
HDL主要是由肝脏和小肠产生的一种血浆脂蛋白,通过与其他脂蛋白、酶的相互作用以及与靶细胞的接触在血液中不断被重塑。其内层为疏水性脂质核心,主要由胆固醇酯和三酰甘油构成;外层为亲水的极性层,包括磷脂、游离胆固醇、载脂蛋白和一些活性酶类,其中脂质和蛋白质部分几乎各占一半。蛋白成分可分为载脂蛋白、酶类、脂质转移蛋白、急性期反应蛋白、补体成分、蛋白酶抑制剂和其他蛋白质7大类,载脂蛋白AⅠ(apolipoprotein A-Ⅰ,apoA-Ⅰ)是最主要的载脂蛋白,脂质部分则以磷脂为主。不同HDL颗粒间因蛋白质和脂质等含量的差异而具有高度异质性。另外,HDL可以用不同的技术划分不同的亚群[4],经非变性聚丙烯酰胺梯度凝胶电泳法(non-denaturing gradient gel electrophoresis,Native-PAGE)将 HDL 分为 HDL2a、HDL2b、HDL3a、HDL3b及HDL3c 5型,而经双向电泳法(twodimensional electrophoresis,2-DE) 将 HDL 分为 α-1HDL、α-2HDL、α-3HDL、α-4HDL、pre-β-1HDL 5 型。为了便于各项研究结果的分析比较,Rosenson等[5]依据颗粒密度和大小提出新的命名方法,将HDL分为极大颗粒、大颗粒、中等颗粒、小颗粒及极小颗粒5个亚型。近年来利用核磁共振(nuclear magnetic resonance,NMR)技术已经确定了26种HDL亚群,但由于测量精度有限,它们被简单描述为小颗粒、中颗粒、大颗粒。
2 SLE患者HDL结构的变化
2.1 SLE患者血脂代谢异常 大部分研究结果表明,SLE患者的极低密度脂蛋白(very-low-density lipoprotein,VLDL)、低密度脂蛋白(LDL)水平升高,而 HDL 水平降低,目前被描述为“狼疮谱”[6]。低HDL-胆固醇(HDL-C)是SLE患者(包括儿童)最常见的血脂异常指标之一。一项包含546例不同种族SLE患者的研究中发现,81%的患者 HDL-C 水平较低(<35mg/dl)[7],另一项针对埃及221例SLE患者的研究中发现45%的患者HDL-C水平较低(<40mg/dl)[8],该两项研究均提示对照组与空白组的HDL-C水平无统计学差异,推测是由于患者群体的差异。但值得注意的是,HDL-C作为临床常规实验室指标,越来越多学者认为其与HDL颗粒的数量并不完全相关。因此,更多研究通过免疫组化方法测量apoA-Ⅰ浓度从而来测定HDL水平,发现相对于健康对照组,SLE患者apoA-Ⅰ水平较低[9]。Purmalek等[10]进一步通过NMR方法直接测量HDL粒子数发现SLE患者HDL颗粒数显著减少,疾病活动期颗粒数水平更低。研究发现在SLE患者血清中HDL重要的抗氧化组分-对氧磷酶 1(paraoxonase 1,PON1)活性降低[11]。药物应用方面,强的松及羟氯喹的使用与HDL-C升高相关,但目前还没有研究发现他汀类药物能改变SLE患者HDL-C水平[12]。
2.2 SLE患者HDL颗粒大小变化 相较于健康人群,SLE患者血清中有不同亚型、不同颗粒大小的HDL,且不同患者炎症反应、用药差异均会影响HDL亚型分布。此外,因描述HDL分型的分析方法不同,阻碍了各个研究之间结果的比较。Hua等[13]报道SLE患者中小颗粒HDL含量较低,总体HDL水平较健康对照组高,而Chung等[14]报道SLE患者大颗粒HDL含量较低,总体HDL水平与健康对照组无明显差异,其他另有研究认为SLE患者与健康对照组在HDL颗粒大小上并无明显差异[15]。Juárez-Rojas等[16]报道 SLE 患者 HDL3 到HDL2的成熟过程受损,循环中HDL2b下降、HDL3b和HDL3c增加。
2.3 SLE患者HDL颗粒蛋白质和脂质组分变化 SLE患者HDL蛋白质组分变化以apoA-Ⅰ最为显著。针对SLE青年女性群体,Machado等[9]研究发现HDL-C/apoA-Ⅰ比值高于健康对照组,Juárez-Rojas等[16]分离出的HDL颗粒中apoA-Ⅰ水平明显下降。而有研究通过比较51例SLE患者和49例健康对照组发现,SLE患者apoA-Ⅰ/HDL比值升高,但总体apoA-Ⅰ水平仍较低[17]。同样,HDL脂质组分在SLE患者体内也受到损害。Juárez-Rojas等[16]发现SLE患者HDL颗粒脂质成分中胆固醇酯比例降低而三酰甘油比例升高。SLE患者氧化应激和炎性反应导致HDL过氧化反应增强,目前认为HDL的抗氧化作用主要依赖PON1等酶类,最新研究表明SLE患者PON1、PON3浓度及活性较健康人群显著下降[18]。血清淀粉样蛋白(serum amyloid A,SAA)是潜在的促炎因子,HDL上的apoA-Ⅰ可被SAA代替,多个团队研究发现SLE患者HDL上SAA明显富集[3]。故此推测,因上述HDL颗粒结构发生改变,HDL功能也出现变化。
2.4 趋炎 HDL(pro-inflammatory HDL,piHDL) 研究发现在SLE患者体内,HDL组分发生改变,具有抗感染功能的HDL会转化为功能紊乱的促炎症颗粒(pi-HDL),胆固醇的外流能力减弱,无法正常发挥其抗感染、抗氧化功能(图1)[19]。piHDL的特点在于其所含SAA水平增加,apoA-Ⅰ水平和PON活性降低,SAA会替代apoA-Ⅰ成为HDL的载脂蛋白,降低HDL对动脉粥样硬化的保护特性。McMahon等[20]报道44.7%的SLE患者piHDL水平增高,而对照组和类风湿性关节炎组的pi-HDL水平分别只有4.1%和20.1%,同时该团队又进一步利用颈动脉超声技术发现piHDL水平与颈动脉内膜中层厚度和颈动脉粥样斑块的增加呈正相关,提示pi-HDL对SLE亚临床动脉粥样硬化的发生、发展有显著作用。
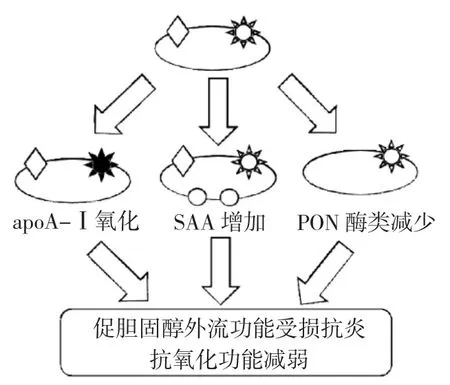
图1 功能异常的高密度脂蛋白(HDL)
2.5 氧化型高密度脂蛋白(oxidized HDL,ox-HDL) SLE患者体内氧化应激状态也会使HDL发生结构性变化,已有研究证实SLE患者体内ox-HDL水平较高[21]。当发生氧化应激反应时,髓过氧化物酶(myeloperoxidase,MPO)可在巨噬细胞、单核细胞和中性粒细胞中呈现高表达,利用过氧化氢氧化修饰脂质、蛋白质、核酸和脂蛋白。apoA-Ⅰ作为HDL中的主要部分,MPO通过对apoA-Ⅰ上的酪氨酸残基86、112、148等位点进行氧化修饰,显著提高重度氧化的apoA-I水平。有研究报道SLE患者血清中MPO浓度较高,提示SLE患者HDL氧化水平增加可能与MPO之间存在联系[22]。而除了MPO之外,HDL结构上过氧化脂质以通过使apoA-Ⅰ和apoA-Ⅱ结构中的蛋氨酸特异性氧化和酪氨酸特异性氯化,而促进ox-HDL形成。
最近认为HDL氧化与中性粒细胞外诱捕网(neutrophil extracellular traps,NETs)的形成存在一定联系。NETs是中性粒细胞在适宜刺激下释放到胞外的一种纤维网格样结构,正常生理情况下,NETs起捕获并杀灭病原体的作用,而目前发现NETs在SLE患者体内降解受阻,导致体内NETs水平异常升高和组织间中性粒细胞浸润,NETs功能紊乱。Carlucci等[23]研究证实SLE患者外周血中含有一群被称为低密度粒细胞(low-density granulocytes,LDG)的中性粒细胞亚群,其不仅易产生NETs还易导致血管损伤,且与SLE患者HDL介导胆固醇外流能力减弱相关。研究认为NETs水平升高能促进MPO、一氧化氮合酶(nitric oxide synthase,NOS)、磷酸酰胺腺嘌呤二核苷酸氧化酶(NADPH oxidase,NOX)向胞外转移,最终促进HDL3氧化[23];另有研究发现在SLE患者NETs形成过程中释放的MPO、NOX、NOS通过促进HDL 3-氯酪氨酸修饰和3-硝基酪氨酸修饰,抑制NETs形成而减少HDL的氧化[21]。除此之外,目前研究表明NETs成分中的DNA、组蛋白等是SLE患者产生自身抗体的靶抗原,而SLE患者脱氧核糖核酸酶(desoxyribonuclease,DNase)活性降低导致的 NETs清除障碍是其自身抗体产生的始动因素之一[24]。总而言之,这些研究均支持NETs在SLE患者HDL氧化过程中起重要作用的观点。
3 SLE患者HDL功能的变化
3.1 SLE患者HDL促胆固醇外流能力减弱 HDL将多余的胆固醇从周围组织(包括动脉粥样硬化斑块)转运到肝脏进行机体的再循环,或以胆酸的形式排泄出体外,这一过程称作胆固醇逆转运(reverse cholesterol transport,RCT)。HDL通过促进胆固醇流出以抑制脂毒性和泡沫细胞形成,从而发挥其抑制动脉粥样硬化的作用。HDL促胆固醇外流功能(cholesterol efflux capacity,CEC)是其抑制动脉粥样硬化的核心功能之一。从SLE患者体内提取的HDL与健康对照组HDL相比,其促胆固醇外流能力下降15%[21],动脉粥样硬化非钙化斑块成分增多[23]。SLE状态下氧化应激和炎性反应等导致apoA-Ⅰ和HDL颗粒蛋白质、脂质组分变形、氧化,氨甲酰化等(如前所述),形成过多 piHDL、oxHDL,改变apoA-Ⅰ的结构,影响HDL与细胞表面胆固醇转运体(如卵磷脂胆固醇酰基转移酶,lecithin cholesterol acyltransferase,LCTA)结合,导致 CEC 下降。
3.2 SLE患者HDL抗感染功能减弱 动脉管壁内膜发生炎症反应和脂质异常累积是动脉粥样斑块形成的两个重要诱因。炎症状态使血管内皮细胞表面黏附分子表达上调,进而加快粥样斑块进程。近年来,HDL能直接抑制动脉粥样硬化炎症反应这一说法已被广泛接受,目前HDL复杂的抗感染机制尚未阐明,但已有几种信号通路被证实[25]。首先,HDL是巨噬细胞内炎症反应的主要调节机制,通过上调转录抑制因子3(ATF3)抑制toll样受体(toll-like receptor,TLR)通路,下调白细胞介素(IL)-6、IL-12、肿瘤坏死因子(TNF)等的释放;HDL还通过抑制单核巨噬细胞中的核因子-κB(NF-κB)信号通路,减少其下游因子如E-选择素、P-选择素、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管黏附分子-1(vascular adhesion molecule-1,VCAM-1)及血小板源性生长因子(platelet-derived growth factor,PDGF)等表达,从而抑制血管炎症反应。
然而,与正常HDL抗感染反应相反,从SLE患者体内提取的HDL有趋炎作用(上文已述)。Smith等[26]研究发现SLE环境下的HDL无法抑制TLR通路驱动的炎症反应,可激活NF-κB通路,使单核巨噬细胞炎症因子TNF-α、IL-6的分泌增加。
SLE患者过量表达ox-HDL,可作为配体与氧化低密度脂蛋白受体-1(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1R)结合,增强局部氧化应激反应,抑制ATF3核转运,引起NF-κB等细胞因子增加。除此之外,SLE患者的功能异常HDL还可以直接上调血小板源性生长因子受体(platelet-derived growth factor receptors,PDGF-R)-β 和增加TNF-α 释放[27]。最近研究人员将HDL由正常抗炎能力向异常促炎作用的转变归因于SAA,研究表明SLE患者HDL颗粒中SAA含量可以通过影响细胞膜表面“脂筏”的组成成分和结构完整性及其介导的信号转导,特异性损害HDL的抗感染作用[28]。
3.3 SLE患者HDL抗氧化功能减弱 在普通人群以及SLE患者中,氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)水平升高是公认的CVD危险因素。HDL可保护LDL的脂质和蛋白质组分免受自由基氧化,抑制初级和次级氧化物产生,从而发挥抗氧化作用。SLE患者oxHDL和氧化apoA-Ⅰ的过表达降低了HDL颗粒清除活性氧(ROS)的能力,而piHDL促进LDL氧化的作用使SLE患者过表达oxLDL,促进内皮黏附因子表达和单核细胞的趋化,从而促进泡沫细胞产生。对氧磷脂酶(paraoxonase,PON)作为HDL重要的抗氧化组分,有清除粥样斑块、巨噬细胞和脂蛋白中的脂质过氧化物(lipid hydroperoxise,LOOH)作用。SLE患者PON-1活性降低(原因尚不清楚)、抗氧化能力下降,部分研究发现其与患者自身抗体水平(如:抗HDL-IgG、抗β2糖蛋白I抗体等)呈负相关[29]。Marsillach等[18]还发现除了PON-1,PON-3水平在患有亚临床动脉粥样硬化的SLE患者明显降低。
4 SLE患者脂蛋白相关自身抗体形成
自身抗体水平升高是SLE的特征之一。在欧美和日本的SLE患者中抗apoA-Ⅰ抗体阳性率约为7.7%~32.5%,且该抗体滴度与疾病活动度呈正比[30]。诸多学者认为抗apoA-Ⅰ抗体可能通过降低PON活性,促进LDL氧化,被单核巨噬细胞摄取而形成泡沫细胞,且在狼疮小鼠模型中已证实抗apoA-Ⅰ抗体水平与HDL-C水平、PON-1活性呈负相关[31]。目前认为在SLE患者体内抗apoA-Ⅰ水平升高与无脂apoA-Ⅰ、氧化游离apoA-Ⅰ相关。无脂apoA-Ⅰ在血浆中的表达还与疾病过程中SAA替代HDL中正常apoA-Ⅰ等成分使apoA-Ⅰ部分游离有关。apoA-ⅠMet-148位点氧化导致蛋白质构象改变,apoA-Ⅰ分子C端的α螺旋(对脂质分子具有极高亲和性,在apoA-Ⅰ与脂质分子结合过程中起始动作用)转变为β折叠,引起淀粉样变并与HDL解离,故而使无脂apoA-Ⅰ水平上升[32]。研究发现,从SLE患者血浆中分离出来的HDL含有高水平蛋白质结合的3-氯酪氨酸和3-硝基酪氨酸量,其分别是健康人1.9倍、120.9倍[21],而这种错误折叠的apoA-Ⅰ具有更强的免疫原性,会产生抗原决定簇,诱导体内生成抗apoA-Ⅰ抗体。
抗HDL抗体在SLE患者中也有报道,但抗HDL抗体与抗apoA-Ⅰ抗体之间的差异尚不明确。部分研究发现相较于健康人群和原发性抗心磷脂综合征患者,SLE患者体内抗HDL抗体滴度更高,且与疾病活动度和PON活性降低相关[33]。在体外试验中也证实抗HDL抗体、抗apoA-Ⅰ抗体可直接抑制PON1活性,使SLE患者发生CVD风险增加[31]。
Borda等[34]表示与SLE病程密切相关的抗心磷脂抗体(anticardiolipin antibody,aCL),其与 IgG 型抗 apoA-Ⅰ抗体之间存在交叉反应,并且IgG型aCL与血清HDL、apoA-Ⅰ水平负相关,这提示aCL也有可能参与了SLE血脂紊乱的过程。
5 SLE与基于HDL相关治疗的研究现状
他汀类药物是目前市面上用于治疗和缓解CVD的传统药物。LAPS研究指出接受2年阿托伐他汀治疗的SLE患者颈动脉内膜中层厚度和颈动脉粥样硬化斑块与对照组相比无明显差异[35]。而另一项使用他汀药物治疗的全国性临床研究发现,SLE高脂血症患者的CVD病死率降低30%[36],另有学者报道短期应用阿托伐他汀(8周)能改善SLE患者内皮依赖性血管舒张功能[37]。故而目前大样本长期前瞻性临床试验已确定他汀药物治疗SLE是必要的。
重组高密度脂蛋白(reconstituted HDL,rHDL)是由apoA-Ⅰ或apoA-Ⅰ模拟肽在磷脂重组后制备的纳米颗粒,自1984年来作为抗动脉粥样硬化治疗药物被广泛研究。在动物模型和临床试验中已证实静脉注射rHDL可提高外周循环HDL浓度、快速转运胆固醇、抑制炎症介质合成、改善内皮功能、增强整体动脉粥样硬化保护作用。到目前为止,已有6种不同的药物在临床进行测试:SRC-HDL、CSL-111、CSL-112、ETC-216、ETC-642和CER001。其中ETC-216和CSL-111经血管内超声(IVUS)评估可减少CVD患者的斑块负担[30]。与CSL-111相比,CSL-111的新剂型CSL-112由更好的临床有效性和安全性。rHDL对治疗炎症性疾病如脓毒血症也有一定作用。HDL可以中和细菌内毒素,调节巨噬细胞的炎症反应,抑制促炎因子释放,刺激内皮型一氧化氮合酶(eNOS)的产生。因此注射CSL-111可抑制促炎因子释放,缓解临床症状。
测试HDL治疗在SLE动物模型的假定益处的研究甚少。Woo等[38]研究单独使用L-4F或与普伐他汀联合治疗SLE在狼疮小鼠动脉粥样硬化模型中有显著积极作用:降低抗ds-DNA抗体、抗磷脂抗体滴度,改善小鼠的肾组织炎症,减少尿蛋白漏出、氧化脂质和骨质疏松。ETC-642是apoA-Ⅰ模拟肽(ESP24218)和脂质复合物组成的HDL模拟物,Smith等[26]将小鼠巨噬细胞暴露在1∶4的SLE HDL∶ETC-642环境中,观察细胞培养液中TNF-α、IL-6表达量,并通过对ATF3转录及翻译的表达分析发现,ATF3表达量与rHDL抗炎作用呈正相关,此项研究为开发新药提供一定可行性思路。到目前为止,rHDL动物实验治疗丰富了HDL功能在SLE并发CVD疾病防治中的证据,但仍需大规模的前瞻性临床试验进行验证。
6 小结
SLE患者并发CVD风险明显增加,尽早干预SLE患者并发CVD风险的因素十分重要。活动期SLE患者全身氧化应激和炎症反应活跃,HDL颗粒结构发生改变,这些HDL功能异常促进SLE患者并发CVD的发生和发展,可能是重要的干预靶点。SLE的相关研究丰富了HDL功能在CVD防治中的证据,但仍需大规模的临床试验进行验证。
