多囊卵巢综合征患者血清特异性LncRNA表达谱研究
2020-06-24吴镔莎余宁卢佳敏李小青周怡池万凌屹谢迟迟张娟文郑若姮
吴镔莎 余宁 卢佳敏 李小青 周怡池 万凌屹 谢迟迟 张娟文 郑若姮
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种以持续排卵障碍、高雄激素血症及胰岛素抵抗(insulin resistance,IR)为特征的生殖内分泌常见疾病,其发病率在育龄期妇女中达5%~10%,占不排卵性不孕症的50%~70%[1]。PCOS以不孕、多毛、无排卵及月经不调等为主要临床表现,同时伴有特征性的血清生化指标改变,如雄激素及促黄体激素(luteinizing hormone,LH)水平上升但卵泡刺激素(follicle stimulating hormone,FSH)水平正常等。PCOS是一种多因性疾病,与遗传[2]、基因多态性[3]、代谢综合征[4]及环境[5]等因素密切相关,但具体机制仍然未明,且缺少特异性的分子生物学诊断标志物。本研究联合长链非编码核糖核酸(long noncoding ribonucleic acid,LncRNA)表达芯片初筛及实时定量逆转录-聚合酶链反应(quantitative real time polymerase chain reaction,qRT-PCR)验证,构建 PCOS特异性表达谱,进一步采用生物信息学方法推测其可能的下游基因通路,为PCOS分子生物学诊断方法的研发提供新思路。
1 对象和方法
1.1 对象 选取2017年1月1日至2018年6月30日在浙江大学医学院附属第一医院就诊的50例PCOS患者为PCOS组,同期在体检中心常规体检的50例健康人群作为对照。PCOS的诊断依据鹿特丹标准(至少满足以下3条标准中的2条):(1)排卵减少或不排卵;(2)临床雄激素过高征,包括多毛、痤疮、男性化的脱发以及高雄激素血症;(3)B超检查见一侧或双侧卵巢直径2~9mm的卵泡≥12个和(或)卵巢体积≥10cm3。本研究经医院伦理委员会审查批准,两组对象均知情同意。
1.2 方法
1.2.1 血清RNA提取 采集所有对象血清5ml,-80℃保存备用。每例取血清 100~500μl,加入 800μl Trizol-LS,振荡混匀;加入 10μl 0.1pmol/μl的 miRNA156,振荡混匀,静置15min。加入200μl氯仿,剧烈振荡,静置15min;16 000g离心20min。取上清液,加入400μl水饱和酚,振荡混匀,静置1~2min;16 000g离心3min。取上清液,加入200μl水饱和酚和200μl氯仿,振荡混匀,静置1~2min;16 000g离心 3min。取上清液(约 800μl),分至两管,每管加入1ml异丙醇,振荡混匀,静置于冰上20min;4℃、16 000g离心20min。弃上清液,每管加入500μl 75%焦碳酸二乙酯(DEPC)-乙醇,振荡后16 000g离心20min。弃上清液,用吸水纸在试管口将剩余液体吸干,开盖晾干(若液体仍较多,可用移液枪将液体吸出,但应注意不要碰到管底)。每管加入15μl DEPC水,静置待RNA溶解后,将两管合并。
1.2.2 LncRNA表达谱检测 从PCOS组、对照组分别随机选取3例血清标本进行LncRNA表达谱检测。使用Nanodrop测定提取RNA在分光光度计260、280、230nm处的吸光度,以进行浓度测定与纯度评估。用甲醛电泳试剂进行变性琼脂糖凝胶电泳,检测RNA纯度及完整性。采用人类8*60KLncRNA芯片进行信号采集,该芯片包含有30 586个人LncRNA位点(Arraystar,Rockville,Maryland,USA)。首先根据单色微阵列基因表达分析流程(Agilent Technology,Santa Clara,USA)进行样本的标记与序列杂交,再利用安捷伦图像获取软件11.0.1.1进行图像分析。后续的分位数标准化与数据处理在GeneSpring GX v12.1软件(Agilent Technologies)中进行。联合分析组间t检验(P<0.05)、多重假设检验(FDR<0.05)和倍数变化(>2或<0.5)的结果,得到显著性差异的LncRNA表达谱。进一步以热图形象化显示可区分PCOS患者和健康人群的差异表达LncRNA。
1.2.3 LncRNA的qRT-PCR验证 选取包含接受芯片检查对象在内的PCOS患者和健康人群各6例,使用Prime Script RTreagent试剂盒(TakaRa,大连,中国)针对热图得到的差异表达LncRNA进行qRT-PCR验证。U6核小RNA(snRNA)进一步扩增,作为内参。将每个LncRNA的绝对表达量除以U6 snRNA的绝对表达量,得到LncRNA的相对表达量。
1.2.4 生物信息学分析 将芯片得到的显著上调和下调的LncRNA,利用starbase网站(http://starbase.Sysu.edu.cn)进行下游调控靶基因预测。将预测得到的信使RNA(mRNA)进行基因本体注释(gene ontology,GO)富集分析,以得到潜在的共同细胞生物学功能。
1.3 统计学处理 采用SPSS 11.0统计软件。每项实验至少进行3次,正态分布的计量资料用±s表示,两组比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组对象一般资料比较 与对照组相比,PCOS组体重指数(body mass index,BMI)、睾酮、甘油三酯、C 反应蛋白(C-reactive protein,CRP)水平及胰岛素抵抗稳态模型(homeostasis model assessment-insulin resistance,HOMA-IR)明显增高,雌二醇水平明显降低,差异均有统计学意义(均P<0.05);两组对象年龄、胆固醇水平比较,差异均无统计学意义(均P>0.05),见表1。
2.2 PCOS患者LncRNA表达谱的构建 与对照组比较,PCOS组患者血清中分别有351、217种显著上调和下调的LncRNA(符合变化系数≥2.0,P<0.05)。进一步作聚类分析,发现包含显著上调的11种LncRNA和显著下调的8种LncRNA的数据集可以成功区分PCOS患者和健康人群,见图1(插页)。
2.3 差异表达LncRNA的验证 通过qRT-PCR验证热图中所列LncRNA,与对照组比较,在PCOS组上调的LncRNA中,ENST00000433673和 CTC-338M123未达到显著性差异;在PCOS组下调的LncRNA中,ENST00000569039未达到显著性差异。qRT-PCR结果进一步支持LncRNA芯片作为初筛方法的灵敏度和特异度。

表1 两组对象一般资料比较
2.4 LncRNA下游靶基因的GO富集分析 选取PCOS患者LncRNA芯片中显著上调和下调的LncRNA各20个,输入Starbase网站进行下游基因预测,得到的靶基因作进一步GO富集分析,结果发现显著上调LncRNA预测的mRNA共涉及11个相关GO生物学功能,包括细胞生长和体积的负调控、N-乙酰葡萄胺/葡萄胺代谢过程、氨基糖代谢过程、细胞组分大小和定位调控、细胞腔;显著下调LncRNA预测的mRNA共涉及20个相关GO生物学功能,包括基因及表观遗传学负调控、细胞活化调控、细胞周期、淋巴血管发育、钙离子反应、染色质重塑、离子转运、干扰素r生物合成过程正调控、血细胞发生、嘌呤碱生物合成、结合调控、mRNA接合位点选择、细胞运动、转录、白细胞活化调控,见图2。
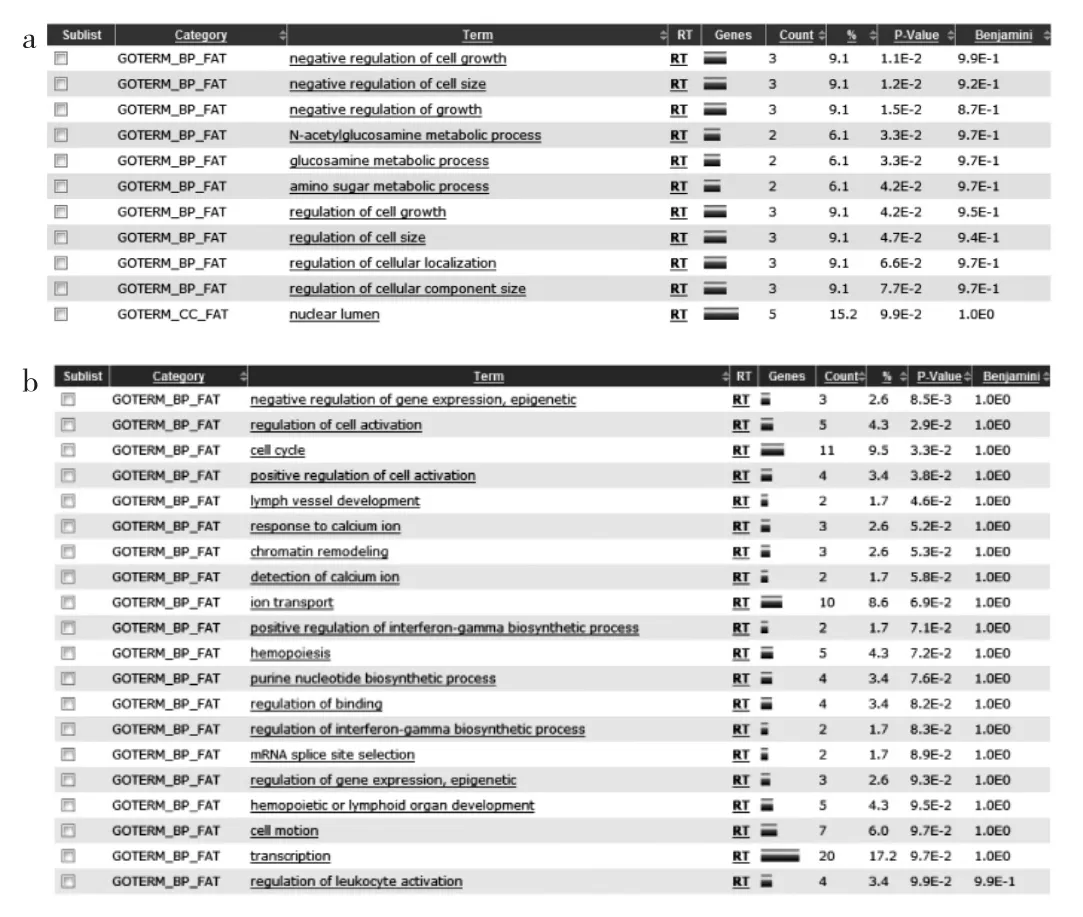
图2 差异表达LncRNA所预测靶基因的GO富集分析(a:显著上调LncRNA所预测的下游mRNA;b:显著下调的LncRNA所预测的下游mRNA)
3 讨论
当前PCOS的诊断多采用2003年鹿特丹标准[6]。各项研究表明 PCOS除引起生殖功能和代谢功能的异常外,还可增加子宫内膜癌、血脂异常、心血管疾病和2型糖尿病的发病风险。有报道指出,PCOS可并发雄激素性脱发、睡眠呼吸暂停、抑郁、妊娠期高血压、先兆子痫、非酒精性脂肪性肝病等[7],病情严重时可能影响女性一生的健康。由此可见,早期诊断和治疗是至关重要的。因此,构建PCOS非侵入性的分子标志物群,不仅有助于提高疾病的临床检出率,实现早期诊疗,对于PCOS的研究、减轻社会经济负担也有重要意义。
LncRNA是一类长度介于200~100 000个核苷酸的非编码RNA[8]。目前研究认为,它在表观遗传学水平、转录水平及转录后水平上广泛地参与肿瘤调节基因的表达,从而在复杂的肿瘤调控网络中发挥重要作用[9]。此外,LncRNA通过调控下游靶基因参与各种病理、生理过程(如肿瘤发生、信号转导、血管生成等)也是当前学术界研究的热点。然而,LncRNA在PCOS中的研究并不多见,且主要集中于其下游调控机制的研究(如LncRNA-GS5促进PCOS患者的IR[10]、LncRNA介导的内源竞争RNA网络在PCOS患者卵母细胞核成熟中的作用[11])或组织LncRNA表达谱的变化(如PCOS患者颗粒细胞[12]和卵丘细胞[13])。
血清存在着多种蛋白、糖质、色素、电解质、无机盐,同时还汇集了来自全身组织器官的多种信号分子。目前组织中LncRNA分子已被证实是一类新型疾病标志物,而血清中LncRNA是否存在同样的效能,是当前研究的最热点问题之一。Chen等[14]最早阐明了血清中存在稳定的miRNA(一种短链RNA)并且在不同疾病之间miRNA的表达谱存在有显著性差异,支持血清中非编码RNA存在的可能。此后,血清LncRNA在食管鳞癌[15]、膀胱癌[16]和乳腺癌[17]中的预测作用陆续被发现,使得血清LncRNA表达谱在疾病中的作用日益受到重视。血清LncRNA作为新型疾病标志物,具有检出谱系广、灵敏度高、检测成本低、取材方便、样本易存放(-20℃存放即可)等优点,该方法可广泛用于疾病普查等相关工作,成为了早期诊断疾病的有效手段。但是笔者检索了国内外文献,关于血清LncRNA在PCOS中的研究未见报道。
本研究通过LncRNA表达谱研究,阐明了PCOS患者差异性表达的LncRNA;并进一步作聚类分析,发现包含显著上调的11种LncRNA和显著下调的8种LncRNA的数据集可以成功区分PCOS患者和健康人群。针对聚类分析的结果,进一步采用qRT-PCR进行验证,发现16种LncRNA差异表达与芯片结果一致,符合率达84.2%。在这些差异表达的LncRNA中,既往研究提示CCAT1与肿瘤发生、发展密切相关,如其通过介导下游Runx2基因参与人宫颈癌的增殖和上皮细胞向间质细胞的转变[18];XLOC家族中的006390被报道可以通过稳定c-Myc来促进胰腺癌发生和谷氨酸盐代谢[19];LncRNA-ROR可以通过调节miRNA-145/FSCN1通路促进食管癌细胞的转移和浸润[20]。生物信息学分析结果提示,这些差异表达的LncRNA下游调控基因的生物学功能涵盖细胞生长、活化、表观遗传学调控等,值得进一步研究。
综上所述,本研究系统阐述了PCOS患者血清特异性LncRNA表达谱,并对热图分析产生的差异LncRNA进行qRT-PCR验证,进一步对预测的下游mRNA进行生物信息学分析,通过GO富集分析找到若干关键基因功能,为PCOS非侵入性诊断提供分子生物学标志物。但本研究也存在一些不足:(1)PCOS患者血清LncRNA表达谱测定的样本数偏少,虽经qRT-PCR验证,但仍可能会发生较大偏倚,无法充分反映目标人群情况;(2)笔者预测了差异表达程度最高的20个LncRNA的下游mRNA,但仍需要进一步qRT-PCR验证,同时扩大验证进行预测下游mRNA的LncRNA范围;(3)仅采用GO富集分析LncRNA下游mRNA的生物信息学功能,后续可针对其KEGG通路作进一步分析。
