增殖期糖尿病视网膜病变的血清代谢组学研究
2020-06-19朱晓蓉杨芳远杨光燃谢荣荣冯建萍杨金奎
朱晓蓉 杨芳远 卢 晶 曹 曦 杨光燃 谢荣荣 冯建萍 杨金奎*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730; 2.糖尿病防治研究北京市重点实验室,北京 100730; 3.北京市糖尿病研究所,北京 100730)
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病最具特征性的微血管合并症,是我国成年人致盲的常见原因和首要原因,严重影响患者的生活质量[1]。研究[2]显示,糖尿病病史15~20年,几乎所有的1型糖尿病和60%以上的2型糖尿病患者有视网膜病变。威斯康星糖尿病视网膜病变流行病学研究(Wisconsin Epidemiological Study of Diabetic Retinopathy,WESDR)表明,3.6%的1型糖尿病患者在年轻时和1.6%的2型糖尿病患者在晚期时被诊断为法定盲。我国糖尿病人群居世界第一,目前成年糖尿病患者超过1亿[3],据此推算,我国因糖尿病视网膜病变所致的法定盲患者将超过160万人。因此,早期发现和干预具有重要的临床意义。
糖尿病视网膜病变是由基因与环境因素综合作用的代谢性疾病。而且越来越多的证据[4]表明,糖尿病视网膜病变的发生与“代谢记忆”有关。早期高血糖暴露引起的表观遗传修饰,即使血糖控制良好后也会发生糖尿病合并症[5]。近年来,代谢组学技术的发展也为探索糖尿病视网膜病变生物标志物研究提供了新的思路。曾有代谢组学研究[4,6]用于探索早期糖尿病视网膜病变的血液“代谢图谱”。而本研究拟在发生威胁视力的糖尿病视网膜病变——增殖期糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)的2型糖尿病患者中,采用代谢组学检测,探索增殖期糖尿病视网膜病变的“代谢图谱”,探讨与其发生发展可能相关的机制。
1 对象与方法
1.1 研究对象
以2016-2017年间在首都医科大学附属北京同仁医院内分泌科及眼科门诊就诊的1 024名2型糖尿病患者为研究对象,选择其中增殖期糖尿病视网膜病变者为病例组(PDR组),根据性别、年龄组间匹配的原则,选择糖尿病病程10年以上且眼底完全正常(non-diabetic retinopathy, NDR)者为对照组(NDR组),每组各21例。纳入标准:2型糖尿病患者;年龄40~75岁;糖化血红蛋白(hemoglobin A1c,HbA1c)≥7.5%。排除标准:1型糖尿病和分型不明确的糖尿病患者;合并其他眼部疾病或伴有眼部合并症的全身系统疾病的患者;严重肝肾功能、心脏功能受损的患者;恶性肿瘤及有器官移植病史的患者。
1.2 研究方法
1.2.1 临床信息采集
对所有受试者登记临床信息并完善体格检查,包括身高、体质量、年龄、性别、糖尿病病程、吸烟史、血压、体质量指数(body mass index,BMI)等。同时采集血液和尿液进行实验室检测,包括空腹血糖、总胆固醇、三酰甘油、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇、血清肌酐、肝功能、糖化血红蛋白及尿微量白蛋白等。
1.2.2 血清样本制备
过夜禁食至少8 h,采用K2EDTA抗凝管抽取4 mL外周血,冰上静置30 min后,4° 1 000g离心机离心10 min,提取血清。所有血清标本-80 ℃冰箱冻存直到研究使用。
1.2.3 眼底检查
采用拓普康TRC-NW7SF (Topcon Co., Tokyo公司,日本)眼底照相仪,所有受试者均接受眼底照相检查,眼底照相结果均由两名首都医科大学附属北京同仁医院眼科医师按2002年国际糖尿病视网膜病变临床分级标准[7]进行分级评估。(i)无明显视网膜病变(NDR):无异常改变;(ii) 轻度非增殖期糖尿病视网膜病变(non-proliferative diabetic retinopathy, NPDR):仅有微动脉瘤;(iii)中度NPDR:介于轻度及重度NPDR的表现;(iv)重度NPDR:出现下列任何1个改变,但无PDR表现:任一象限内多于20处视网膜内出血;两个以上象限有静脉串珠样改变;1个象限有显著的微血管内微血管异常;(v)增殖期糖尿病视网膜病变:出现1种或多种改变,包括新生血管形成、玻璃体积血或视网膜前出血。
1.2.4 液相色谱-质谱技术(liquid chromatography-mass spectrometry, LC-MS)代谢组检测
取血清100 μL,加入3倍体积乙腈,涡旋震荡混合1~3 min,4 ℃静置10 min,13 000 r/min离心10 min,取上清,真空干燥即可。100 μL乙腈复溶,待检。采用电喷雾电离源,正离子电离模式。离子源温度120 ℃,脱溶剂温度 500 ℃, 脱溶剂氮气流600 L/h,锥孔反吹氮气 50 L/h。正离子模式毛细管电离电压分别为3.0 kV,取样锥孔电压为27 eV,萃取锥孔 4 eV,四极杆扫描范围50~1 500 m/z。
1.3 统计学方法
1.3.1 临床资料统计

1.3.2 代谢组结果统计
使用MarkerView进行峰识别、峰过滤、峰对齐工作。利用MetaboAnalyst 4.0 (http://www.metaboanalyst. ca/MetaboAnalyst/)将样本进行标准化处理;进行偏最小二乘法(partial least squares discriminant analysis,PLS-DA)多元分析发现组间的差异代谢物;采用倍数变化和t检验相结合的方法计算火山图。再用组间差异具有统计学意义的峰进行多元模式识别确定上调或下调峰。再用这些数据进行箱形图分析、聚类分析和代谢途径分析。
差异代谢产物应用Metaboanalyst (http://www.metaboanalyst.ca/)进行路径和可视化分析。差异代谢物筛选根据差异倍数(fold change,FC)、P值和变量重要性投影值(variable important in the projection, VIP)设定标准。筛选的差异代谢物与人类代谢组数据库(Human Metabolism Database,HMDB)数据库进行比较,确定具体物质[8]。
利用KEGG数据库对差异化合物进行Pathway分析,并且用统计检验的方法计算每个Pathway条目中差异化合物富集的显著性。计算的结果会返回一个富集显著性的P值,小的P值表示差异化合物在该Pathway 中出现了富集。

图1 PLS-DA散点得分图Fig.1 Score plots of PLS-DA models The two groups were well separated in the PLS-DA score plot, indicating that they had markedly different metabolic characteristics;PLS-DA:partial least squares discriminant analysis.
2 结果
2.1 两组患者临床特征比较
PDR组与NDR组患者临床特征详见表1。两组间年龄、性别、BMI、低密度脂蛋白胆固醇浓度差异均无统计学意义(P>0.05)。NDR组糖化血红蛋白浓度高于PDR组,PDR组合并蛋白尿的患者数高于NDR组,差异有统计学意义(P<0.05)。
表1 两组患者临床特征表


ItemNDR(n=21)PDR(n=21)tPGender (male/female)9/129/12 0.00∗1.000Age/a53.8±6.851.6±7.70.850.404Duration/a15(11.5,20)11(8,15.5)2.690.014BMI/(kg·m-2)26.98±3.4026.22±2.591.440.164LDL-C/(mmol·L-1)2.83±0.952.82±0.960.380.709FBG/(mmol·L-1)8.15±2.748.95±2.86-0.140.892HbA1c/%9.38±1.208.14±0.642.800.011Albuminuria515-3.55∗0.002Microalbuminuria 20-200 ng/min48 >200 ng/min17
*χ2value;NDR: non-diabetic retinopathy;PDR:proliferative diabetic retinopathy;BMI: body mass index;LDL-C:low density lipoprotein cholesterol;FBG: fasting blood glucose;HbA1c: hemoglobin A1c.
2.2 差异代谢物分析
对获得代谢物质进行正交PLS-DA模型分析显示两组的代谢差异,得分图见图1。建立的PLS-DA模型能够很好地区分PDR组和NDR组。进一步将差异代谢物绘制火山图及热图(图2),结果均表明PDR与NDR组相比存在明显不同的代谢特征。按照FC>2或FC<0.5,P<0.05且VIP>1,筛选出的差异化合物与HMDB数据库进行比较,共鉴定出136个差异代谢物质,其中包括有机酸(78%),有机氮化合物(4%),脂类及类脂分子(3%)及其他代谢物(图3)。表2展示10个变化显著的代谢物。

图2 差异代谢物绘制火山图(A)和热图(B)Fig.2 The volcanic map (A) and heat map (B) of the different metabolites were plottedThere were significantly different metabolic characteristics in the PDR group compared with the NDR group;NDR: non-diabetic retinopathy; PDR:proliferative diabetic retinopathy.
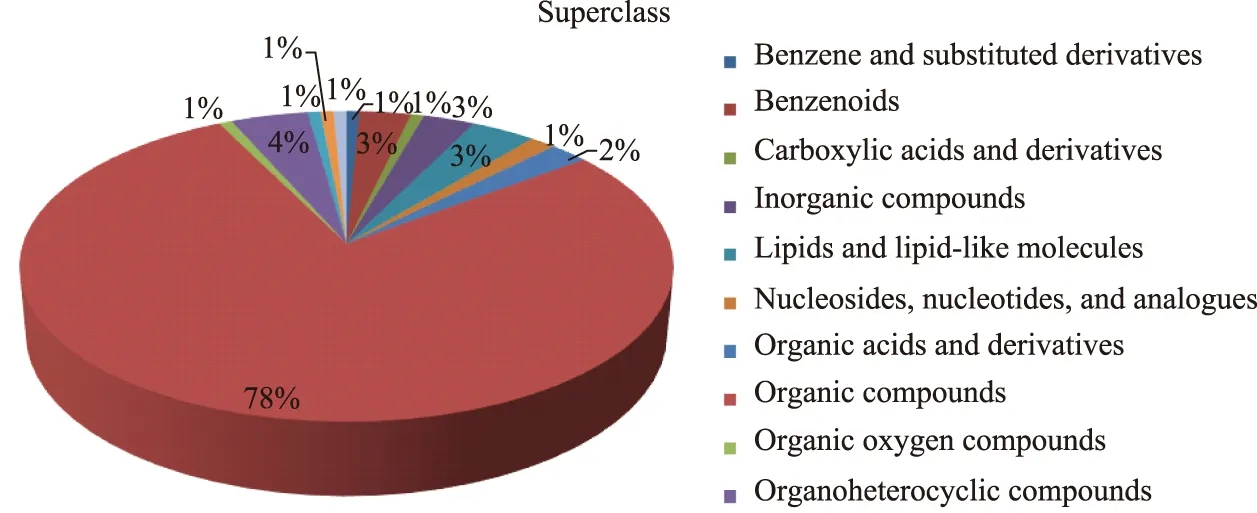
图3 差异代谢物分类 Fig.3 Metabolite classification analysisPie chart of differentially metabolomic showed that the 136 metabolites mainly involved organic compounds (78%), organoheterocyclic compounds (4%), lipids and lipid-like molecules (3%) and others.

表2 与增殖期糖尿病视网膜病变相关的差异代谢物
HMDB:Human Metabolism Database.
2.3 代谢通路分析
代谢差异物在30条KEGG通路中富集(图4A),其中3条通路显著富集(P<0.05)。这3条通路分别为硫代谢、鞘脂代谢以及半胱氨酸和蛋氨酸代谢(图4B~D)。

图4 代谢通路分析Fig.4 Non-targeted metabolomics pathway analysisA:Pathway enrichment analysis. The size and color of each circle was based on pathway impact value and P-value, respectively; B-D: Three pathways differ between the NDR and PDR group, particularly, in Sulfur metabolism (B), Sphingolipid metabolism (C) and Cysteine and methionine metabolism(D); NDR: non-diabetic retinopathy; PDR:proliferative diabetic retinopathy.
3 讨论
糖尿病视网膜病变是糖尿病最具特征性的微血管合并症,是成人发生失明的常见原因,也是不可逆性盲的首要原因[1]。糖尿病视网膜病变分为非增殖期视网膜病变和增殖期视网膜病变。其中增殖期糖尿病视网膜病变也被定义为威胁视力的糖尿病视网膜病变,极易导致视力丧失,降低患者生存质量。早期发现和干预具有极其重要的意义。糖尿病视网膜病变的发生机制与高血糖所致持续性代谢性紊乱、炎性反应、氧化应激或其他未知致病因子有关[9]。一个不争的事实是,一些血糖控制达标的患者也出现了增殖期糖尿病视网膜病变。因此,有研究者[10]认为尽管血糖是视网膜病变进展的主要的系统性风险因素,但它的整体贡献只有11%,也就是说,风险的89%必须由其他未知因素来解释。本研究采用液相色谱-质谱技术探索增殖期糖尿病视网膜病变患者血清中代谢失调的特征。本研究目的包括:(1)检测威胁视力的糖尿病视网膜病变-增殖期糖尿病视网膜病变的“代谢图谱”; (2)探索可能与增殖期糖尿病视网膜病变发生发展相关的代谢通路。
迄今为止,仅有4项关于糖尿病视网膜病变的代谢组学研究,而根据研究标本类型可以分为玻璃体和血浆。但是玻璃体标本取样具有侵袭性、取样受限,而血浆/血清易于获得,依然是目前开展临床筛查常用的生物样品。因此,2016年Chen等[4]首次采用气相色谱技术对40例非增殖期糖尿病视网膜病变患者的血浆进行代谢组学检测,共检测14个差异代谢物,而葡糖酸水平显著升高可能作为潜在的诊断标志物。与气相色谱-质谱技术相比,本研究采用液相色谱-质谱技术提高了检测灵敏度,共检测出146个差异代谢物。其中差异代谢物-犬尿酸(kynurenic acid)在既往研究[6]中也被报道与糖尿病视网膜病变相关,可能与氧化应激有关,但具体机制尚未明确。
早期2项玻璃体标本的代谢组学研究[11-12]报道增殖期糖尿病患者的玻璃体液的精氨酸代谢[11]、多元醇途径和抗坏血酸代谢紊乱[12]。Chen等[4]进行的血清代谢组学研究结果则显示非增殖期糖尿病视网膜病变患者血清中磷酸戊糖代谢途径显著富集,磷酸戊糖代谢途径紊乱可能与非增殖期糖尿病视网膜病变相关。本研究通过增殖期糖尿病视网膜病变患者血清代谢组检测,发现差异代谢物硫代谢、鞘脂代谢以及半胱氨酸和蛋氨酸代谢通路显著富集,推测上述代谢途径紊乱可能与增殖期糖尿病视网膜病变发生、发展有关。蛋氨酸是重要的必需氨基酸,参与机体重要的代谢过程。有研究者[13]认为蛋氨酸代谢紊乱可以通过氧化应激途径引起肾脏功能损伤。发生机制与影响蛋氨酸代谢通路中的甲硫氨酸亚砜还原酶A(MsrA)和B(MsrB)活性有关[14]。而正常人视网膜中也已被证实存在MsrA[15],因此笔者首次提出蛋氨酸代谢途径紊乱可能也是通过影响MsrA功能参与增殖期糖尿病视网膜病变的进程。总而言之,不同眼底分期的血清“代谢图谱”存在差异,提示增殖期糖尿病视网膜病变可能存在独特的代谢过程。因此,需要更多的研究来验证这些结论并探讨与糖尿病视网膜病变之间的关联。
采用代谢组学研究糖尿病视网膜病变的发病机制具有很大的优势,目前处于起始阶段,相关报道很少,结果重复性差,需要更多的研究来验证这些结论并探讨与糖尿病视网膜病变之间的关联。本研究为探索性研究,存在一定局限性,小的样本量不足以做出糖尿病视网膜病变患者代谢状态的结论性陈述,需要增加样本量和开展队列研究来证实笔者的发现,并进一步探讨可能的机制。
总之,本研究通过伴有增殖期糖尿病视网膜病变的2型糖尿病患者的血清代谢组学研究,发现PDR组与NDR组患者相比具有独特的代谢特征。提出硫代谢、鞘脂代谢以及半胱氨酸和蛋氨酸代谢紊乱可能与增殖期糖尿病视网膜病变的发病机制有关。但是本研究结果仍需要更多的研究来验证这些结论并深入探讨与糖尿病视网膜病变之间的关联。
