基于Illumina测序筛选牛卵泡发育相关的上调表达基因
2020-06-19孟金柱安清明武渊勋赵园园
孟金柱,安清明,武渊勋,赵园园
(1.铜仁学院,贵州 铜仁 554300;2.山西普源泰奶牛养殖有限公司,山西 晋中 030800)
哺乳动物的卵泡是生殖系统的重要组成部分,它在控制发情周期、发情行为,确保卵母细胞发育能力及后期胚胎存活率、排卵后黄体功能和孕酮合成等方面起着重要作用[1]。在牛的1个发情周期中,卵泡生长特征呈现波的模式,常常会出现2~3个卵泡波[2]。直径4~9 mm的有腔卵泡生长依赖于卵泡刺激素(FSH),且在卵泡发育波出现之前,FSH浓度会发生短暂升高[3]。研究表明,牛卵泡内的多种生长因子,如激活素、抑制素和胰岛素样生长因子(IGF)及其结合蛋白等,在调控卵泡中细胞的存活、增殖或凋亡过程中发挥了很重要的作用[4]。
牛卵泡含有卵母细胞(CC)、颗粒细胞(GCs)和膜细胞(TCs)。颗粒细胞和膜细胞合成的类固醇和肽激素分泌到细胞外基质,发出一系列信号控制卵母细胞的发育和成熟,从而创造了一个决定卵母细胞质量和成熟的微环境[5-6]。膜细胞通过细胞色素P450 17A1酶(CYP17A1)合成雄激素[7],而颗粒细胞中的细胞色素P450 19A1酶(CYP19A1)负责将雄激素转化为雌激素(E)[8]。增强雌二醇(E2)产生的能力,对维持优势卵泡(DF)的生长和启动性行为、促性腺激素浓度的升高、减数分裂的恢复和排卵至关重要[9]。牛卵泡发育过程中E2的产生受多种激素和生长因子调控,包括FSH[10]、IGF[11]、可卡因安非他命调节转录肽(CART)[12]以及骨形态发生蛋白2(BMP2)[13],但具体调控机制尚不清楚。
多种动物的转录调控机制已经通过Illumina测序被发现,如绵羊[14]、奶牛[15]和猪[16]。ROMEREIM等[17]对牛卵泡中颗粒细胞、膜细胞、大黄体细胞(LLCs)和小黄体细胞(SLCs)进行转录组测序及分析,筛选出促进黄体形成及参与卵泡发育的相关基因。鉴于此,通过Illumina平台对牛DF和从属卵泡(SF)中的颗粒细胞进行测序,筛选出卵泡发育相关的上调表达基因,对揭示牛特定的卵泡发育阶段多种配体、受体和同源胞内信号分子的表达差异,分析促进牛卵泡颗粒细胞增殖及调控E2分泌的关键因子具有重要意义,为进一步阐明调控优势卵泡被选择的潜在机制奠定基础。
1 材料和方法
1.1 样品采集
以山西省太谷县普源泰奶牛养殖有限公司的黑白花奶牛为研究对象,在相同的饲喂条件下,选取6头2岁龄健康母牛,同期发情并使用B超检测每头牛卵泡发育情况,送往屠宰场屠宰,然后采集每头牛卵巢上的最大卵泡(8~10 mm)与第二大卵泡(5~8 mm),置于4 ℃杜氏磷酸缓冲液(DPBS)中,带回动物繁殖生理实验室。
1.2 方法
1.2.1 DF和SF的筛选 将采集到的6头牛的最大卵泡与第二大卵泡分别放到6个盛有生理盐水的培养皿中,抽取卵泡液并使用ELISA试剂盒(上海蓝基生物科技有限公司)测定E2和孕激素(P),根据最大卵泡和第二大卵泡卵泡液中E2和P的比值筛选出DF和SF,分别刮取其中的颗粒细胞。
1.2.2 总RNA提取、文库构建及测序 用RNA微量提取试剂盒(QIAGEN公司,德国)提取3头牛DF和SF颗粒细胞中的总RNA并纯化,使用Agilent Bioanalyzer 2100检测总RNA的完整性,Qubit 2.0 Flurometer测量浓度后,由北京诺和致源生物信息科技有限公司进行文库构建、Illumina测序。
1.2.3 测序数据组装及分析 将Illumina测序获得的原始reads去除质量低的、含N的、接头等序列后,获得干净reads。干净序列从头组装后得到unigenes序列,同时使用SOAP V2.0软件将其比对到牛的参考基因组数据库中,此时获得mRNA。使用DESeq 2对获得的mRNA进行差异表达分析,同时筛选出牛卵泡发育相关上调表达基因。用DAVID软件对获得的上调表达基因进行GO分析及KEGG信号通路分析。
1.2.4 反转录及引物合成 将Illumina测序剩余的总RNA反转录成cDNA,反应条件:42 ℃ 15 min,85 ℃ 5 s。通过GeneCards数据库对获得的上调表达基因进行功能分析后,筛选6个可能与牛卵泡发育相关的基因,使用NCBI设计引物(表1),以β-actin作为内参基因,引物由生工生物工程(上海)股份有限公司合成。

表1 供试引物序列Tab.1 Primer sequences for test
1.2.5 实时荧光定量PCR分析 采用实时荧光定量PCR方法对牛DF与SF颗粒细胞中差异表达上调基因mRNA的相对表达情况进行验证。每个样品设5个重复,根据TransStart®Tip Green qPCR SuperMix(北京全式金生物技术有限公司)使用说明书构建20 μL PCR反应体系:模板cDNA 4 μL,上下游引物各0.5 μL,SYBR Mix 10 μL,H2O 5 μL。反应程序:94 ℃预变性1 min;94 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,45个循环。结果采用2-△△CT法计算,经SPSS 17.0软件进行显著性分析。
2 结果与分析
2.1 牛DF和SF筛选结果
参照文献[17]中筛选DF和SF的方法(最大卵泡卵泡液中E2/P>1,第二大卵泡卵泡液E2/P<1),对每头牛的最大卵泡和第二大卵泡卵泡液中E2和P进行测定,筛选出3头牛的DF和SF(表2)。后续试验采用这3头牛的DF和SF颗粒细胞进行测序。
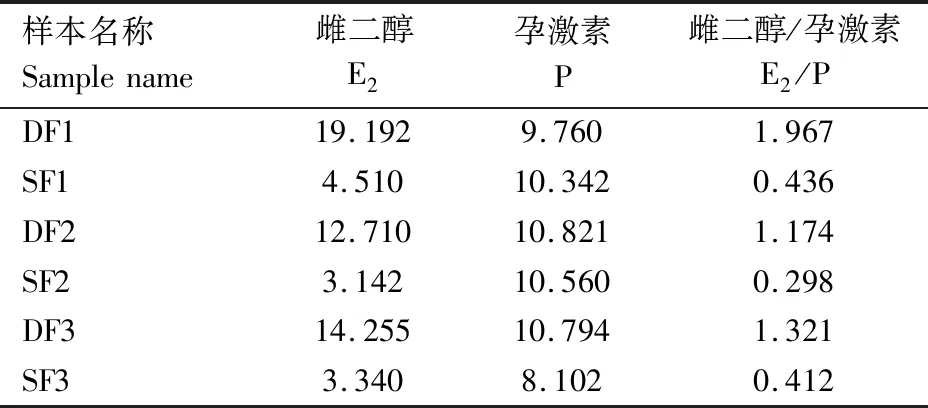
表2 牛DF和SF卵泡液中E2和P的测定结果Tab.2 Results of E2 and P in DF and SF follicular fluid in cattle
2.2 牛卵泡颗粒细胞中差异表达基因筛选
将测序结果与牛的参考基因组数据库进行比对,获得32 346个基因,分别将DF和SF颗粒细胞中的FPKM进行标准化,其中FPKM≥0.5的基因有13 243个。使用DESeq 2软件对获得的13 243个高表达基因进行差异表达分析,共得到194个上调表达基因,表3列出了其中差异表达倍数最高的20个基因及其功能。
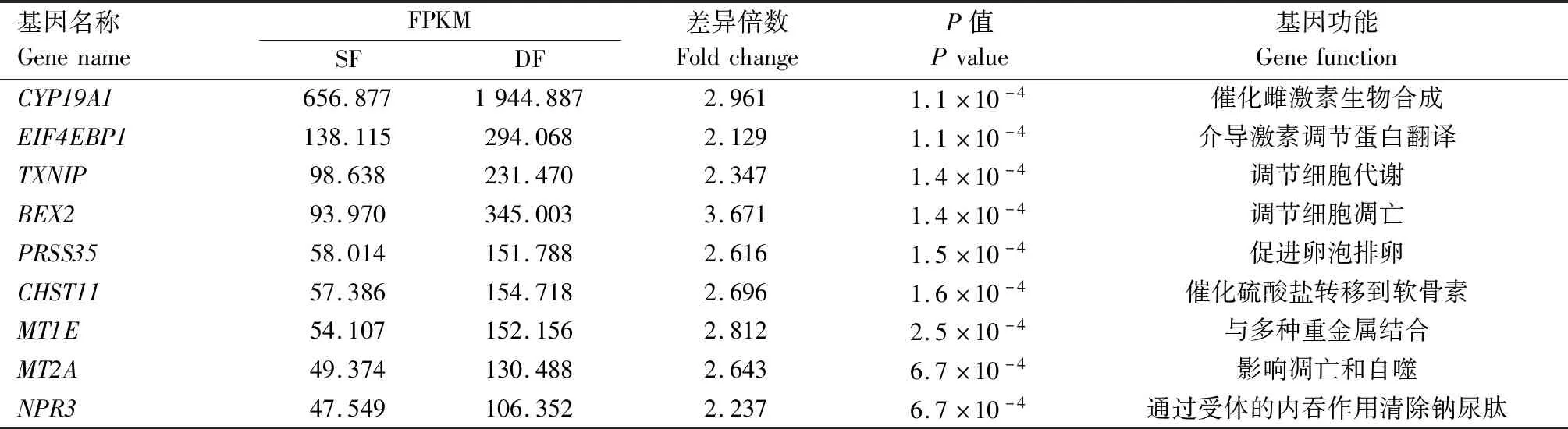
表3 牛DF和SF颗粒细胞中差异倍数最高的20个基因Tab.3 Top 20 genes of fold change between DF and SF GCs in cattle

续表3 牛DF和SF颗粒细胞中差异倍数最高的20个基因Tab.3(Continued) Top 20 genes of fold change between DF and SF GCs in cattle
2.3 牛卵泡颗粒细胞中表达上调基因GO及KEGG分析
通过对牛卵泡颗粒细胞中上调表达基因进行GO功能富集分析,从而对可能促进卵泡发育的基因进行分类。应用DAVID软件对获得的194个表达上调基因进行GO分析,共分为3大类33组,其中参与生物学过程(Biological process)的基因占60.6%;与细胞组分(Cellular component)有关基因占21.2%,其中31个基因参与细胞质功能;与分子功能(Molecular funtion)相关的基因占18.2%,其中18个基因参与金属离子结合(表4)。
为了进一步得到促进卵泡发育有关基因的信号通路,使用DAVID软件对表达上调基因进行KEGG信号通路分析,共发现4条通路(表5),其中基因富集最为显著的是轴突导向通路。
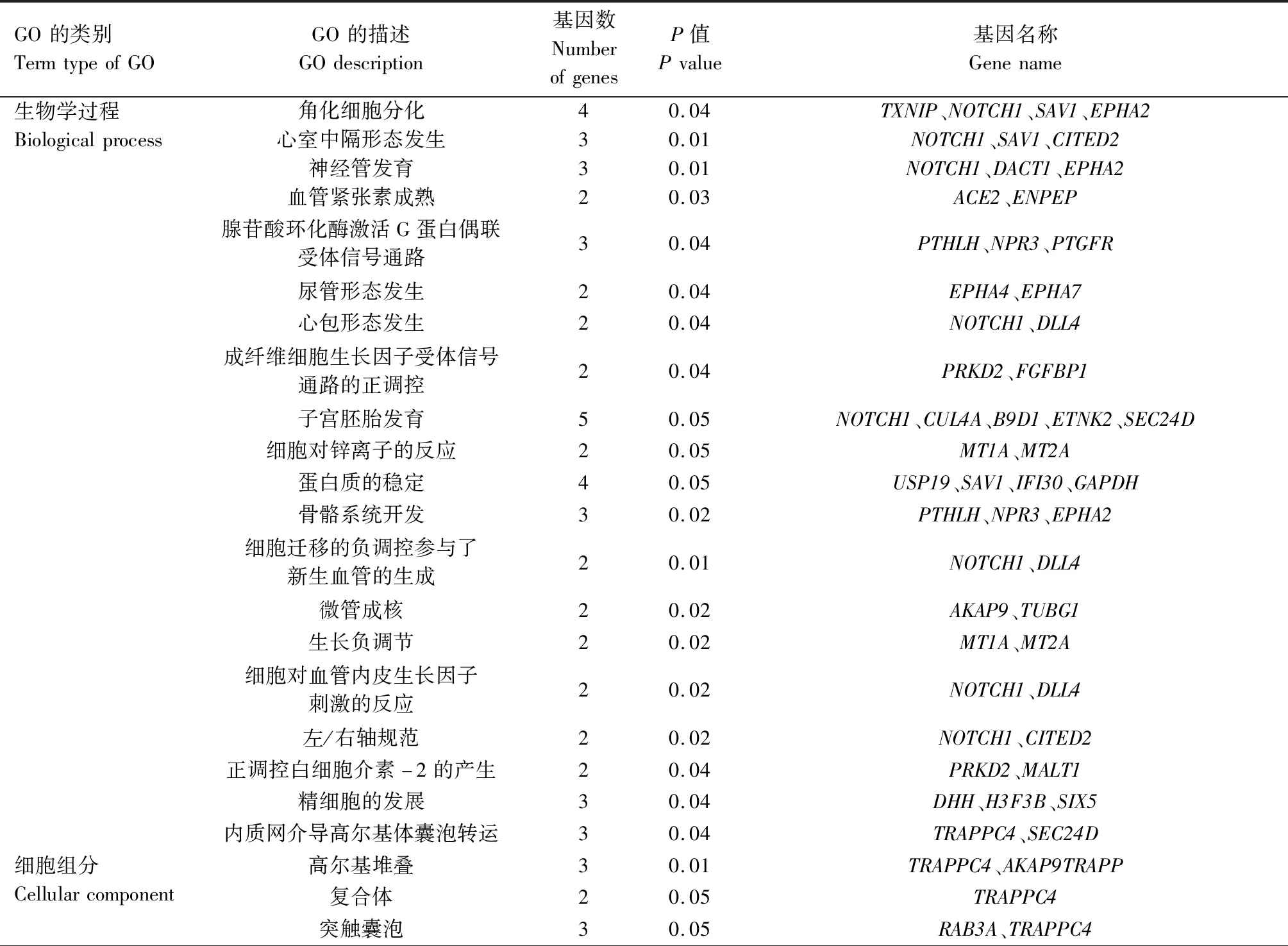
表4 牛DF和SF颗粒细胞中上调表达基因GO分析Tab.4 GO analysis of up-regulated genes in DF and SF GCs in cattle
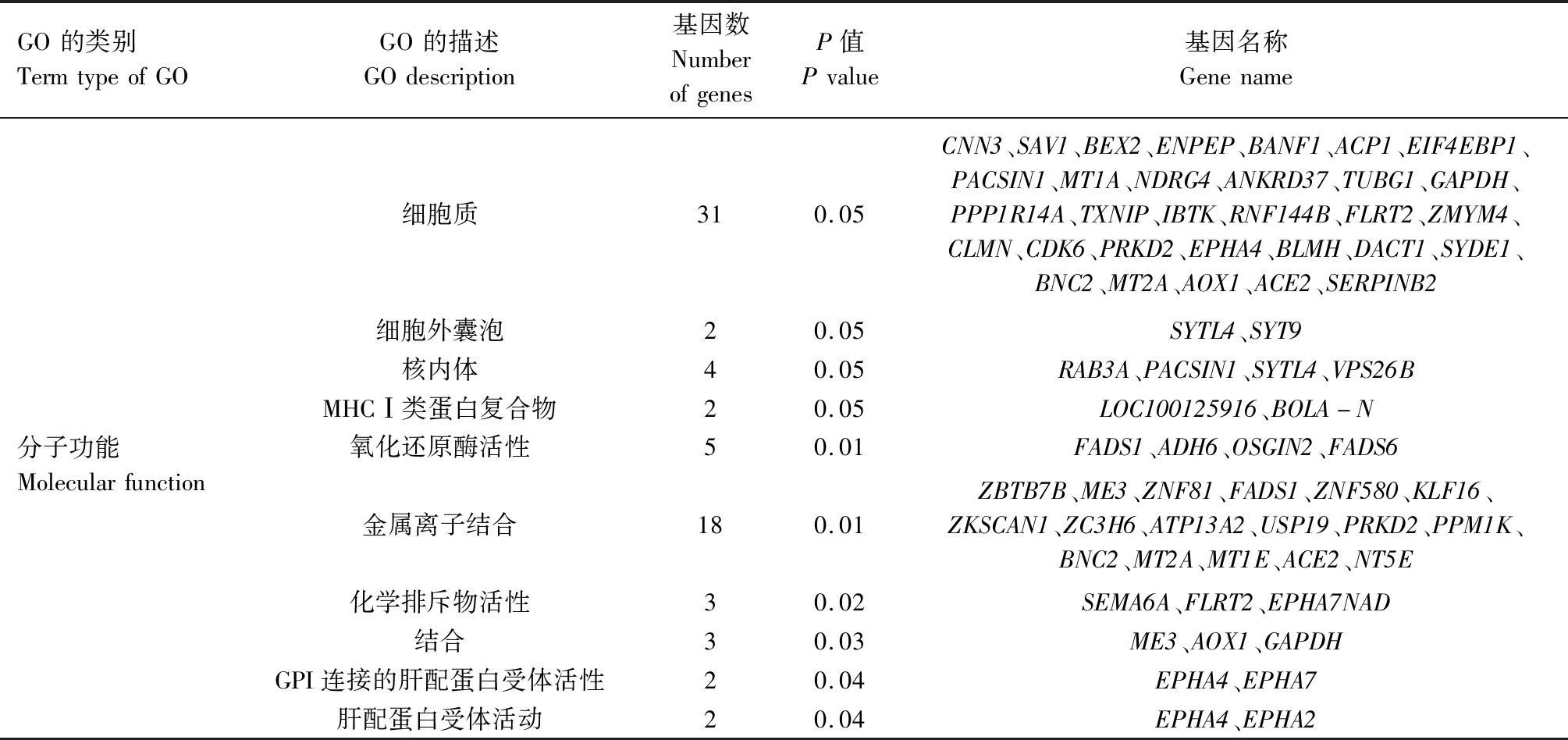
续表4 牛DF和SF颗粒细胞中上调表达基因GO分析Tab.4(Continued) GO analysis of up-regulated genes in DF and SF GCs in cattle
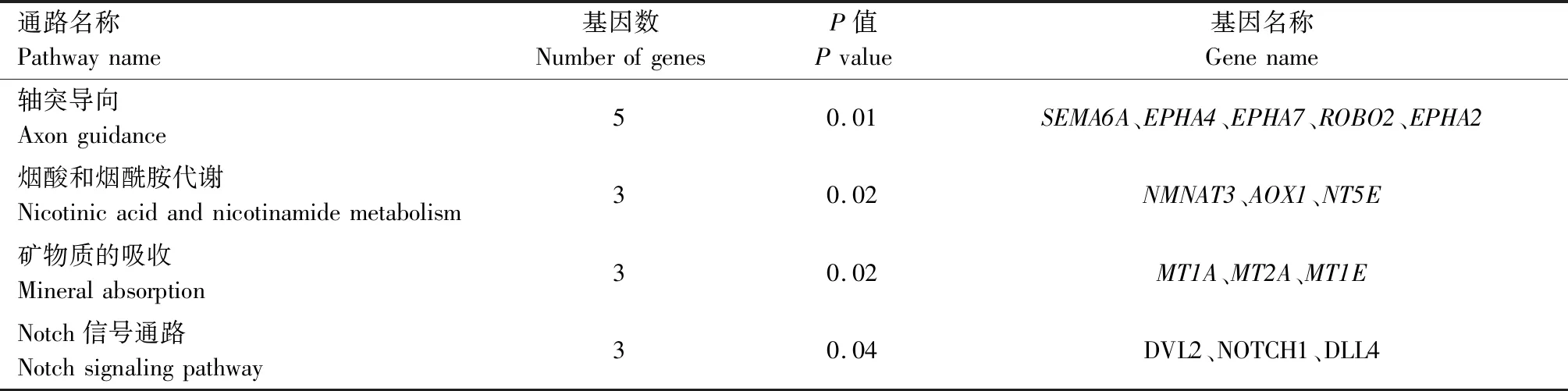
表5 上调表达基因KEGG信号通路分析Tab.5 KEGG pathway analysis of up-regulated genes
2.4 实时荧光定量PCR分析
通过对筛选出来的6个具有代表性的上调表达基因进行相对定量分析,结果(图1)表明,CYP19A1

**和*分别表示在P<0.01和P<0.05水平上差异显著** and *represent significant difference at P<0.01 and P<0.05,respectively图1 候选上调表达基因在牛DF和SF颗粒细胞中的相对表达量Fig.1 Relative expression of candidate up-regulated genes between DF and SF GCs in cattle
在DF颗粒细胞中的相对表达量极显著高于SF(P<0.01),TXNIP、BEX2和PRSS35在DF颗粒细胞中的相对表达量显著高于SF(P<0.05),与Illumina测序表达趋势一致。EIF4EBP1和CHST11在DF和SF颗粒细胞中的表达趋势与Illumina测序结果相反,但差异不显著(P>0.05)。
3 结论与讨论
哺乳动物在发育过程中,卵巢上最大的卵泡,即未来的优势卵泡持续生长、成熟并排出卵子[18]。有腔卵泡的生长,表现为通过在时间和空间上的有序组织来促进对促性腺激素的响应,这首先导致卵泡募集,并伴随着卵泡波的出现,然后促进优势卵泡生长成为排卵卵泡[19]。研究表明,FSH和IGF-1等内分泌因子是有腔卵泡发育的主要驱动因素[20]。但在每个卵泡波中,促进卵泡发育成为优势卵泡并排卵的分子调控机制尚不清楚。AUSTIN等[21]的研究结果表明,在牛发情周期的第1个卵泡波中,闭锁卵泡分泌E2的能力会减弱。ASSEY等[22]在研究优势卵泡和从属卵泡的结构时发现,卵泡液中雌激素在优势卵泡的生长发育过程中占主导作用;从属卵泡最终会走向闭锁,卵泡液中主要是P占主导作用。本研究分别测定最大卵泡与第二大卵泡中E2和P的浓度,采取最大卵泡卵泡液中E2/P>1和第二大卵泡卵泡液中E2/P<1来确定优势卵泡和从属卵泡。
LI等[23]应用Illumina测序技术对水牛不同大小的卵泡(直径小于5 mm、5~8 mm、8~12 mm及大于12 mm)颗粒细胞进行研究发现,卵泡的成熟和排卵可能会受到免疫控制。本研究通过对牛的优势卵泡和从属卵泡颗粒细胞进行测序,获得194个上调表达基因。分别对上调表达基因进行GO功能富集、KEGG信号通路分析,从中筛选出6个基因,在牛的卵泡发育过程中可能会起促进作用。实时荧光定量PCR验证分析结果显示,CYP19A1在DF颗粒细胞中的相对表达量极显著地高于SF (P<0.01),PRSS35、BEX2和TXNIP在优势卵泡颗粒细胞中的相对表达量显著地高于从属卵泡 (P<0.05),与Illumina测序所得到的结果基本一致。
CYP19A1作为细胞色素 P450 超家族蛋白成员之一,在雄激素合成雌激素过程中起到了重要的催化作用。FSH促进颗粒细胞表达CYP19A1,将膜细胞分泌的雄激素转化为雌激素。BAO等[24]将小鼠CYP19A1基因敲除后发现,卵泡丧失了分泌雌激素的功能,但仍然能够对外源雌激素产生应答。敲除掉CYP19A1基因的小鼠,卵泡发育止步于腔前卵泡,从而导致小鼠不能排卵[25]。WAHLBERG等[26]通过基因芯片技术研究与小鼠排卵相关的蛋白酶时发现,PRSS35在排卵卵泡颗粒细胞中表达量极高,对卵泡排卵以及黄体的形成和退化起了促进作用。本研究中,PRSS35在牛DF中的表达量显著高于SF,PRSS35作为上调基因促进卵泡生长,与WAHLBERG等[26]的研究结论相符。BEX2是BEX家族中重要的成员之一。ZHOU等[27]研究发现,BEX2可以促进U251细胞的增殖,敲除BEX2则会导致U251细胞凋亡。MENG等[28]研究发现,降低BEX2的表达会引起线粒体凋亡,从而使细胞周期阻滞于G1期,导致细胞凋亡。本研究发现,TXNIP在DF颗粒细胞中的表达量显著高于SF,推测其可能会促进卵泡的发育并导致排卵。
本研究在牛DF和SF颗粒细胞中共获得194个上调表达基因,结合功能分析,共筛选出6个卵泡发育相关上调的基因,并进行实时荧光定量PCR验证,CYP19A1、TXNIP、BEX2和PRSS35在牛DF颗粒细胞中表达水平均比SF高,这些基因可能会促进卵泡的发育,最终引起卵泡排卵。
