外周P2X3 受体介导不同类型疼痛的作用差异探析*
2020-06-18蔡杨乾施任怡杜俊英房军帆何晓芬林咸明方剑乔
蔡杨乾 施任怡 周 游 杜俊英 房军帆 何晓芬 林咸明 梁 宜,2 方剑乔
(1 浙江中医药大学第三临床医学院浙江省针灸神经病学重点实验室,杭州 310053;2 浙江中医药大学附属第三医院针灸科,杭州 310005)
疼痛作为继呼吸、脉搏、血压、体温之后的第五个生命指征,也是临床最常见的症状之一,常与其他疾病伴随发生,严重影响病人正常工作和日常生活,极大地降低病人的生活质量。据统计我国有慢性疼痛病史者大约占人口20%~30%;大多数慢性疼痛病人在服用非甾体抗炎药 (nonsteroidal anti-inflammatory drugs, NSAIDs) 或阿片类药物后,虽然能在一定程度上缓解疼痛,但是NSAIDs 和阿片类药物带来的药物不良反应不可忽视,干扰着临床慢性疼痛的治疗。已有研究证实,外周 P2X3 受体在初级感觉神经元介导的痛觉传入中发挥重要作用[1],参与不同类型病理性疼痛的发生和维持。药理学研究也证实,鞘内注射 P2X3 选择性受体拮抗剂A-317491 或 P2X3 受体基因siRNA 可有效缓解多种神经病理性疼痛[2,3]。然而外周P2X3 受体在不同类型病理性疼痛模型的表达时效性是否存在差异,尚未见报道。本文综述相关研究文献,以期揭示不同疼痛模型的外周P2X3 受体变化特征,初步揭示其在不同病理性疼痛的作用差异,以及为后期研发镇痛相关药物寻找靶点。
一、P2X3 受体结构、分布和特性
1. P2X3 受体结构和分布
P2X3 受体在单一亚基上存在4 个腺苷三磷酸 (adenosine triphosphate, ATP) 结合位点,由2 个跨膜结构域、位于胞内的N 末端和C 末端、位于胞外环结构的保守序列构成。P2X3 受体可由背根神经节 (dorsal root ganglion, DRG) 胞体合成后转运到外周端和中枢端,外周端分布在DRG 神经元、三叉神经节 (trigeminal ganglia, TG) 神经元等初级感觉神经元上,中枢端轴突末梢投射入脊髓背角的II 层深部、脑干和中脑导水管周围灰质[4]。有研究证实,外周P2X3 受体高选择性地表达在 DRG、TG 等初级感觉神经元,尤其以中小型神经节细胞为主[5]。
2. P2X3 受体的特性
ATP 作为体内的一种供能物质,也是广泛存在于周围和中枢神经系统的神经递质,与疼痛密切相关。嘌呤与嘧啶受体包括P1 和P2 受体,腺苷为腺嘌呤核苷酸前体和代谢产物,主要激活P1 受体,而ATP 及其类似物和UTP 等作用于P2 受体。P1受体又称为腺苷受体,包括A1、A2a、A2b 和A3四个亚型,为G-蛋白偶联型受体 (G protein couple receptor, GPCRs);P2 受体又称为ATP 受体,分为P2X 和P2Y 受体两大类[6]。
P2X 受体为配体门控性离子通道 (ligand gated ion channels, LGICS) 型受体,与胞外ATP 结合,允许Na+、K+、Ca2+等阳离子通透,目前已明确有7种P2X受体亚型,P2X3受体是其中的7个亚型之一。P2X3 受体为配体门控非选择性阳离子通道受体,能与胞外的ATP 选择性结合[7]。ATP 将其激活后,允许Na+、K+、Ca2+通过,尤以Ca2+的通透性最为明显,在伤害性信息的产生、传递中起着重要的作用。当机体受到伤害或神经损伤后释放大量ATP,释放的ATP 可作用于感觉神经元上的 P2X3 受体,诱发 P2X3 受体的去极化,从而激活 P2X3 受体从细胞质转移到细胞膜,使其膜表达增加[8],进而参与伤害性信息传递和痛觉敏化。
二、外周 P2X3 受体与疼痛
1. 激活外周 P2X3 受体介导疼痛发生
近年来大量研究表明外周 P2X3 受体在炎性痛、神经病理性疼痛以及骨癌痛中发挥重要作用,外周 P2X3 受体表达增加可诱发大鼠的机械痛觉过敏,导致疼痛发生。Liu 等[9]进一步研究发现,P2X3 受体是通过介导神经元钙通道 VILIP-1 在背根神经节表达上调,增加神经元兴奋性,参与癌痛的产生。另有研究发现[10]在大鼠足底注射 P2X3受体激动剂 α, β-meATP 后,可观察到剂量相关的急性伤害性反应,比如大鼠的抬足、缩足和舔足等反应。在炎性痛、神经病理性痛和骨癌痛大鼠的足底注射一定剂量的α, β-meATP 后,均可增强大鼠缩足、舔足等伤害性行为反应。因此,笔者认为激活外周P2X3 受体可以诱发大鼠的痛觉过敏,介导疼痛的发生。
2. 抑制外周 P2X3 受体发挥镇痛效应
通过P2X3 受体基因沉默[3]、鞘内注射P2X3 选择性受体拮抗剂A-317491[2]、鞘内注射反义寡核苷酸[11]等抑制外周P2X3 受体表达或活性,可以显著减轻痛觉过敏,发挥镇痛效应。有研究发现[2]大鼠鞘内注射 P2X3 选择性受体拮抗剂A-317491 后,可明显减轻由弗氏佐剂诱发的机械痛觉过敏反应。另有研究发现鞘内注射特异性P2X3 受体拮抗剂A-317491 或P2X3 受体反义寡脱氧核苷酸后,大鼠DRG 上的P2X3 受体蛋白表达显著降低,且大鼠患侧的机械痛觉过敏减轻,缓解了大鼠的骨癌痛[12,13]。因此,通过抑制外周P2X3 受体的活化可能减轻大鼠痛觉过敏,达到镇痛的效果。
三、外周P2X3 受体活化与不同类型病理性疼痛的作用
1. 外周P2X3 受体与炎性痛
P2X3 受体活化是介导炎性痛敏反应的主要物质之一。炎性因子前列素E2可以直接激活蛋白激酶 (Protein Kinase C, PKC),磷酸化的PKC 进一步增加P2X3 瞬时电流,引起炎性痛的痛觉过敏。在急性和慢性炎性痛模型中,P2X3 受体表达与大鼠痛阈变化密切相关[14~16]。有研究发现鞘内注射P2X3 受体选择性拮抗剂A-317491[2]或反义寡核苷酸[11],可明显减轻由完全弗氏佐剂 (complete freund's adjuvant, CFA) 诱发的各种痛觉过敏反应、降低慢性炎症所致的热痛觉过敏和机械性痛觉过敏。但在角叉菜胶诱发的急性炎性痛大鼠鞘内注射A-317491 仅能减轻机械痛觉过敏,对于热痛觉过敏无影响[17,18]。P2X3 受体介导急、慢性炎性痛在时间点上存在差异:在角叉菜胶诱发的急性炎性痛模型中,P2X3受体活化与大鼠痛阈改变在时间上存在不对等性,与CFA 诱发的慢性炎性痛有所不同。基于现有研究结果,认为 P2X3 受体参与急、慢性炎性痛的发生、发展和维持(见表1)。
2. 外周 P2X3 受体与神经病理性疼痛
神经病理性疼痛由躯体感觉神经系统的损伤或疾病而直接造成的疼痛,是一种慢性疼痛,主要病理特征为自发的持续性或多变性疼痛、痛觉过敏和痛觉超敏。在三种常用神经病理性疼痛模型中外周P2X3 受体表达各异:脊神经结扎 (spinal nerve ligation, SNL) 致神经病理性疼痛大鼠受损 (L5-6) DRG中P2X3 受体表达降低,而未受损 (L4) DRG 中表达增加;而坐骨神经慢性结扎损伤 (chronic constriction injury, CCI)、保留性坐骨神经损伤 (spared nerve injury, SNI) 致神经病理性痛大鼠 DRG P2X3 受体表达则显著增强[20,21,24]。有研究报道,在 CCI 致神经病理性痛大鼠背根神经元应用非选择性P2X 受体拮抗剂Suramin 能明显抑制神经元ATP 反应电流[21]。环氧合酶抑制剂能够减少 CCI 致神经病理性疼痛大鼠 DRG 神经元中 P2X3 受体的表达以及降低痛觉过敏[25]。在SNL 致神经病理性疼痛大鼠鞘内注射反义寡核苷酸,可以抑制大鼠机械痛觉过敏的发展[11]。由此推测 P2X3 受体可介导神经病理性疼痛,但受损神经元上的 P2X3 受体可能不参与神经病理性疼痛的发生(见表2)。
3. 外周 P2X3 受体与骨癌痛
骨癌痛 (bone cancer pain) 由原发性肿瘤或其他部位肿瘤的骨转移所致,具有自发痛、痛觉过敏、痛觉超敏等特征,是一种顽固的难治性疼痛。骨癌痛属于混合型疼痛,兼有神经病理性疼痛、炎性疼痛等病理特征,但又不同于这两种疼痛[26]。肿瘤细胞中所含异常高水平的ATP 可能通过机械应力释放,激活附近的痛觉神经纤维的 P2X3 受体[27]。在骨肿瘤中,阻断机械门控离子通道或应用 ATP 受体的拮抗剂可减少运动相关的疼痛[28]。在常用的大鼠骨癌痛模型造模方法中选用Walker256 和MRMT-1乳腺癌细胞诱发的骨癌痛模型证实DRG P2X3 受体活化和大鼠痛阈变化密切相关[10,12,29](见表3)。鞘内注射特异性P2X3 受体拮抗剂A-317491 或反义寡脱氧核苷酸能够显著减轻骨癌痛大鼠机械痛觉过敏[12,13]。
四、展望
综上所述,目前公认 P2X3 受体参与多种类型疼痛的发生和维持,然而外周 P2X3 受体在不同类型疼痛中表达规律并不相同:在炎性疼痛和骨癌痛中外周 P2X3 受体表达明显增加,而在神经病理性疼痛中 P2X3 受体表达增加与否与神经元是否损伤密切相关。P2X3 受体被认为是由DRG 神经元合成,可通过神经轴突传输至周围神经末梢介导外周痛敏化。据此,推测保持神经轴突的完整性是 P2X3 受体参与外周痛敏化的物质基础。已有研究报道,在 SNL 致神经病理性疼痛模型大鼠 L4中小型 DRG神经元的 VR1 表达增加,而 P2X3 受体表达没有变化[33],该研究结果也提示当神经轴突或神经元损伤时,P2X3 受体并非是介导疼痛的关键物质,VR1等其他致痛物质可能成为介导疼痛的关键物质。因此,P2X3 受体与其他类型致痛物质在外周痛敏化或是不同疼痛阶段是否扮演不同角色?这或许将成为今后外周痛敏化的亮点之一。另一方面,已有研究认为 P2X3 受体作为膜受体,其内吞和膜转运在疼痛发生和维持中至关重要[34],推测 P2X3 受体的膜转运及其轴突转运可能是外周痛敏化的关键,其内在关键机制研究或许是 P2X3 受体与疼痛相关性研究中的新热点。深入研究 P2X3 受体在外周和中枢痛敏化中的作用规律及其潜在机制,将有助于全面了解 P2X3 受体在疼痛中的角色担当,也为后期研发镇痛相关药物找到潜在的靶点。

表1 常见炎性痛模型及外周 P2X3 受体表达情况

表2 常见神经病理性疼痛模型及外周 P2X3 受体表达情况
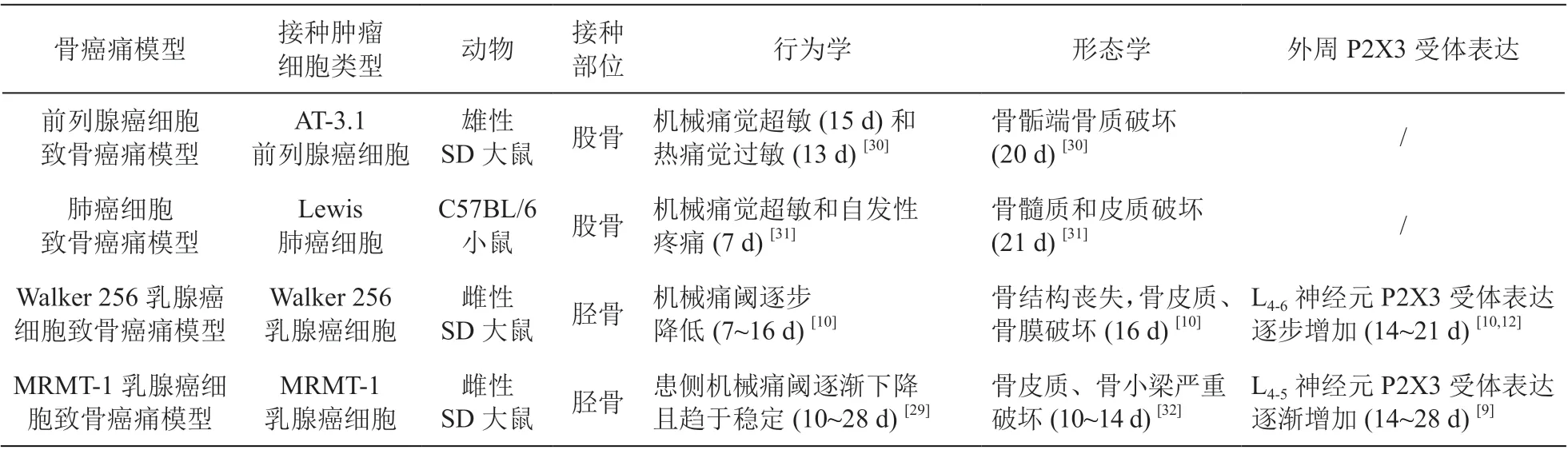
表3 常见骨癌痛模型及外周 P2X3 受体表达情况
