基于GC/MS的皮肤T细胞淋巴瘤(CTCL)异种移植小鼠血浆和皮肤组织的代谢组学分析
2020-06-17曹宜青沈小雁康宏艳乐云辰郁韵秋
曹宜青 沈小雁 曹 涵 康宏艳 乐云辰 梁 栋 郁韵秋△
(1复旦大学药学院药物分析教研室 上海 201203;2上海交通大学医学院瑞金医院皮肤科 上海 200025;3无锡生物制剂(上海)有限公司 上海 201203)
皮肤T 细胞淋巴瘤(cutaneous T-cell lymphoma,CTCL)是一种由T 淋巴细胞克隆浸润引起,以皮肤病变为主要表现的非霍奇金淋巴瘤。临床上CTCL常见的亚型有蕈样肉芽肿、Sezdry 综合征和原发性皮肤外周 T 细胞淋巴瘤[1]。CTCL 的发病机制尚不明确,其临床表型与炎症性皮肤病相似,早期诊断困难[2]。目前CTCL 的主要诊断方式是组织病理学活检、分子分析和外周血染色体检查,缺少非侵入性检查手段[3]。
代谢组学是“组学领域”的重要组成部分,通过对生物体内代谢物的定性和定量分析来寻找代谢物与生理病理变化的相关关系[4]。近年来,多组学技术已被用于CTCL 的诊断,比如利用基因组学分析 诊 断 CTCL[5-6]。 LC/MS 和 GC/MS 是代 谢 组 学分析中应用最广泛的两种分析方法,两者识别出的差异代谢物既有区别又有联系。我们基于GC/MS和LC/MS 对CTCL 人血样进行研究,结果显示CTCL 的发病机制与磷脂异常有关[7],进一步考虑进行皮肤组织样本的分析,但由于人病变组织不易获得,因此本研究采用CTCL 荷瘤鼠的血浆和肿瘤组织分别进行GC/MS 的代谢组学分析,并对LC/MS[8]和 GC/MS 找出的差异代谢物进行对比、分析和关联,从而为进一步研究CTCL 提供依据。
材料和方法
试剂和细胞甲醇、乙腈(HPLC 级)、肝素钠购自上海国药控股化学试剂有限公司;正庚烷购自阿拉丁生化科技有限公司(上海);十三酸、吡啶(HPLC 级)、甲氧基胺盐酸盐、N-甲基-N-(三甲基硅烷基)三氟乙酰胺(MSTFA)、三甲基氯硅烷(TMCS)、RPMI 1640 培养基(ATCC 302001)、HH细胞(T cell Lymphoma ATCC CRL-2105)、青霉素-链霉素溶液(SV30010,10 000 U/mL 青霉素:10 000 U/mL链霉素)、胎牛血清(F2442-500 mL)和二甲亚砜(色谱纯)购自美国SigmaAldrich 公司。
CTCL 异种移植小鼠HH 细胞培养和CTCL异种移植小鼠模型与本课题组前期研究[8]相同。动物实验均符合复旦大学动物实验伦理标准要求。实验动物合格证号:伦药批第(2018-12-YF-YYQ-01)号。对照组:健康小鼠(n=5);实验组:CTCL 荷瘤鼠(n=16)。取小鼠眼眶血,加肝素钠抗凝,1 600×g离心10 min,留取血浆。
HH 细胞皮下注射于雌性裸鼠的右侧腋下,小鼠皮肤组织分别取自对照组小鼠的右腋下皮肤,实验组小鼠皮肤肿瘤组织近端(荷瘤鼠右腋下)、肿瘤组织远端(荷瘤鼠左腋下)和肿瘤组织。
血浆处理取血浆50 μL 至离心管,室温下解冻 15 min,加 200 μL 的-20 ℃ 甲醇(含 40 μg/mL 十三烷酸),涡旋 5 min,静置 10 min,12 000×g下离心15 min,取上清液40 ℃下氮气吹干,残余物衍生化,12 000 ×g下离心 5 min,上清液转至 GC/MS 进行分析。
组织处理向EP 管加入-20 ℃甲醇和小鼠组织(1 mg∶50 μL),涡旋5 min,超声10 min,电子组织匀浆器(60 Hz,300 s)中匀浆,12 000×g下离心15 min,取 600 μL 上清,加入 400 μL 甲醇(40 μg/mL十三烷酸),涡旋5 min,静置10 min,12 000×g下离心 15 min,取 900 μL 上清液 40 ℃下氮气吹干,衍生化3 h,12 000×g下离心 5 min,上清液转至 GC/MS进行分析。
GC/MS 分析Agilent 7890B 气相色谱仪(含7693 自动进样器)和5977A 四极质量分析仪。色谱柱:DB-5 MS 熔融石英毛细管柱(30 m×250 μm×0.25 μm,美国 Agilent 公司)。程序升温:初始 70 ℃保持 3 min,之后 5 ℃/min 升至 300 ℃保持 5 min。氦气载气流量:1.2 mL/min;进样体积:1 μL;分流比:2∶1;入口温度:300 ℃;界面温度:280 ℃;离子源温度:230 ℃。
数据采集及处理通过MassHunter定性分析软件(B.06.00)将原始数据转换为mzData 格式,转换后的数据上传到XCMS-Online(https://xcmsonline.scripps.edu)进行数据过滤,峰对齐和保留时间校正。峰强度校正后,使用“80%规则”筛选数据。数据预处理 后 用 SIMCA 13(Umetrics,Sweden)进 行 统 计分析。
将筛选出的代谢物上传至NIST 数据库和人类代谢组数据库(HMDB,http://www.hmdb.ca)进行比对,部分采用标准品进行结构验证。使用热图(GraphPad)分析以观察不同组之间差异代谢物的变化。通过Medcalc 软件构建接受者操作特征曲线(ROC)以评估差异代谢物的灵敏度和特异性。采用 MetaboAnalyst 3.0(http://www.metaboanalyst.ca/)进行差异代谢物的代谢通路分析。
结 果
原始数据的质量控制和TIC 图所有血浆样品和组织样品的保留时间偏差分别为4 s 和1.2 s,说明所采用的分析方法(包括色谱条件)具有良好的重现性(图1、2)。原始数据包括含有1 704 个特征离子的21 个血浆样本,含有1 016 个特征离子的50 个组织样本,数据过滤后,得到1 047 个和653 个特征离子。

图1 对照组与CTCL 组小鼠血浆样品和组织样品的保留时间偏差Fig 1 Retention time deviation plots of plasma and tissue samples of mice in control group and CTCL group

图2 CTCL 组小鼠血浆和组织样品的重叠TICFig 2 The overlapping TICs of plasma and tissue samples in mice of CTCL group
数据的多变量统计分析在血浆样品的CTCL组和对照组间,PCA 分离不明显,其R2X=0.474,Q2=0.204(图 3A);PLS-DA 分离明显,其 R2X=0.314,R2Y=0.944,Q2=0.576(图 3B);OPLS-DA 分离 明显,其 R2X=0.630,R2Y=1.000,Q2=0.672(图 3C)。200 次交叉排列验证结果表明,PLS-DA 分析模型具有可靠的预测能力(R2:0,0.809;Q2:0,-0.003 73)(图3D)。
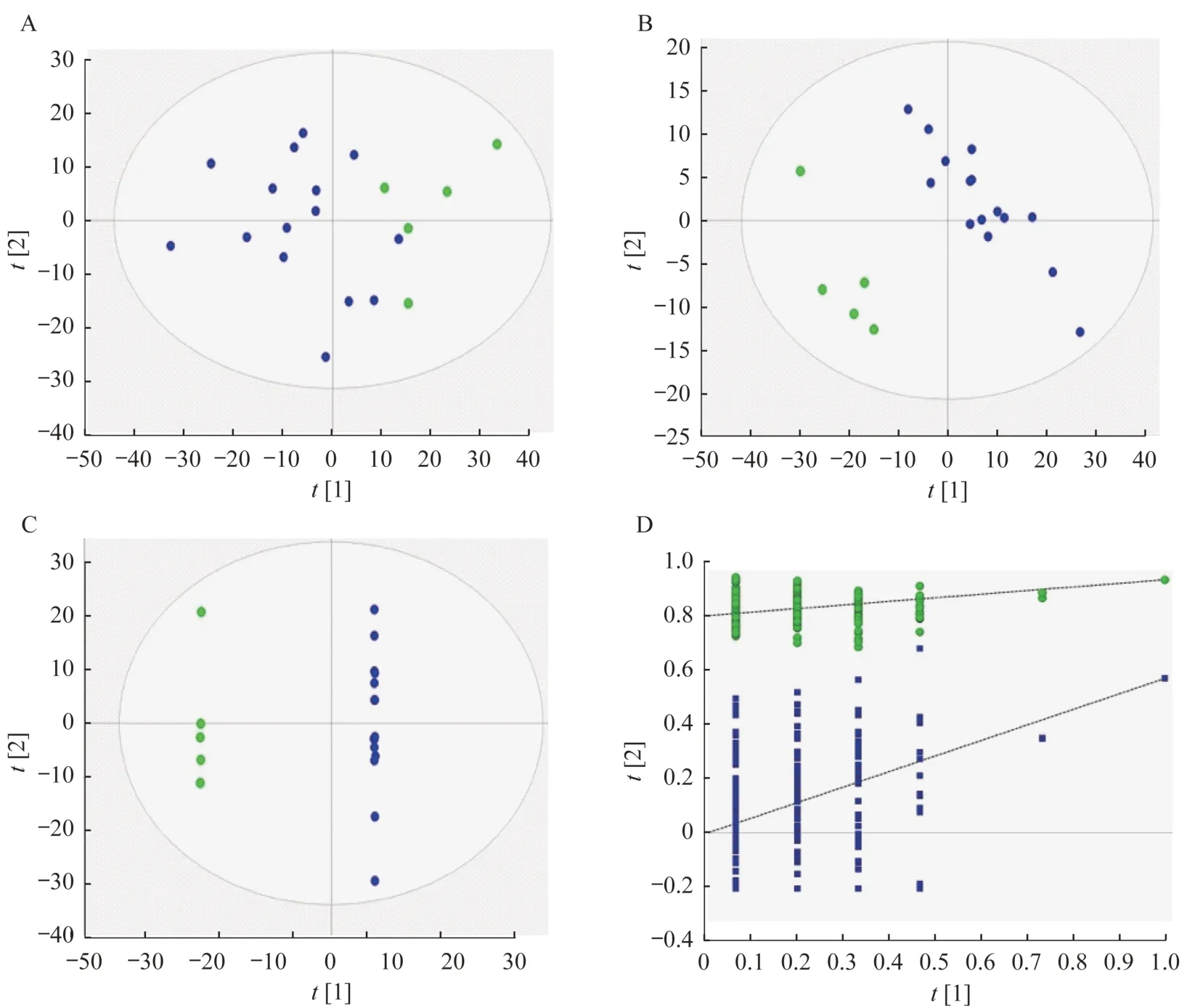
图3 对照组与CTCL 组小鼠血浆PCA、PLS-DA 及OPLS-DA 分析Fig 3 PCA,PLS-DA and OPLS-DA analysis of plasma of mice in control group and CTCL group
在组织样品中,PCA 显示肿瘤组和其他3 组间有显著差异(R2X=0.868,Q2=0.721),但是对照组与肿瘤组织远端(荷瘤鼠左腋下)间差异不大。为消除小鼠的个体差异,进一步观察CTCL 小鼠自身的肿瘤组织和肿瘤组织远端(荷瘤鼠左腋下)。PCA(R2X=0.748,Q2=0.618)、PLS-DA(R2X=0.531,R2Y=0.955,Q2=0.916)和 OPLS-DA(R2X=0.613,R2Y=0.977,Q2=0.939)的得分图和拟合参数均显示出肿瘤组织远端组和肿瘤组有明显分离(图4)。对 PLS-DA 进行 200 次交叉检验验证,R2(0,0.350)和Q2(0,-0.304)表明该模型无过度拟合(图4)。
血浆和组织样品中差异代谢物的筛选与结构验证根据OPLS-DA 模型中的VIP值,t检验的P值和FC值(VIP≥1,P≤0.05 和FC≥1.5)选择差异代谢物(表1、2)。在血浆样品中共有29 种差异代谢物(其中两种在HMDB 中不存在),21 种经标准品得以验证,在组织样品中共有33 种差异代谢物(其中一种在HMDB 中不存在),25 种经标准品得以验证。其中13 种差异代谢物(L-缬氨酸,L-丝氨酸,L-亮氨酸,甘油,L-异亮氨酸,L-苯丙氨酸,3-磷酸甘油,D-葡萄糖,阿拉伯糖,肌醇,亚油酸,硬脂酸,胆固醇)同时存在于血浆和组织样品中(图5)。
在血浆样品中CTCL 组的乳酸和大部分氨基酸增加;油酸、硬脂酸、1-十六烷酸酯甘油和胆固醇明显减少(图6)。在组织样品中肿瘤组的3-磷酸甘油,邻磷酸乙醇胺和L-天冬氨酸显著增加;大部分氨基酸含量减少(图7)。
血浆和组织样品中差异代谢物的ROC 分析对 62 种差异代谢物作 ROC 分析(表3、4):在血浆样品中,肉豆蔻酸的AUC 值为1,表明肉豆蔻酸具有最高的特异性和灵敏度(图8);在组织样品中,多种差异代谢物的AUC 值为1(图9)。
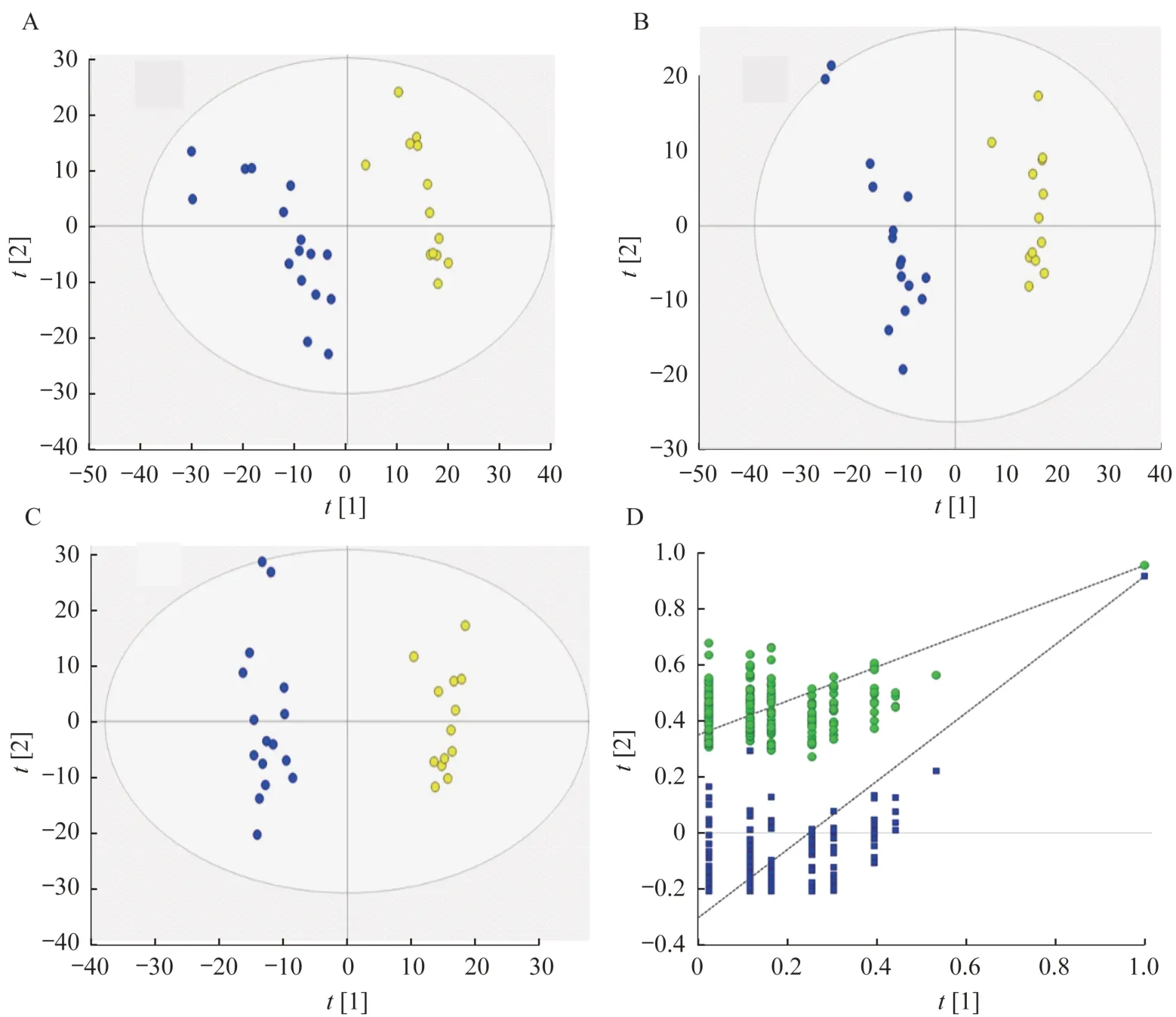
图4 CTCL 小鼠自身的肿瘤组织和肿瘤组织远端的PCA、PLS-DA 及OPLS-DA 分析Fig 4 PCA,PLS-DA and OPLS-DA analysis of tumor tissue and tumor tissue distal end in CTCL mice

图5 CTCL 小鼠血浆样品和肿瘤组织样品中检测到的差异代谢物数据的Venn 图Fig 5 Venn diagrams presenting data for differential metabolites detected in plasma samples and tumor tissue samples of CTCL mice detected by GC/MS and LC/MS respectively
血浆和组织样品中差异代谢物的Pathway 分析支链氨基酸(BCAA)和甘油磷脂代谢被认为是血浆和组织样品中最相关的代谢途径(图10)。
讨 论
多平台多样本数据相互补充和印证GC/MS和LC/MS 是目前代谢组学分析的主流技术平台。本研究采用GC/MS 分析平台,对CTCL 荷瘤鼠的血浆和肿瘤组织样品进行代谢组学分析,并将研究结果和课题组之前的研究结果[8]进行比较(图5),结果表明:血浆中的胆固醇同时在LC/MS 和GC/MS中出现,肿瘤组织中黄嘌呤和7 种氨基酸(L-天冬酰胺、L-赖氨酸、L-苯丙氨酸、L-酪氨酸、L-色氨酸、L-亮氨酸、L-谷氨酸)同时在 LC/MS 和 GC/MS 分析平台中出现。LC/MS 和GC/MS 两种分析平台对该类差异代谢物的分析均能达到较高的灵敏度,表明这两种分析方法不仅可以互补,还可以进行有效的相互验证。此外,由于代谢组学涉及的化合物性质差异较大,不同的分析平台检出的种类不同,如GC/MS 可检出乳酸和葡萄糖,LC/MS 可检出PC类和MG 类,采用多平台技术可以增加差异代谢物的覆盖面,因此在以后的研究中可以考虑将两种分析方法结合以获得更多的信息。

表1 通过GC/MS 筛选出对照组与CTCL 组小鼠血浆样品中的差异代谢物Tab 1 Identification of differential metabolites among the plasma samples of mice in control group and CTCL group by GC/MS
由于代谢途径不同,在血浆和肿瘤组织中会出现不同的差异代谢物,我们又将血浆和肿瘤组织样品的分析结果进行了比较,共同差异代谢物有13种,分别占血浆差异代谢物和肿瘤组织差异代谢物的48.3% 和42.3%;涉及的共同通路有BCAA 代谢、半乳糖代谢、亚油酸通路和甘油磷脂代谢。说明血浆和肿瘤组织样品不仅可以单独反映CTCL的局部代谢,两种样品之间的差异代谢物还较为相关。不同样本得到的差异代谢物在种类和数量上不完全相同,如在GC/MS 平台中单甘脂和棕榈酸等15 种差异代谢物只在血浆样本中出现,尿酸和磷酸乙醇胺等19 种差异代谢物只在肿瘤组织样本中出现。

表2 通过GC/MS 筛选出CTCL 小鼠自身的肿瘤组织和肿瘤组织远端样品中的差异代谢物Tab 2 Identification of differential metabolites among tumor tissue samples and tumor tissue distal end samples in CTCL mice by GC/MS
CTCL 小鼠血浆和肿瘤组织中BCAA 异常BCAA(包括缬氨酸,亮氨酸和异亮氨酸)在血浆中上调并在肿瘤组织中下调,这表明BCAA 在CTCL的恶性T 细胞增殖过程中被转运和消耗,以适应更高的蛋白质合成速率。异常BCAA 是CTCL 小鼠血浆和肿瘤组织最重要的代谢特征。

图6 对照组与CTCL 组小鼠血浆样品中代谢物的热图分析Fig 6 Heatmap of metabolites in plasma samples of mice in control group and CTCL group

图7 CTCL 小鼠自身的肿瘤组织和肿瘤组织远端组中代谢物的热图Fig 7 Heatmap of metabolites in tumor tissue group and tumor tissue distal end group in CTCL mice
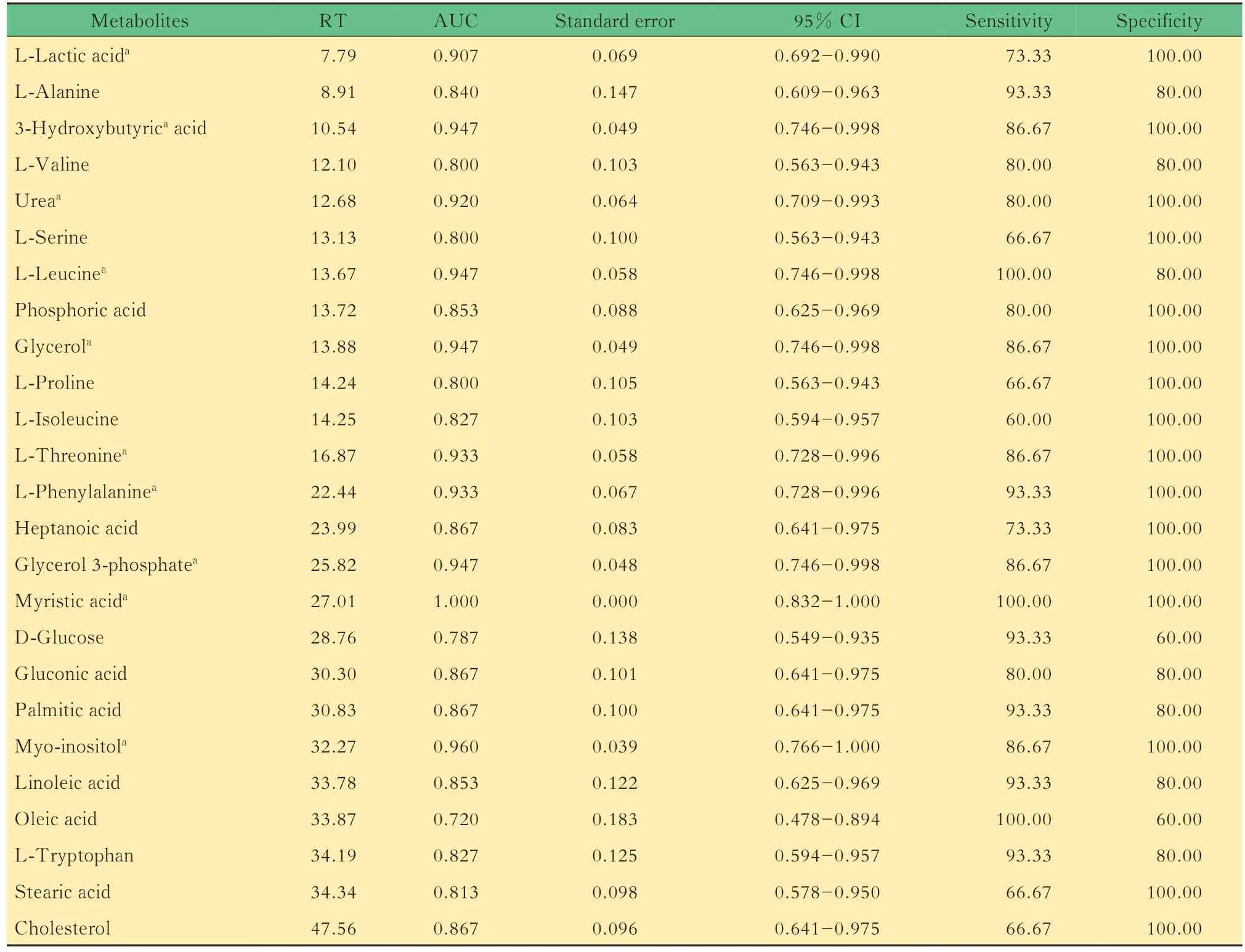
表3 对照组和CTCL 组小鼠血浆样品中差异代谢物的ROC 数据Tab 3 ROC results for differential metabolites in plasma samples of mice in control group and CTCL group

图8 对照组与CTCL 组小鼠血浆样品中部分AUC >0.9 的差异代谢物的ROCFig 8 The ROC of differential metabolites with AUC >0.9 in plasma samples of mice in control group and CTCL group

图9 CTCL 小鼠自身的肿瘤组织和肿瘤组织远端组样品中部分AUC>0.9 的差异代谢物的ROCFig 9 The ROC of differential metabolites with AUC >0.9 in CTCL mice of tumor tissue and tumor tissue distal end
BCAA(尤其是亮氨酸)可通过激活 mTORC1[9]刺激骨骼肌蛋白形成。同时亮氨酸会降低AMP 激酶(AMPK)活性,从而引发胰岛素抵抗和癌症[10]。在本研究中,亮氨酸在血浆中明显升高,在组织中明显减少,表明BCAA 可能激活mTORC1 并引发CTCL(图11)。
CTCL 小鼠血浆和肿瘤组织中3-磷酸甘油上调血浆和肿瘤组织中增加的3-磷酸甘油可能导致细胞膜降解或恶性T 细胞形态变化。小鼠血浆中3-磷酸甘油的升高与课题组之前的研究结果[8]相一致。
CTCL 小鼠血浆中葡萄糖上调体内葡萄糖含量也会影响mTORC1[10]的活性。血浆中葡萄糖的升高会抑制AMPK 通路,从而减轻TCS1/TSC2 复合物的抑制功能并激活mTORC1[11]。同样,葡萄糖也可以通过降低亮氨酸等AMPK 激酶的活性来激活mTORC1[12]。在本研究中,血浆中葡萄糖含量增加,意味着葡萄糖激活mTORC1,同时参与癌细胞的Warburg 效应,而血浆中乳酸含量增加也验证了这一点[13];肿瘤组织中葡萄糖含量降低,可认为葡萄糖通过糖酵解被消耗并转化为乳酸(图11)。

图11 基于CTCL 小鼠血浆和肿瘤组织中BCAA 异常假设的CTCL 小鼠代谢通路Fig 11 Hypothetical metabolic pathways based on BCAA abnormalities in plasma and tumor tissues of CTCL mice
CTCL 小鼠血浆o-磷酸乙醇胺被降解我们之前的研究已显示:组织中鞘氨醇-1-磷酸酯(S1P)增加会促使磷酸戊糖途径与核苷酸代谢相互作用,且与CTCL 肿瘤组织大小显著相关(Pearson 相关系数ρ=0.64)[8]。本研究显示,血浆中 S1P 降解的 o-磷酸乙醇胺含量也增加,不同样本(血浆和皮肤)的研究结果表明S1P 和o-磷酸乙醇胺的异常可能与CTCL关系密切。
