水溶液中各微粒浓度守恒关系的总结
2020-06-17谭明福
■谭明福
电解质在水溶液中存在各种变化,甚至某些微粒会以多种形式存在,但它们总会存在一些守恒关系。水溶液中各种微粒浓度的守恒关系是溶液中离子平衡的重点内容,也是溶液中各种平衡的重点考查内容,下面具体分析三种守恒关系。
1.电荷守恒
任何水溶液都是电中性的,也就是水溶液中所有阳离子所带的正电荷的总量等于所有阴离子所带的负电荷的总量。要准确写出电荷守恒式,需要注意两个问题:一是不能漏掉任何一种离子;二是找准每个离子所带的电荷数。
例如,写出K3PO4溶液中的电荷守恒式。
分析:由溶液中阴、阳离子所带的电荷总数相等,可得)。要特别注意非一价离子的化学计量数。
2.元素守恒
元素守恒本质上还是质量守恒,也称物料守恒。书写元素守恒式时要抓住两个关键问题:一是找准在变化前(包括化学反应、水解、电离等各种变化)“核心元素”(除氢、氧元素之外的其他元素都可能是)的物质的量的关系;二是找全“核心元素”的所有存在形式。
例如,写出0.1mol·L-1(NH4)2HPO4溶液中的元素守恒式。
分析:(NH4)2HPO4中的“核心元素”是N和P。部分水解,所以N 元素最终存在的形式有两种微粒,即和NH3·H2O;既有部分水解,也有部分电离,所以P元素最终存在的形式有四种微粒,即和。故0.1 mol·L-1(NH4)2HPO4溶液中的元素守恒式为。
3.质子守恒
质子守恒是指由水电离产生的H+和OH-的物质的量始终相等,但溶液中可能有其他微粒结合了H+或者OH-,使部分H+和OH-不再全部以H+和OH-的形式存在,但其总量始终保持不变。所以书写质子守恒式时,关键是把所有由水电离的H+和OH-存在的微粒形式找完整,不能多找,也不能遗漏。
例如,写出Na2CO3溶液中的质子守恒式。
分析:解决这个问题可以有多种方法。
第一种方法:按照质子守恒式的本质写。Na2CO3溶液中水电离出的H+有三种存在形式,即和H2CO3(注意每产生一个H2CO3需要两个H+),水又电离出OH-,所以质子守恒式为。
第二种方法:图示法。先找出Na2CO3溶液中所有能得到质子和失去质子的微粒,再用图示的方式列出它们得到质子和失去质子的方式和个数,最后得出结论。在Na2CO3溶液中,能得到质子的是和H2O,能失去质子的只有H2O,列出图1,由图1可得出结论,2c(H2CO3)+c(H+)=c(OH-)(得失几个质子,微粒前的化学计量数就是几;H3O+就是H+)。
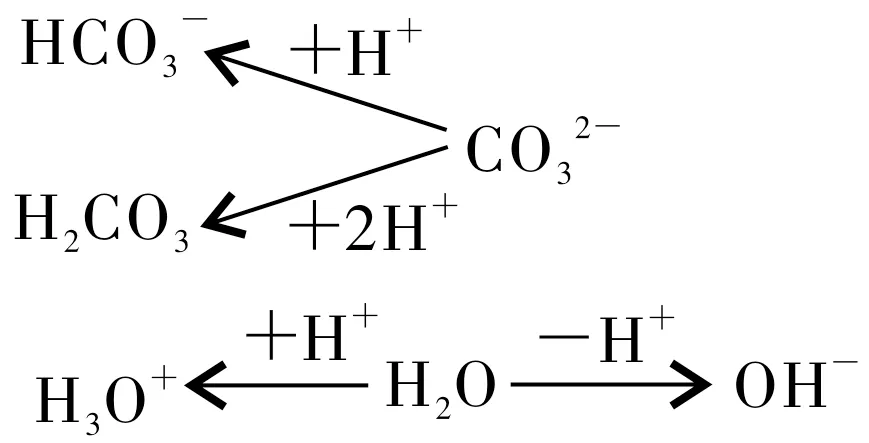
图1
第三种方法:先写出电荷守恒式和元素守恒式,然后用消元法进行数学处理,即可得到质子守恒式。
针对单一溶液,第一种、第二种方法快速简单;但对于混合溶液,则容易出错,最好的办法是用第三种方法,准确有效。
