脂多糖通过JAK2/STAT3通路诱导肾小球内皮细胞炎症反应的研究
2020-06-12张晓翠
刘 燕,张晓翠,邓 芳
肾小球内皮细胞(glomerular endothelial cells,GECs) 与基底膜和足细胞共同组成肾小球滤过屏障,是肾脏发挥生理作用的基础,肾脏疾病发生的一个标志性事件就是肾小球微血管通透性增高形成蛋白尿,GECs的损伤是其初始环节[1]。Janus激酶2/信号转导和转录激活因子3(Janus kinase 2/signal transducer and activator of transcription 3,JAK2/STAT3)途径是许多细胞因子受体系统的组成部分,在细胞的增殖、分化以及免疫调节等过程中广泛存在。正常情况下信号转导和转录激活因子(signal transducer and activator of transcriptions, STATs) 蛋白为单体,被磷酸化后变为二聚体形式,而JAKs活化后可以促使单体 STATs 磷酸化,得到相应的二聚体,所得产物会进入核内,并和启动子区的相关序列结合并调控基因转录过程[2]。研究[3]表明,JAK2/STAT3途径很可能参与了肾脏的炎性反应病理过程, 敲除STAT3 基因小鼠模型抑制JAK2/STAT3通路的激活,能使肾组织炎症及损伤作用减轻。但其在小鼠GECs(mGECs)中的作用机制尚未完全清楚。该研究旨在探讨脂多糖(lipopolysaccharide, LPS)是否通过激活JAK2/STAT3信号通路诱导mGECs产生炎症,为肾脏炎症性疾病防治提供新思路。
1 材料与方法
1.1 实验动物与主要试剂健康雄性昆明小鼠10只,SPF级,4~6周,由安徽医科大学实验动物中心提供。Ⅳ型胶原酶、内皮细胞生长因子、胰蛋白酶及转铁蛋白(美国Sigma公司);DMEM低糖培养基(美国HyClone公司);胎牛血清(FBS)(以色列BI公司);LPS(美国Sigma公司);CCK-8试剂盒(南京诺唯赞生物科技);反转录试剂盒、实时荧光定量PCR试剂盒(日本Takara公司);实时荧光PCR引物(上海生工);兔抗p-JAK2、JAK2、p-STAT3、STAT3抗体(美国CST公司);兔抗β-actin单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG(武汉三鹰);增强化学发光(ECL)试剂盒(上海Tanon公司);小鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、小鼠白细胞介素-6(interleukin- 6,IL-6)ELISA 试剂盒(美国R&D公司)。
1.2 方法
1.2.1mGECs的分离和培养 小鼠在无菌操作下眼球放血,并取出其肾脏,去除被膜及髓质,将皮质在80目筛上轻轻研磨,并依次从120、200目筛滤过,离心取沉淀后使用0.1% Ⅳ型胶原酶消化并收集肾小球,将其接种于提前涂有1%明胶的培养瓶中,培养在含20% FBS、胰岛素660 U/L、血管内皮生长因子20 mg/L、肝素钠100 mg/L、青霉素100 mg/L、链霉素100 mg/L的DMEM低糖培养基中,镜下观察肾小球贴壁后常规换液。21 d后进行细胞纯化,纯化后常规培养并传代,第2代细胞采用形态学观察,直接免疫荧光法对所分离mGECs进行鉴定。所有实验均采用第3~8代细胞进行实验,所有细胞置于饱和湿度、5% CO2、37 ℃的孵箱中常规培养[3]。
1.2.2LPS细胞毒性检测 将mGECs以1×104个/孔接种于96孔板中,不同浓度LPS(0.1~100 μg/L)刺激细胞24 h,10 μl CCK-8试剂混合到每个孔中,再培养4 h。酶标仪测量490 nm处的吸光度,对照组细胞中的平均吸光度值设定为100%生存力,处理结果表示为对照的百分比。
1.2.3siRNA转染 JAK2、STAT3 6条siRNA由广州锐博生物科技有限公司设计合成。将细胞接种至24孔板培养孔中,使转染时细胞密度达30%~50%,去除孔板中的培养基,在每孔细胞中加入含有60 ml/L Buffer、2.5 ml/L siRNA、6 ml/L Reagent的无血清培养基500 μl,37 ℃培养48 h。未处理组细胞为空白对照组;使用control siRNA组为siRNA阴性对照组;siRNA 干扰组分别为siRNA 1组、siRNA 2组、siRNA 3组。Western blot分别检测细胞JAK2和STAT3表达量,筛选出干扰效率最高的siRNA进行后续实验。
1.2.4LPS和JAK2/STAT3 siRNA干预 mGECs细胞用DMEM低糖培养基中常规培养,将生长达80%融合的细胞接种于6孔板中,细胞接种密度为2×105个/孔,无血清同步化培养24 h后,分组进行处理:对照(control)组、 LPS组(LPS 0.1 μg/L、1 μg/L、10 μg/L)、JAK2siRNA+LPS(1 μg/L)组、STAT3 siRNA+LPS(1 μg/L)组,其中,siRNA转染48 h后,加LPS(1 μg/L)刺激24 h。
1.2.5细胞免疫荧光染色 将细胞种植于玻片上,适宜条件培养至80%融合时,室温下用4%多聚甲醛固定细胞15 min,PBS洗3次。0.1%聚乙二醇辛基苯基醚再次固定细胞4 min,10% FBS终止固定。在4 ℃孵育一抗P-JAK2(1 ∶ 200)、P-STAT3(1 ∶200)过夜,PBS清洗细胞3次,室温下孵育羊抗兔二抗(1 ∶ 100)作用细胞30 min,DAPI细胞核染色2 min,荧光显微镜下拍照。
1.2.6Western blot检测 将细胞置于冰上,PBS清洗后,收集细胞并提取总蛋白,测定各组蛋白浓度。按蛋白定量结果上样,经10%SDS-PAGE凝胶电泳,恒流转至NC膜上,5%脱脂牛奶室温封闭2 h,TBST洗膜后,在4 ℃孵育一抗JAK2(1 ∶ 2 000)、P-JAK2(1 ∶ 2 000)、STAT3(1 ∶ 2 000)、P-STAT3(1 ∶ 2 000)过夜,TBST洗膜后,室温下孵育羊抗兔二抗(1 ∶ 5 000)2 h,再次TBST洗膜后,ECL显色曝光。用Western blot条带吸光度值进行分析比较。
1.2.7qRT-PCR反应 使用TRIzol Reagent试剂1 ml/孔提取各组细胞总RNA,并以提取的RNA样品为模板反转录成cDNA。采用SYBR Green法对cDNA样品进行实时荧光定量PCR。引物序列见表1。反应条件为:95 ℃预变性10 min后进入循环;95 ℃、10 s,60 ℃、30 s,扩增40个循环;每组设3个复孔,采用2-△△Ct法分析相对表达量。

表1 PCR引物列表
1.2.8ELISA法检测培养上清液细胞因子含量 收取各孔细胞培养上清液,5 000 r/min、4 ℃离心10 min,保存于 -80 ℃冰箱中。用ELISA试剂盒测定培养基中TNF-α、IL-6含量。

2 结果
2.1 LPS的最适宜作用浓度及其对JAK2/STAT3的影响为研究LPS对mGECs活性的影响,CCK-8法检测mGECs用不同浓度LPS(0.1~100 μg/L)干预24 h后细胞活性。与空白对照组相比,LPS(0.1~10 μg/L)未表现出对mGECs的毒性(F=3.145,P>0.05),而LPS 100 μg/L组较对照组细胞活性下降11.37%,差异有统计学意义(P<0.05),见图1。Western blot结果显示,在不同浓度LPS(0.1、1、10 μg/L)刺激后,JAK2磷酸化水平较对照组升高79%、172%、201%,差异有统计学意义(F=40.56,P<0.01)。STAT3磷酸化水平较对照组升高38%、144%、174%,差异有统计学意义(F=194.7,P<0.01),且均呈剂量依赖关系。1 μg/L LPS处理后的P-JAK2和P-STAT3表达变化较对照组均有统计学意义(P<0.05)。而各组总蛋白变化无统计学意义(P>0.05),见图2。免疫荧光示1 μg/L LPS刺激后mGECs的P-JAK2、P-STAT3表达量增多,见图3。

图1 CCK-8法检测 0.1~100 μg/LLPS处理mGECs后细胞活力变化
1:空白对照组;2:LPS 0.1 μg/L刺激组;3: LPS 1 μg/L刺激组;4: LPS 10 μg/L刺激组;5: LPS 100 μg/L刺激组;与空白对照组比较:*P<0.05
2.2 siRNA的筛选Western blot结果显示,3组JAK2 siRNA转染后, 与空白对照组相比,JAK2的总蛋白表达量分别下降65.25%、56.78%、63.01%,差异均有统计学意义(F=1 539,P<0.05)。且siRNA1片段干扰后的JAK2总蛋白表达量减少最明显。3组STAT3 siRNA转染后,STAT3的总蛋白表达量分别下降62.08%、59.54%、65.71%,差异均有统计学意义(F=2 170,P<0.05)。且siRNA3 片段干扰后的STAT3总蛋白表达量减少最明显,即沉默效果最好,见图4。qRT-PCR结果与之一致,见图5。
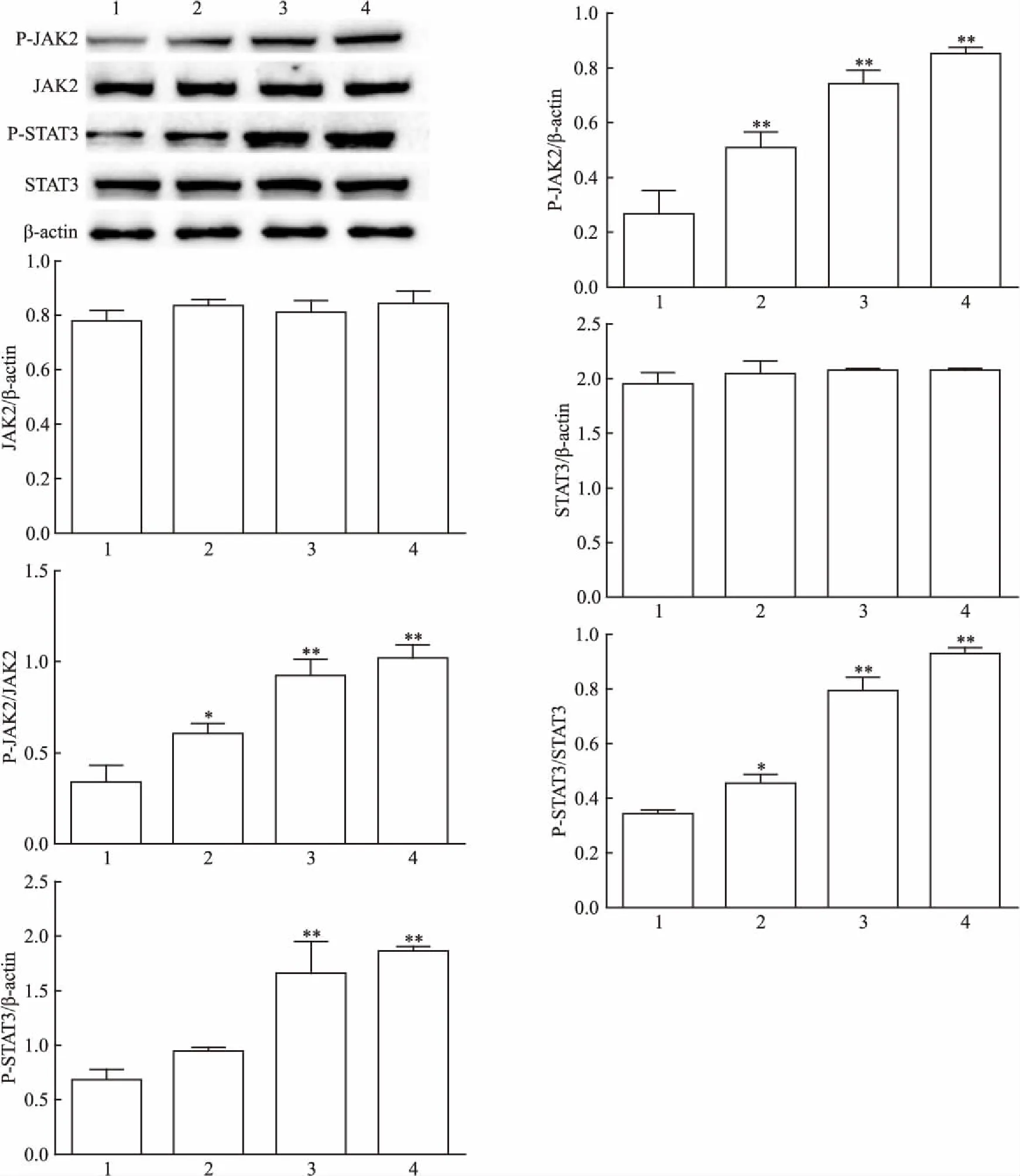
图2 Western blot法检测0.1~10 μg/L LPS处理mGECs后JAK2/P-JAK2、STAT3/P-STAT3蛋白相对表达变化
1:空白对照组;2:LPS 0.1 μg/L刺激组;3: LPS 1 μg/L刺激组;4: LPS 10 μg/L刺激组;与空白对照组比较:*P<0.05,**P<0.01

图3 免疫荧光法检测LPS处理mGECs后P-JAK2、P-STAT3蛋白表达变化 SP×400
A:空白对照组;B:LPS 1 μg/L组;1:P-JAK2;2:P-STAT3
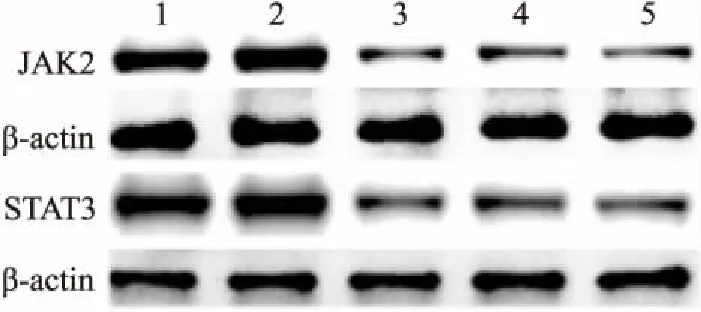
图4 转染siRNA后mGECs的JAK2、STAT3蛋白表达量
1:空白对照组;2:空白+siRNA阴性对照组;3: 空白+siRNA 1组;4:空白+siRNA 2组;5:空白+siRNA 3组
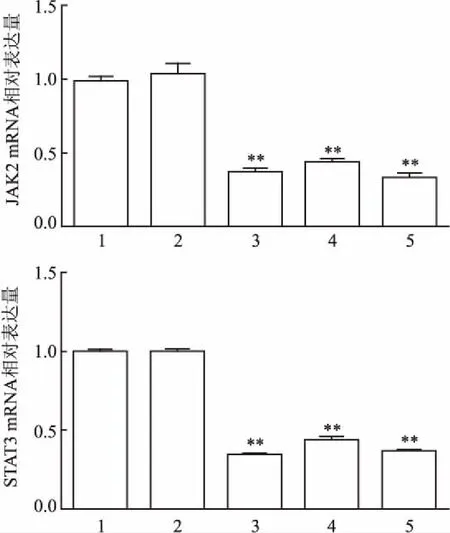
图5 转染siRNA后mGECs的JAK2、STAT3 mRNA相对表达量
1:空白对照组;2:空白+siRNA阴性对照组;3: 空白+siRNA 1组;4:空白+siRNA 2组;5:空白+siRNA 3组;与空白对照组比较:**P<0.01
2.3 JAK2/STAT3 siRNA抑制JAK2-STAT3信号通路的激活与没有处理的细胞(空白对照组)相比1 μg/L LPS处理细胞后JAK2和STAT3的磷酸化蛋白增多(F=825.2,P<0.01;F=561.9,P<0.01),总蛋白变化无统计学意义(P>0.05); JAK2 siRNA组与STAT3 siRNA均能降低LPS刺激的mGECs中磷酸化JAK2/STAT3蛋白的表达(P<0.01),见图6。

图6 P-JAK2、P-STAT3 蛋白在mGECs中的相对表达量
1:空白对照组;2:LPS刺激组;3:LPS刺激+JAK2/STAT3 siRNA组;与空白对照组比较:**P<0.01;与LPS刺激组比较:##P<0.01
2.4 LPS刺激及JAK2/STAT3 siRNA处理mGECs后TNF-α、IL-6表达变化用ELISA法检测TNF-α和IL-6的表达变化发现:LPS刺激后可以使TNF-α和IL-6表达上调(F=45.67,P<0.01;F=19.82,P<0.05)。JAK2/STAT3 siRNA预处理mGECs后TNF-α和IL-6的表达下降,见图7。mRNA水平变化趋势与之一致,见图8。LPS+JAK2 siRNA组与LPS+STAT3 siRNA组炎症因子IL-6、TNF-α差异无统计学意义(P>0.05)。

图7 IL-6、TNF-α 的蛋白表达量
1:空白对照组;2:LPS组;3:LPS+JAK2 siRNA组;4:LPS+STAT3 siRNA组;与空白对照组比较:**P<0.01;与LPS组比较:#P<0.05,##P<0.01

图8 TNF-α、IL-6的mRNA表达量
1:空白对照组;2:LPS组;3:LPS+JAK2 siRNA组;4:LPS+STAT3 siRNA组;与空白对照组比较:**P<0.01;与LPS组比较:##P<0.01
3 讨论
作为肾单位的一部分,也是原尿生成的部位,肾小球有丰富的血管网络[1,4]。在健康个体中,肾小球滤过膜能保留血液中的血细胞和蛋白质并有效过滤血浆,而在肾脏炎症患者中,由于炎性细胞浸润,纤维蛋白渗出,肾小球基膜损伤和新月体形成导致肾小球滤过屏障遭到破坏从而产生血尿和蛋白尿。mGECs是肾小球滤过屏障的组成部分,是滤过膜的内层,排列在肾小球毛细血管腔。由于mGECs是首先暴露于血液动力学、免疫学或代谢损伤诱导损伤的细胞,并且与肾小球系膜细胞、足细胞相互作用,可能是肾脏炎症发生过程中的重要环节[1]。当培养在适宜的促炎刺激体外环境下,mGECs受外界刺激引起正常的形态和功能改变,损伤的mGECs表现为细胞形态的变化、特异性标志物的改变、分泌功能改变以及抗氧化能力减弱,导致活性氧簇的过度产生,引起一系列蛋白激酶的依次磷酸化[5]。LPS是革兰阴性细菌细胞壁的主要成分,在多种肾脏炎症性疾病中均能诱导mGECs产生炎症反应[6-7]。TNF-α、IL-6是肾脏炎症性疾病的代表性炎症因子,有研究[8]证实,LPS诱导mGECs的炎症反应与TNF-α和IL-6的分泌呈正相关。因此,此次研究把炎症信号通路中的关键蛋白作为研究对象,探讨LPS 诱导的mGECs炎症反应的机制。
多种信号通路参与LPS诱导的内皮细胞炎症,如核转录因子kappa B信号通路、AMP依赖的蛋白激酶信号通路[6,9]。JAK-STAT信号通路是重要的炎症信号通路之一。在癌症中可观察到JAK/STAT信号通路异常活化[10],并且其也参与类风湿关节炎和肾脏疾病的发生发展[11]。LPS能在多种疾病中激活JAK/STAT通路[2,7],本研究用Western blot法检测不同浓度下LPS刺激细胞后的JAK2、STAT3的总蛋白及磷酸化水平,结果显示,随着LPS浓度的增高JAK2和STAT3的磷酸化水平也不断提高,且呈剂量依赖性,而总蛋白的变化无统计学意义,结果与Chen et al[12]研究一致。LPS诱导细胞分泌TNF-α、IL-6。在IL-6高水平存在的情况下,P-JAK2和P-STAT3也会增加,IL-6是JAK2/STAT3信号通路的强诱导剂,IL-6与细胞膜上IL-6受体结合后能诱导JAK2/STAT3信号通路的活化,从而以正反馈形式促进炎症反应的发生[13]。JAK2 siRNA和STAT3 siRNA处理后能降低蛙皮素诱导的大鼠胰腺腺泡AR42J细胞炎症和凋亡[12]。本实验中用siRNA影响细胞JAK2、STAT3的基因表达后其炎症指标TNF-α、IL-6减少的结果与之一致。而对于其他信号通路对于肾小球内皮细胞炎症的影响,将会在后续的研究中进行探讨。本研究表明,JAK2/STAT3信号通路的激活在促进mGECs炎症过程中发挥了促进作用,而抑制JAK2/STAT3信号通路的激活能减轻LPS诱导的mGECs的炎症损伤。综上,在mGECs中,LPS可以通过JAK2/STAT3信号通路介导炎症反应。
