长链非编码RNA牛磺酸上调基因1表达水平在Ⅰ~Ⅱ期宫颈癌诊断和预后中的作用
2020-06-10金志军
夏 艳,金志军
宫颈癌(cervical cancer, CC)是全球女性第三大常见肿瘤[1]。目前CC的治疗方法有外科手术、化疗和放疗等,但是由于肿瘤细胞耐药、疾病复发等,患者的预后欠佳,5年生存率约为40%[2-3]。因此,开发新的诊断和预后标志物以提高患者长期生存获益是非常必要的。长链非编码RNAs (long non-coding RNAs, lncRNAs)是一类长度>200个核苷酸、不具有编码蛋白质功能的RNA分子[4],其在多种疾病中发挥重要功能,包括表观遗传调控和转录以及转录后调控等[5]。最近,越来越多的研究表明,lncRNA表达失调与肿瘤的发生和进展有关[6-10]。在所有与癌症相关的lncRNAs中,牛磺酸上调基因1(taurine upregulated gene 1, TUG1)是近年发现的lncRNA,它参与调控多种肿瘤细胞的增殖和凋亡[6-7,11-14]。lncRNA TUG1在胆管癌、乳腺癌、膀胱癌等多种肿瘤组织中高表达,并且与患者的预后相关[7,15-16]。本研究旨在评估CC患者癌组织lncRNA TUG1的表达水平与CC诊断及预后的关系。
1 对象与方法
1.1对象 前瞻性队列研究连续纳入2014年1月—2015年12月接受手术治疗的CC患者137例。入组标准:(1)经临床和病理检查确诊为CC患者;(2)年龄≥18周岁;(3)国际妇产科联盟(international federation of gynecology and obstetrics, FIGO)分期为Ⅰ~Ⅱ期;(4)准备接受手术切除,且未行术前新辅助化疗或放疗。排除标准:(1)严重感染或中重度肝肾功能异常患者;(2)有性传播疾病或急性生殖系统炎症患者;(3)有其他恶性肿瘤史患者;(4)妊娠期或者哺乳期妇女;(5)研究者评估难以定期随访的患者。本研究已获得第二军医大学附属长征医院伦理委员会批准,所有患者均已签署知情同意书。
1.2信息采集和随访 137例确诊为CC的患者中,年龄<45岁44例(32.1%),年龄≥45岁93例(67.9%);肿瘤大小<4 cm 59例(43.1%),≥4 cm 78例(56.9%);组织学类型为鳞癌的患者82例(59.9%),腺癌55例(40.1%)。FIGO分期为ⅠA期、ⅠB期和ⅡA期的患者分别为27例(19.7%),73例(53.3%)和37例(27.0%);淋巴结转移阴性和阳性分别为69例(50.4%)和68例(49.6%);宫颈基层浸润深度<2/3和≥2/3的患者分别为70例(51.1%)和67例(48.9%)。FIGO分期由2名副高以上职称的妇科医师评定。18例行筋膜外子宫切除术,9例行改良根治性子宫切除术,110例行根治性子宫切除术。62例淋巴结阴性、切缘阴性、宫旁组织阴性,术后定期询问病史和体检,未进行辅助治疗;75例手术发现盆腔淋巴结阳性和(或)手术切缘阳性和(或)宫旁组织阳性,术后28例进行盆腔放疗、31例行盆腔放疗+顺铂单药同步化疗、16例行盆腔放疗+顺铂联合5-氟尿嘧啶的同步化疗。手术后根据患者年龄、病理类型和分期等因素综合考虑选择基于顺铂的同步放化疗。术后第1年,每1~3月随访1次,随后每3~9月随访1次,随访截止日期为2017年6月,中位随访时间为23月(7~42月)。截止2017年6月,137例中共有83例死亡,其中78例因宫颈癌死亡,5例因其他原因死亡。137例中共有59例为终检值(包括5例因其他原因导致的死亡患者和54例随访截止时仍未死亡的患者)。总体生存期(overall survival,OS)定义为患者从诊断之日到任何原因导致死亡的时间。
1.3标本采集 所有患者于手术中切除宫颈癌组织,并于距癌组织边缘2.5 cm处取配对的癌旁组织,立即以生理盐水冲洗,后放入液氮中储藏,以备后期检测使用。
1.4定量聚合酶链式反应 采用TRizol法(美国Invitrogen公司)提取CC患者癌组织和癌旁组织的总RNA,并用逆转录试剂盒(日本TOYOBO公司)将总RNA逆转录成cDNA 待用。以U6作为lncRNA TUG1内参,严格按照SYBR Green Ⅰ 荧光定量PCR试剂盒(美国KAPA公司)操作说明进行qPCR反应(95 ℃ 5 min→40个循环95 ℃ 5 s→60 ℃ 30 s),采用2-△△ct方法计算lncRNA TUG1的相对表达量。 lncRNA TUG1和U6引物采用Primer Premier 5.0 (Premier, Framingham, USA)设计。引物信息如下:
lncRNA TUG1:
Forward:5’-TAGGAGTGGATGTGTTCTGTAGCA-3’
Reverse:5’-TGGTCGTGGAATATGGTCAATGAG-3’
U6:
Forward:5’-CTCGCTTCGGCAGCACATA-3’
Reverse:5’-CTCGCTTCGGCAGCACATA-3’
1.5统计学处理 采用SPSS 22.0软件和GraphPad prism 5.01软件进行统计分析。数据展现形式为频率(百分比)或中位值(1/4~3/4分位值)。采用Wilcoxon符号秩和检验比较lncRNA TUG1在癌组织和配对的癌旁组织中的表达差异,采用Wilcoxon秩和检验比较不同亚组间lncRNA TUGI的表达差异。采用Kaplan-Meier曲线和log-rank检验分析lncRNA TUG1表达水平和OS的关联。采用单元、多元Cox比例风险模型分析CC患者的癌组织lncRNA TUG1表达量以及临床病理特征对患者OS的预测作用。P<0.05为差别具有统计学意义。
2 结 果
2.1lncRNA TUG1在CC癌组织和配对的癌旁组织中的表达水平 CC癌组织lncRNA TUG1相对表达量[中位值:2.436(四分位间距:1.278~4.243)]显著高于配对的癌旁组织[中位值:1.197(四分位间距:0.516~1.947)](P<0.001,图1)。
2.2癌组织lncRNA TUG1表达水平与患者临床病理特征的关联 采用Wilcoxon秩和检验分析癌组织lncRNA TUG1表达水平在CC患者不同临床病理特征亚组中的差异,结果显示癌组织lncRNA TUG1表达水平与FIGO分期(P=0.023)呈正相关,而与其他临床病理特征无关(表1)。
2.3癌组织lncRNA TUG1表达水平与CC患者OS的关联 按照lncRNA TUG1在癌组织中表达水平的中位值2.436将患者分为高表达组和低表达组。Kaplan-Meier曲线和Log Rank检验显示,癌组织lncRNA TUG1高表达患者的累积OS(OS中位值20.0月,95%CI:16.2~23.8月)显著低于癌组织lncRNA TUG1低表达的患者(OS中位值36.0月,95%CI:31.0~41.1月)(P<0.001,图2A)。在78例因CC死亡的患者中,癌组织lncRNA TUG1高表达患者的累积OS(OS中位值22.0月,95%CI:16.0~28.0月)显著低于癌组织lncRNA TUG1低表达的患者(OS中位值36.0月,95%CI:31.0~41.0月)(P<0.001,图2B)。
2.4影响OS的因素 采用多元Cox比例风险模型分析CC患者的癌组织lncRNA TUG1表达量及
表1 癌组织lncRNA TUG1表达水平与宫颈癌患者临床病理特征的关联
Tab 1 Correlation of lncRNA TUG1 expression in tumor tissue and clinicopathological features in CC patients

参 数癌组织lncRNA TUG1表达水平高表达低表达P值n6968年龄/岁0.128 <4518(40.9)26(59.1) ≥4551(54.8)42(45.2)d肿瘤/cm0.349 <427(45.8)32(54.2) ≥442(53.8)36(46.2)组织学类型0.250 鳞癌38(46.3)44(53.7) 腺癌31(56.4)24(43.6)FIGO分期0.023 ⅠA期11(40.7)16(59.3) ⅠB期33(45.2)40(54.8) ⅡA期25(67.6)12(32.4)淋巴结转移0.200 阴性31(44.9)38(55.1) 阳性38(55.9)30(44.1)宫颈肌层浸润深度0.348 <2/338(54.3)32(45.7) ≥2/331(46.3)36(53.7)
CC:宫颈癌;lncRNA:长链非编码RNA; TUG1:牛磺酸上调基因1; FIGO分期:国际妇产科联盟分期.
临床病理特征对患者OS的预测作用,发现癌组织lncRNA TUG1高表达是CC患者OS较差的独立预测因素(P=0.001)。此外,肿瘤≥4 cm(P<0.001)、FIGO Ⅱ期(P<0.001)、淋巴结转移阳性(P<0.001)和宫颈基层浸润深度≥2/3(P=0.002)也是CC患者OS较差的独立预测因素。
表2 影响OS因素多元Cox比例风险模型分析
Tab 2 Analysis of factors affecting OS by Cox’s proportional hazard regression
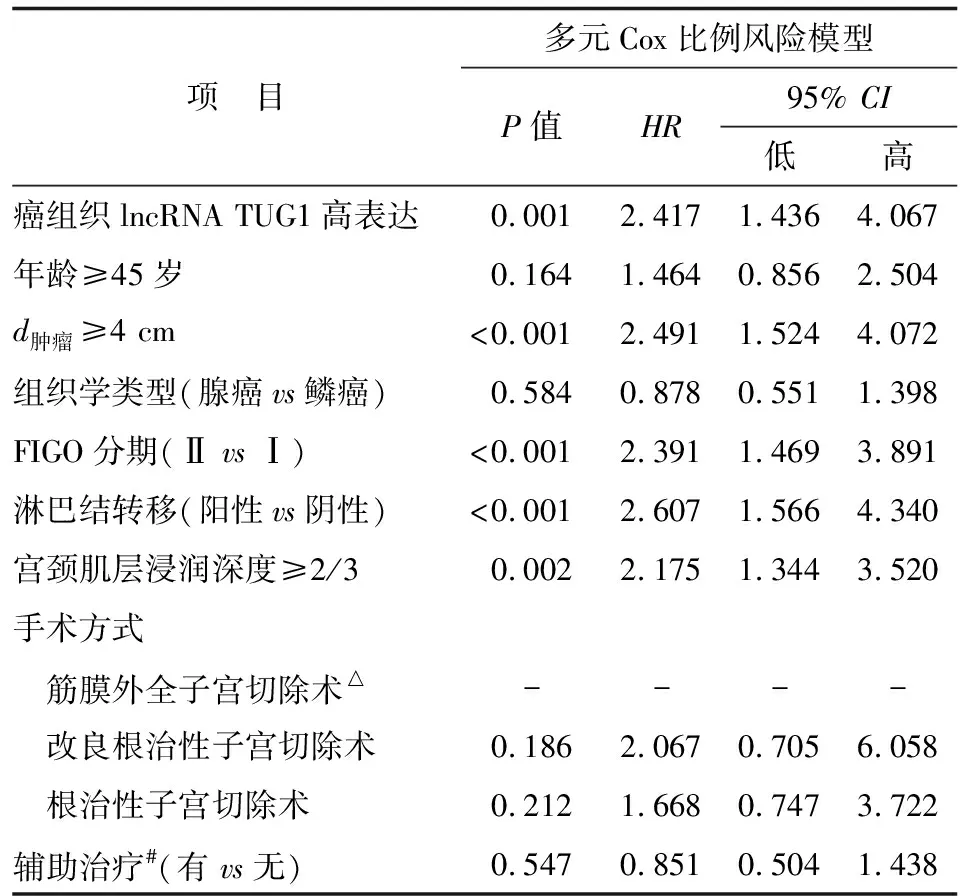
项 目多元Cox比例风险模型P值HR95% CI低高癌组织lncRNA TUG1高表达0.001 2.417 1.436 4.067 年龄≥45岁0.164 1.464 0.856 2.504 d肿瘤≥4 cm<0.001 2.491 1.524 4.072 组织学类型(腺癌vs鳞癌)0.584 0.878 0.551 1.398 FIGO分期(Ⅱ vs Ⅰ)<0.001 2.391 1.469 3.891 淋巴结转移(阳性vs阴性)<0.001 2.607 1.566 4.340 宫颈肌层浸润深度≥2/30.002 2.175 1.344 3.520 手术方式 筋膜外全子宫切除术△---- 改良根治性子宫切除术0.186 2.067 0.705 6.058 根治性子宫切除术0.212 1.668 0.747 3.722 辅助治疗#(有 vs无)0.547 0.851 0.504 1.438
CC:宫颈癌;lncRNA:长链非编码RNA; TUG1:牛磺酸上调基因1; FIGO分期: 国际妇产科联盟分期. △:手术方式以筋膜外全子宫切除术为参考,其他手术方式均与筋膜外全子宫切除术进行对比. #:辅助治疗包括:盆腔放疗+顺铂(或顺铂+5-氟尿嘧啶).
3 讨 论
本研究发现:(1)CC患者的癌组织lncRNA TUG1表达水平高于配对的癌旁组织;(2)CC癌组织lncRNA TUG1表达水平与FIGO分期和淋巴结转移正相关;(3)癌组织lncRNA TUG1高表达的患者具有较差的OS,且lncRNA TUG1高表达是CC患者OS较差的独立预测因素。此外,肿瘤≥4 cm、FIGO Ⅱ分期、淋巴结转移阳性和宫颈基层浸润深度≥2/3是CC患者OS较差的独立危险因素。
lncRNA TUG1是一个长约7.1 kb的lncRNA,位于染色体22q12。研究发现,lncRNA TUG1可以促进肿瘤的发生和发展,且多种肿瘤的lncRNA TUG1的表达水平与临床病理特征相关。Wang等发现,与肾透明细胞癌的癌旁组织相比,癌组织的lncRNA TUG1表达水平显著升高,且lncRNA TUG1表达水平与肿瘤分期、淋巴结转移和远端转移显著正相关[17]。研究发现,癌组织中lncRNA TUG1的表达水平高于癌旁组织,且lncRNA TUG1表达水平与肿瘤大小、TNM分期正相关[15]。这些研究表明,lncRNA TUG1与肿瘤发生正相关,并与疾病进程或临床病理恶性程度相关。本研究发现,CC癌组织lncRNA TUG1表达水平高于配对的癌旁组织,与上述临床研究结果趋势一致。进一步的关联分析发现,lncRNA TUG1表达水平与FIGO分期正相关。这原因可能是lncRNA TUG1可通过调节Wnt/β-catenin或ETM等多条信号通路促进肿瘤细胞的增殖、迁徙以及侵袭[18-22]。
lncRNA TUG1高表达与患者预后不良密切相关。lncRNA TUG1高表达与肾透明细胞癌患者较短的OS相关,Cox比例风险模型分析显示,lncRNA TUG1 高表达是肾透明细胞癌患者较差OS的独立预测因素[17]。在高度肌层浸润性膀胱癌中,lncRNA TUG1高表达与患者较差的OS相关[21],且lncRNA TUG1高表达是骨肉瘤患者OS和无进展生存期差的独立预测因素[20]。本研究显示,癌组织lncRNA TUG1高表达是CC患者OS较差的独立预测因素,且肿瘤≥4 cm、FIGO Ⅱ期、淋巴结转移阳性和宫颈基层浸润深度≥2/3也是CC患者OS较差的独立预测因素,这可能是由于lncRNA TUG1可能通过促进癌细胞增殖、迁移,抑制细胞凋亡和通过诱导EMT等促进癌细胞侵袭,以及可降低患者辅助放疗和(或)化疗敏感度治疗有关[16,18-22]。
本研究还存在一些局限:(1)样本量相对较小,导致数据缺乏统计效能。因此,未来的研究应扩大样本量以进一步验证lncRNA TUG1表达水平与CC患者临床病理及预后的关联;(2)本研究纳入的CC患者仅为FIGO Ⅰ~Ⅱ期,无Ⅲ期及Ⅳ期患者,未能评估lncRNA TUG1表达水平在Ⅲ期、Ⅳ期患者中的预后作用。由于FIGO Ⅳ期患者手术比例低,难以获取肿瘤组织样本,在一定程度上限制了lncRNA TUG1在FIGO Ⅳ期患者中预后作用的研究。(3)患者接受的治疗方式不同,可能会影响患者术后的生活质量进而影响患者的生存,今后需进一步细化患者的入排标准,评估患者术后的生活质量,以排除治疗方式对研究结果的干扰。
