响应面法优化玫瑰茄花青素提取工艺及稳定性研究
2020-06-05
(天津天狮学院,天津301700)
玫瑰茄(Hibiscus sabdariffa L.)是锦葵科木槿属的一年生草本植物,是传统药食两用植物。玫瑰茄原产于热带和亚热带,在福建、广东、广西、台湾均有分布,云南临沧元谋、永仁等地区已形成规模种植[1-2]。玫瑰茄花萼呈紫红色,富含花青素、黄酮、多酚等生物活性成分,具有抗氧化、抗炎、降血压、降血脂、降血糖[3-6]及抗肿瘤[7]等功效。玫瑰茄花含有蛋白质、维生素C、β-胡萝卜素、钙、铁等营养物质,且具有显著生理活性特性,目前主要用于花茶、果脯、蜜饯、果酱[2]、饮料、发酵乳等[8-9]食品的生产。研究表明,超声波法可以缩短提取时间,增大花青素、黄酮类物质提取率[10-12],优化花色苷提取工艺。Hellstrom J等[13]研究指出,花色苷受自身化学结构、温度、浓度、氧气等内外因素的影响,高度不稳定,容易降解。文献指出温度对龙葵果花色苷提取物有一定影响,随着温度升高,花色苷降解速率增大[14-15]。赵玉红等[16]研究巴氏杀菌处理对龙葵果果汁特性的影响,指出果汁中多酚、花色苷、单宁含量随着杀菌温度的升高和杀菌时间的延长而降低。本试验采用响应面试验法优化玫瑰茄花青素提取工艺,并分析花青素的热稳定性,为玫瑰茄资源的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
云南玫瑰茄:市售;无水乙醇(分析纯):天津江天化工技术有限公司;浓盐酸、冰乙酸(分析纯):天津市大茂化学试剂厂;无水乙酸钠、氯化钾(分析纯):天津市福晨化学试剂厂。
1.2 仪器与设备
UV2550紫外分光光度计:岛津仪器苏州有限公司;ME204E分析天平、ME4002TE精密天平:梅特勒-托利多国际贸易(上海)有限公司;SB-3200D超声波清洗机:宁波新芝生物科技股份有限公司;TG18K高速离心机:长沙东旺实验仪器有限公司;ZN-02型小型中药粉碎机:中科耐驰技术(北京)有限公司;60目不锈钢实验室分样筛:上海雷熙五金丝网制品有限公司。
1.3 试验方法
1.3.1 玫瑰茄花青素的提取工艺
用ZN-02型中药粉碎机将玫瑰茄原料粉碎,过60目筛,放入棕色试剂瓶中密封保存。称取经过预处理的玫瑰茄样品粉,按照一定的料液比加入乙醇溶液,进行超声波辅助提取。将玫瑰茄提取液冷却、离心后制得上清液,采用pH示差法测定玫瑰茄花青素得率[14,17]。分别移取配制好的玫瑰茄提取液1.0mL,用pH=1.0、pH=4.5的缓冲液稀释至10 mL比色管中,平衡稳定60 min后在波长520 nm和700 nm处测定吸光度,按照公式1计算花青素得率。
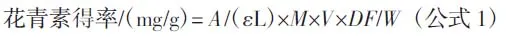
式中:A为(A520nmpH1.0-A700nmpH1.0)-(A520nmpH4.5-A700nmpH4.5);ε为摩尔消光系数,26 900 L/(mol·cm);L为光程,1 cm;M为-矢车菊活化素-3-葡萄糖苷的分子量,449.2;DF 为稀释因子;V 为提取液体积,mL;W 样品质量,g。
1.3.2 玫瑰茄花青素提取单因素试验
准确称取经预处理的玫瑰花样品1 g,置于250 mL磨口三角瓶中,在提取温度50℃条件进行超声功率、提取时间、乙醇浓度、料液比的花青素提取单因素试验,确定各因素的优水平。
1.3.3 玫瑰茄花青素提取响应面试验
基于玫瑰茄花青素单因素试验的结果,应用Design-Expert10软件对提取时间、超声功率、乙醇浓度、料液比做响应面试验设计,其试验因素水平编码表详见表1。

表1 花青素响应面试验编码水平表Table 1 Factors and levels in Box-Benhnken design of anthocyanin
1.3.4 玫瑰茄花青素稳定性分析
1.3.4.1 温度对花青素稳定性影响
按照试验方法1.3.1提取玫瑰茄花青素,配制成稀释5倍、10倍、15倍花青素稀释液。吸取2 mL花青素稀释提取液于 25 mL 比色管中,在 65、70、75、80、85、90 ℃的水浴锅中分别热处理 30、60、90、120 min,放入冷水中快速冷却,按照方法1.3.1测定热处理后花青素浓度,计算花青素保留率[14]。
1.3.4.2 pH值对花青素稳定性影响
按照1.3.4.1中制备稀释5倍花青素稀释液,用1 moL/L 盐酸溶液调 pH 值为 3、4、5、6、7 5种花青素样品溶液[18]。在温度90℃条件下热处理120min,按1.3.4.1方式计算花青素保留率,分析pH值对玫瑰茄花青素的稳定性影响。
2 结果与分析
2.1 玫瑰茄花青素提取单因素试验
2.1.1 超声波功率对花青素提取效果的影响
在提取时间30 min、乙醇浓度 70%、料液比1∶20(g/mL)条件下,温度设定为50℃,考察超声功率对玫瑰茄花青素得率的影响,结果见图1。
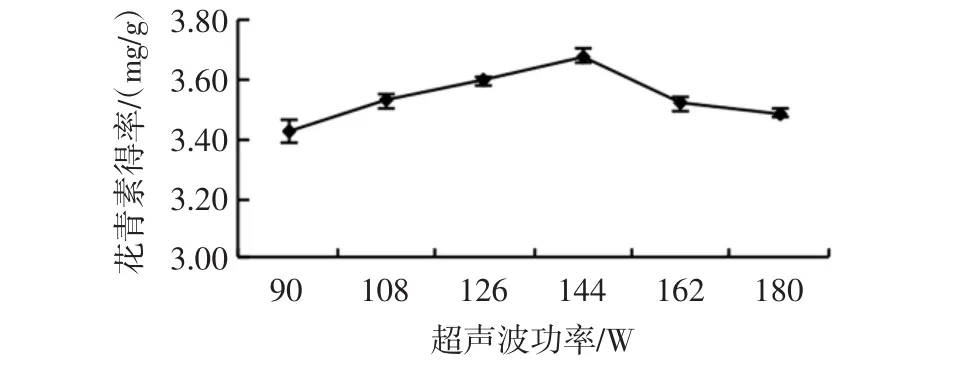
图1 超声功率对花青素得率的影响Fig.1 Effect of ultrasonic power on the yield of anthocyanin
由图1可知,超声功率增加到144 W时玫瑰茄花青素得率为3.68 mg/g。超声功率低于或高于144 W,玫瑰茄花青素得率呈现不同程度的降低,可能是由于一定功率的超声波可以促进花青素的溶出,但功率过大可能会破坏花青素的结构,确定超声波功率144 W为花青素提取的较优水平。
2.1.2 料液比对花青素得率的影响
在超声功率144 W、提取时间30 min、乙醇浓度70%条件下,超声温度50℃,分析料液比对玫瑰茄花青素得率的影响,结果见图2。
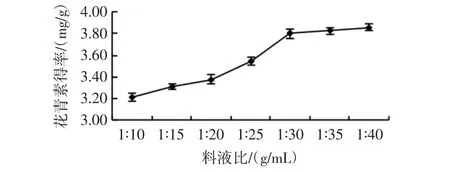
图2 料液比对花青素得率的影响Fig.2 Effect of solid-liquid ratio on the yield of anthocyanin
由图2可知,玫瑰茄花青素得率随溶剂体积的增加而出现先增大后趋于稳定的趋势,在料液比1∶30(g/mL)时花青素得率较高为3.80 mg/g。可能是由于提取溶剂增大有利于花青素物质溶出,但料液比增加至1∶30(g/mL)后玫瑰茄花青素基本都溶出,继续增大料液比效果不明显,确定料液比1∶30(g/mL)为较优水平。
2.1.3 超声时间对花青素得率的影响
在超声功率 144 W、料液比 1∶30(g/mL)、乙醇浓度70%、超声温度50℃条件下,分析提取时间对玫瑰茄花青素得率的影响,结果见图3。
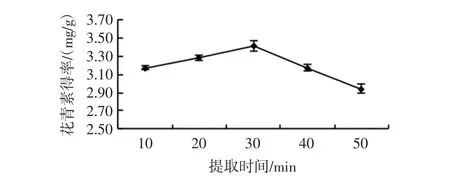
图3 提取时间对花青素得率的影响Fig.3 Effect of exaction time on the yield of anthocyanin
提取时间30 min玫瑰茄花青素得率最高为3.42(mg/g),随提取时间的延长呈现先上升后下降的现象,可能提取时间延长使部分花青素被氧化,导致花青素得率降低,选择提取时间30 min为较优水平。
2.1.4 乙醇浓度对花青素得率的影响
在超声功率 144 W、料液比 1 ∶30(g/mL)、提取时间30 min、提取温度50℃的条件下,分析提取溶剂乙醇浓度对玫瑰茄花青素得率的影响,结果见图4。
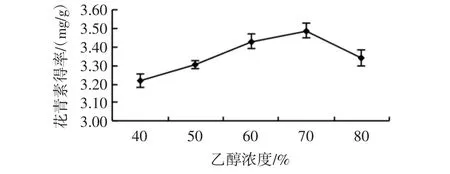
图4 乙醇浓度对玫瑰茄花青素得率的影响Fig.4 Effect of ethanol concentration on the yield of anthocyanin
由图4可知,花青素得率随着乙醇浓度的升高呈现出先增加后下降的趋势,乙醇浓度70%得率最大为3.63 mg/g。可能是由于一些醇溶性杂质、亲脂性强的成分与乙醇、水分子结合,导致花青素得率下降,故确定乙醇浓度为70%为较优水平。
2.2 响应面优化玫瑰茄花青素提取条件
2.2.1 玫瑰茄花青素响应面提取试验结果
在分析玫瑰茄花青素提取的单因素试验结果基础上,应用Design Expert 10进行响应面试验,分析提取时间、超声功率、乙醇浓度、料液比对玫瑰茄花青素得率的影响,响应面试验结果详见表2。
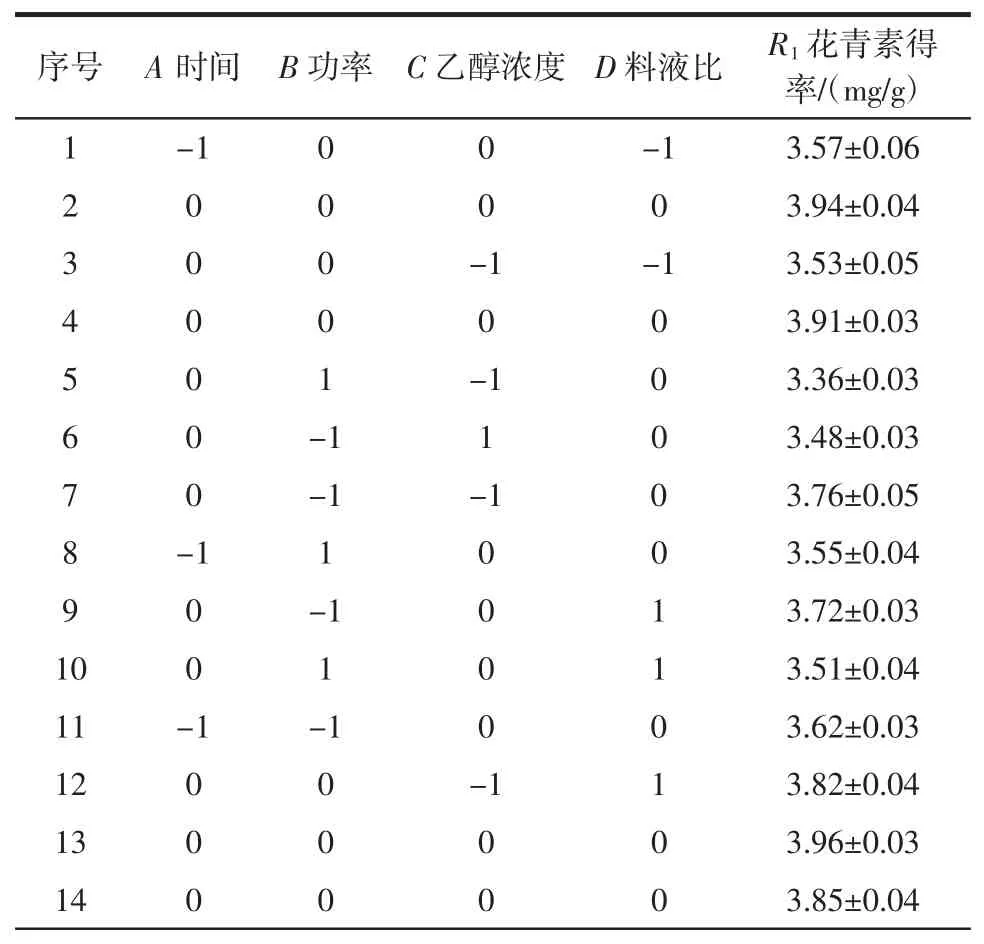
表2 响应面试验方案及结果Table 2 Results of Box-Benhnken design
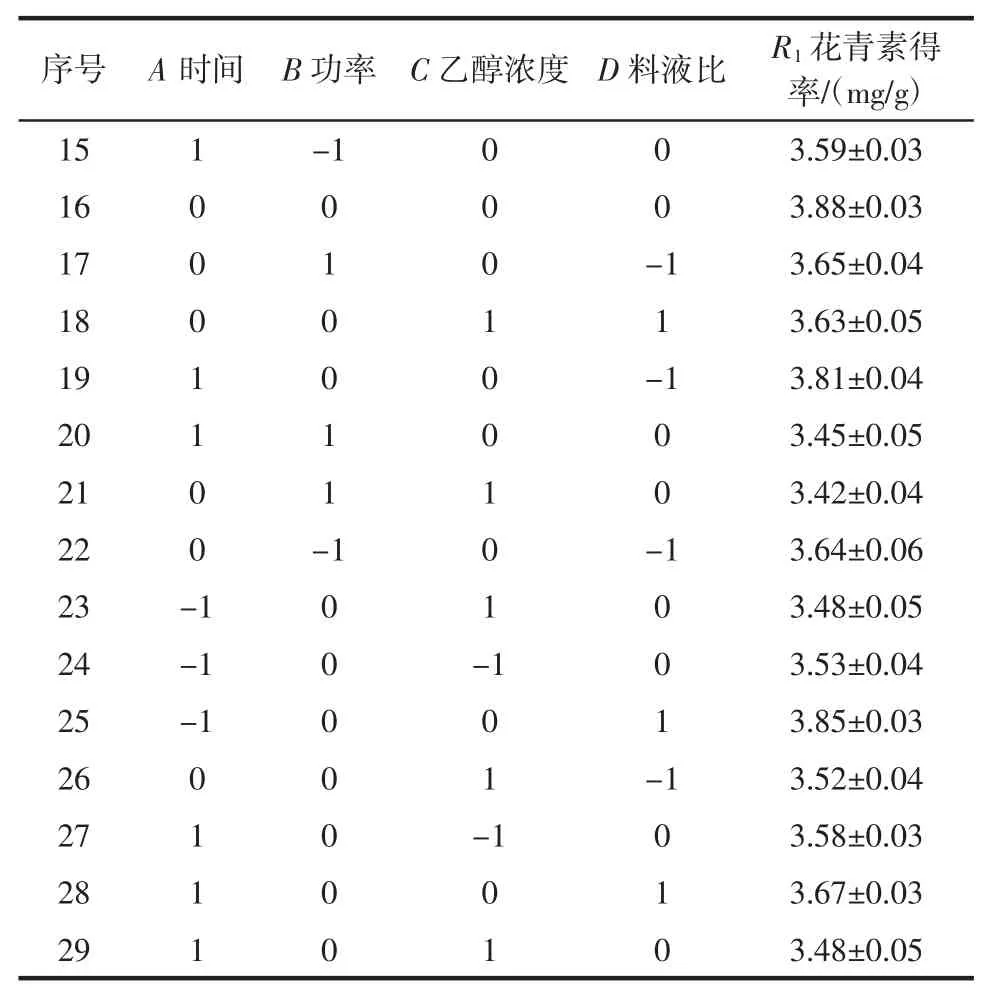
续表2 响应面试验方案及结果Continue table 2 Results of Box-Benhnken design
2.2.2 响应面试验结果方差分析
对表2玫瑰茄花青素响应面试验结果进行方差分析,各差异源对花青素得率的影响分析详见表3。

表3 响应面试验结果方差分析Table 3 ANOVA for Box-Benhnken design
由表3可知,C、BC、D2对花青素提取得率的影响显著,B、AD、A2、B2、C2对提取效果的影响非常显著。通过比较差异源F值的大小,提取时间、超声功率、乙醇浓度、料液比在所设定的范围内对玫瑰茄花青素提取得率的影响程度依次为B>C>D>A。
应用Design-Expert10软件对提取时间、超声功率、乙醇浓度、料液比4个因素进行回归拟合分析,建立多元回归模型:R1=-25.022 8+0.174 9A+0.164 4B+0.269 8C+0.357 6D-1.490 0×10-3A2-9.722 2×10-5AB-1.250 0×10-4AC-2.100 0×10-3AD-6.257 7×10-4B2+4.722 2×10-4BC-6.111 1×10-4BD-2.227 5×10-3C2-9.000 0×10-4CD-2.260 0×10-3D2。多元回归模型统计量 P<0.000 1<0.01,失拟项 P=0.187 3>0.05,决定系数 R2=0.927 4,表明回归方程显著、失拟项不显著,响应面回归方程的拟合程度良好。
2.2.3 响应面图分析
应用Design-Expert10对表3数据进行分析,绘制出响应曲面图5~图10。
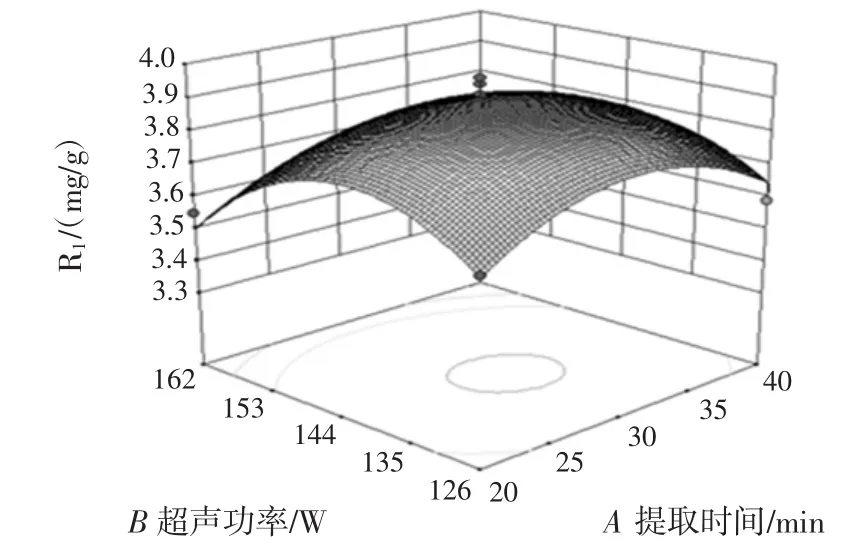
图5 提取时间与超声功率对花青素得率的影响Fig.5 Effect of ultrasonic time and ultrasonic wave power on the yield of anthocyanin
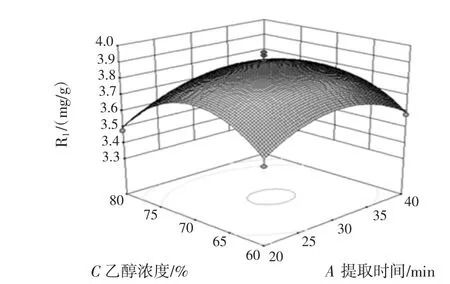
图6 提取时间与乙醇浓度对花青素得率的影响Fig.6 Effect of ultrasonic time and ethanol concentration on the yield of anthocyanin
由响应面回归方程及响应曲面图可知,因素BC、CD的交互作用明显。采用软件优化分析得出最佳提取条件为提取时间27.1 min、超声功率137.9 W、乙醇浓度 67.5%、料液比 1∶34.4(g/mL)。
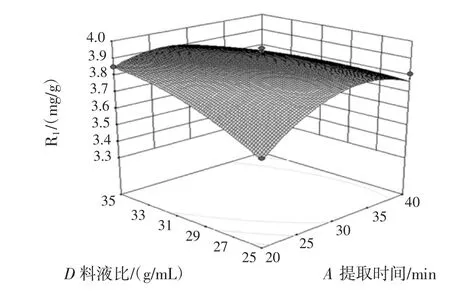
图7 提取时间与料液比对花青素得率的影响Fig.7 Effect of ultrasonic time and liquid ratio on the yield of anthocyanin
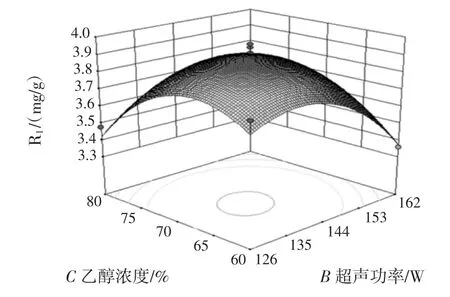
图8 超声功率与乙醇浓度对花青素得率的影响Fig.8 Effect of ultrasonic wave power and ethanol concentration on the yield of anthocyanin

图9 超声功率与料液比对花青素得率影响Fig.9 Effect of ultrasonic wave power and liquid ratio on the yield of anthocyanin
为了便于控制玫瑰茄花青素超声提取条件,提取参数设置为时间27 min、超声功率138 W、乙醇浓度68%、料液比 1∶34(g/mL),其预测值为3.94 mg/g。以所得优化条件进行3次平行验证试验,玫瑰茄花青素得率为(3.93±0.04)mg/g,与模拟预测值接近,表明预测值与试验值有较好的拟合度,多元回归方程可靠。
2.3 玫瑰茄花青素稳定性分析
2.3.1 温度对花青素稳定性影响
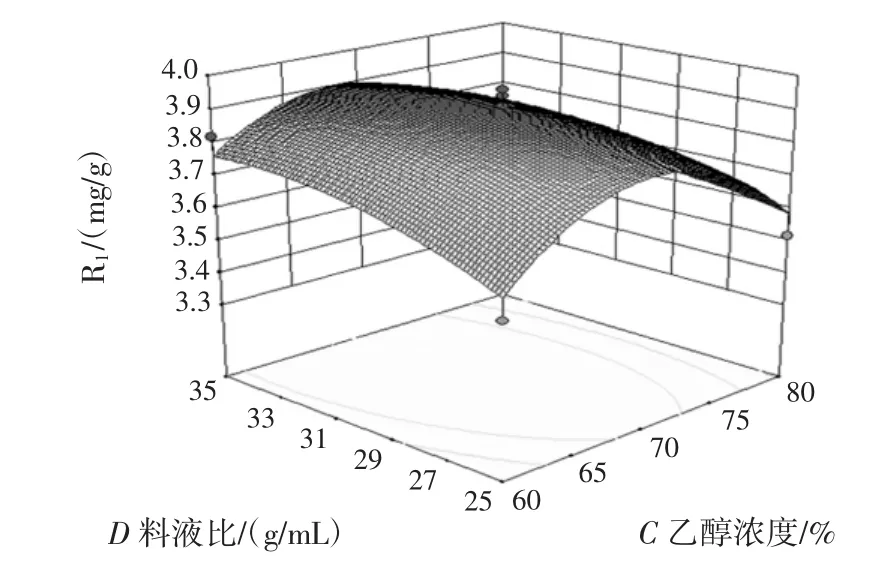
图10 乙醇浓度与料液比对花青素得率影响Fig.10 Effect of ethanol concentration and liquid ratio on the yield of anthocyanin
依据试验方法1.3.1制备玫瑰茄花青素提取液,测定花青素浓度为128.25 μg/mL,配制成稀释度5倍、10倍、15倍玫瑰茄花青素样液。对不同稀释倍数的花青素提取液分别热处理30、60、90、120 min,计算花青素保留率,如图11~图13所示。
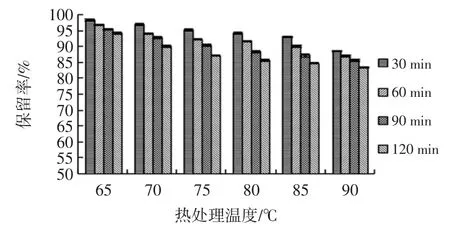
图11 稀释5倍花青素热稳定性分析Fig.11 Analysis on stability of anthocyanin diluted 5 times
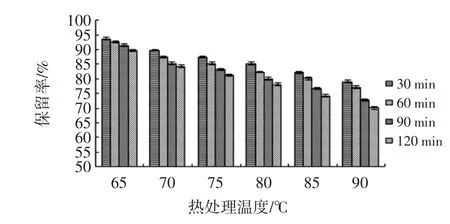
图12 稀释10倍花青素稳定性分析Fig.12 Analysis on stability of anthocyanin diluted 10 times
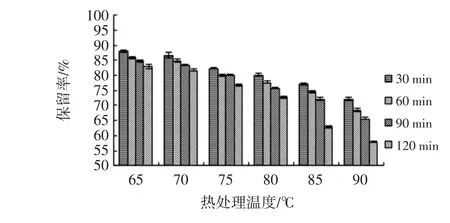
图13 稀释15倍花青素稳定性分析Fig.13 Analysis on stability of anthocyanin diluted 15 times
同样热处理条件下,稀释倍数越大、热处理温度越高花青素稳定性越差,玫瑰茄花青素在90℃、120 min条件下减少量最大为42.05%。稀释倍数增大增强花青素分散性,热处理温度增高促使酚羟基不稳定,使花青素易氧化,故保留率降低。
2.3.2 pH值对花青素稳定性影响
在分析温度对花青素稳定性分析基础上,计算在90℃条件下热处理温度时间120 min后,不同pH值花青素提取液的稳定性,如图14所示。

图14 pH值对花青素稳定性影响Fig.14 Influence of pH on stability of anthocyanin
pH 3~4玫瑰茄花青素保留率变化较大,pH 5~7保留率变化较小,说明在pH值在3~7范围内,pH值越大花青素稳定性越差。
3 结论
以云南产玫瑰茄为原料,在分析超声功率、提取时间、料液比、乙醇浓度单因素试验的基础上,应用Design-Expert10进行玫瑰茄花青素提取响应面优化试验,得到最佳提取条件为时间27 min、超声功率138 W、乙醇浓度 68%、料液比 1∶34(g/mL),花青素得率为(3.93±0.04)(mg/g),与模拟预测值接近。玫瑰茄花青素提取液稀释倍数越大、热处理温度越高花青素稳定性越差,玫瑰茄花青素在90℃、120 min条件下减少量最大为42.05%。随着pH值增大花青素稳定性降低。
