儿童肝母细胞瘤精准肝切除手术效果评价
2020-06-05任清华常赛硕王焕民
杨 维 任清华 秦 红 常赛硕 王焕民
肝母细胞瘤(hepatoblastoma,HB)是儿童最常见的肝脏恶性肿瘤,约占肝脏原发恶性肿瘤的80%和15岁以下儿童恶性肿瘤的1%[1]。在儿童肝母细胞瘤综合治疗体系中,手术切除仍然是一个极为重要的环节,需要选择合适的手术方式进行肿瘤切除。通过实施精准肝切除,可以达到完整切除肿瘤、尽量保留正常肝组织、确保残肝体积最大化以及降低术后出现肝功能不全概率的目的。本文拟针对肝母细胞瘤实施精准肝切除手术的相关经验与体会进行探讨。
材料与方法
一、一般资料
回顾性收集自2014年6月至2019年5月于首都医科大学附属北京儿童医院进行手术治疗的134例肝母细胞瘤患儿作为研究对象,其中男79例,女55例;发病年龄0.2岁至12岁,中位发病年龄1.75(0.8,3.1)岁。按照接受手术治疗的方式将患儿分为精准肝切除组及标准肝叶切除组,其中精准肝切除组88例,标准肝叶切除组46例。分别统计两组PRETEXT分期(pretreatment extension stage),国际儿童肝脏肿瘤协作组(International Society of Pediatric Oncology Epithelial Liver Tumor Study Group,SIOPEL)危险度分级,肿瘤生长部位,肿瘤体积,肿瘤对门静脉、肝静脉及下腔静脉的侵犯情况,手术持续时间,术中出血量,术后血清谷丙转氨酶,谷草转氨酶含量,术后并发症发生情况,腹腔引流管留置时间以及术后住院天数等临床指标;并进行对比分析。
二、术前治疗及评估
本组患儿中,有126例患儿术前根据COG及SIOPEL推荐的方案进行了规范的新辅助化疗。主要化疗药物组合方案包括:C5V(cisplatin+5-Fluorouracil+vincristine,顺铂+5-氟尿嘧啶+长春新碱),C5VD(cisplatin+5-Fluorouracil+vincristine+doxorubicin,顺铂+5-氟尿嘧啶+长春新碱+多柔比星),PLADO(cisplatin+doxorubicin,顺铂+多柔比星),Super-PLADO(cisplatin+carboplatin+doxorubicin,顺铂+卡铂+多柔比星)等。大部分患儿在新辅助化疗后肿瘤体积有不同程度缩小,为外科手术创造了条件。患儿在手术前均应用腹部超声、腹部电子计算机断层扫描(computed tomography,CT)或腹部磁共振成像(magnetic resonance imaging,MRI)增强扫描来测量瘤体大小,评估肿瘤与周围大血管的毗邻关系,以决定手术方案。根据实体瘤治疗评估标准(response evaluation criteria in solid tumors,RECIST),以肿瘤原发病灶的最大径线之和来表示肿瘤体积,对于大血管的侵犯根据SIOPEL推荐的血管累及程度来判定[2,3]。
三、手术方式
当肿瘤所在位置周围有较多可以保留的肝组织,甚至可以保留整个肝段时,为减少正常肝脏组织的损失,通常行精准肝切除手术术,在肝段及亚段水平进行解剖分离切割。反之,当考虑肿瘤周围的剩余正常肝脏组织较少或保留后无法保证良好血供时,则选择标准肝叶切除。个别患儿虽然瘤体侵犯的范围较小,但在术中发现瘤体质地脆软,为避免紧贴肿瘤边界行精准肝切除术可能造成肿瘤破溃外溢,也选择了标准肝叶切除术。两种术式简要操作过程如下:
精准肝切除术:选取右侧肋缘下斜形切口进腹。依次游离松解肝脏诸韧带,将肝脏拖出体外,观察并触摸肿瘤边缘,结合影像学检查所见,进一步明确肿瘤范围。于第一肝门、第二肝门及下腔静脉处常规预置血管阻断带备用,以微波刀在肝脏表面沿肿瘤与正常肝组织之间划定大致切割界限,切开肝被膜后,于距肿瘤边界0.5 cm处,由浅入深切开肝组织;对于体积较大、压迫肝静脉主干或门静脉左右主支、与血管壁关系密切的肿瘤,采用紧贴肿瘤边缘游离切除的方法。在切除过程中,注意随时止血,切断肿瘤供应或回流血管。对于直径在3 mm以下的小血管,使用微波刀烧灼固化后,直接切断;直径>3 mm的血管,仍然采取钳夹切断,断端以丝线结扎或以血管缝线缝扎处理。遇有大血管快速出血,短时间内出血量较大时,根据情况选择短时阻断第一、第二肝门或下腔静脉,进行血管缝合修补,修补完成、出血停止后,放松阻断带,恢复肝脏血液循环。手术过程遵循肿瘤切除与创面止血同时进行的原则,将出血量控制在最小限度,将肿瘤完整切除,保留临近正常肝组织,见图1。
图1 肝母细胞瘤精准肝切除手术前影像及切除后切面情况
Fig.1 Preoperative imaging of hepatoblastoma and gross cross-section appearance after precision resection
标准肝叶切除术:进入腹腔,暴露肝脏肿瘤后,根据肿瘤所累及肝叶由浅入深沿肝叶间解剖界限进行规则性切除。切除过程中,注意离断并处理与切除肝叶相对应的门静脉、肝静脉、肝动脉及其分支血管,完整切除肿瘤及其所累及的一个或多个肝叶。
四、随访
通过门诊、电话和微信等形式进行随访,对患儿的无病生存、复发进展及死亡率等情况进行调查。
五、统计学方法
采用SPSS20.0进行统计学分析。患儿生存率计算采用Kaplan-Meier法,可信区间(confidence interval,CI)的置信度为95%,非正态分布资料的比较采用Wilcoxon秩和检验。由于肝母细胞瘤的PRETEXT分期与病情严重程度及预后存在一定相关性,为避免分期可能对统计结果造成影响,我们在对围手术期指标及预后等各项数据进行统计学分析时,应用了PRETEXT分期进行分层,以期得到较为客观的结果,其中PRETEXT Ⅰ期患儿仅2例,故将PRETEXT Ⅰ期与Ⅱ期合并为一组进行统计分析[11]。P<0.05为差异有统计学意义。
结 果
一、相关临床特征
收集两组患儿可能对手术过程与效果产生影响的相关临床特征,包括PRETEXT分期、SIOPEL危险度分级、肿瘤生长部位、肿瘤体积(最大径线)、肿瘤对于门静脉、肝静脉及下腔静脉侵犯情况、术前是否行新辅助化疗等,结果显示精组肝切除组与标准肝叶切除组肿瘤最大径线长度中位数分别为11.5(10,13.3)cm与9.8(8.5,12.2)cm,精准肝切除组患儿肿瘤体积相对更大,差异有统计学意义(P=0.01);此外,两组患儿肿瘤部位分布存在差异(P=0.02),精准肝切除组患儿肿瘤更多见于中肝或3个以上肝叶;两组其余各项特征无显著差异,见表1。

表1 两组患儿相关临床特征的比较(n)Table1 Comparisonofrelevantclinicalcharacteristicsoftwogroupswithdifferentsurgicalapproaches(n)分组PRETEXT分期Ⅰ+ⅡⅢⅣSIOPEL危险度分级标危高危新辅助化疗有无主要血管侵犯门静脉肝静脉/下腔静脉精准肝切除组38321841478352517标准肝叶切除组29134281841594P值0.090.170.790.320.13
二、围手术期相关指标
对两组患儿手术持续时间、术中出血量、术后第1天血清谷丙转氨酶(alanine aminotransferase.ALT)、谷草转氨酶(aspartate aminotransferase,AST)含量、术后并发症发生情况、腹腔引流管留置时间、术后住院天数等围手术期数据进行对比分析,并应用PRETEXT分期进行矫正,发现精准肝切除组与标准肝叶切除组患儿术后出现并发症(包括失血性休克、胆瘘、腹腔感染、乳糜腹、肠梗阻等)的人数比例分别为15/88和8/46,发生率分别为17.0%和17.4%,组间差异无统计学意义(P=0.87),见表2;两组患儿其余指标的对比结果见表3。
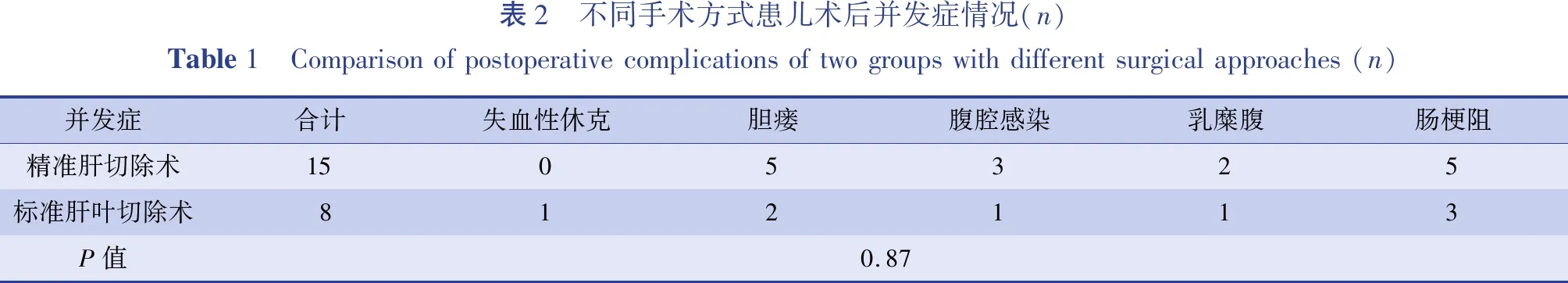
表2 不同手术方式患儿术后并发症情况(n)Table1 Comparisonofpostoperativecomplicationsoftwogroupswithdifferentsurgicalapproaches(n)并发症合计失血性休克胆瘘腹腔感染乳糜腹肠梗阻精准肝切除术1505325标准肝叶切除术812113P值0.87
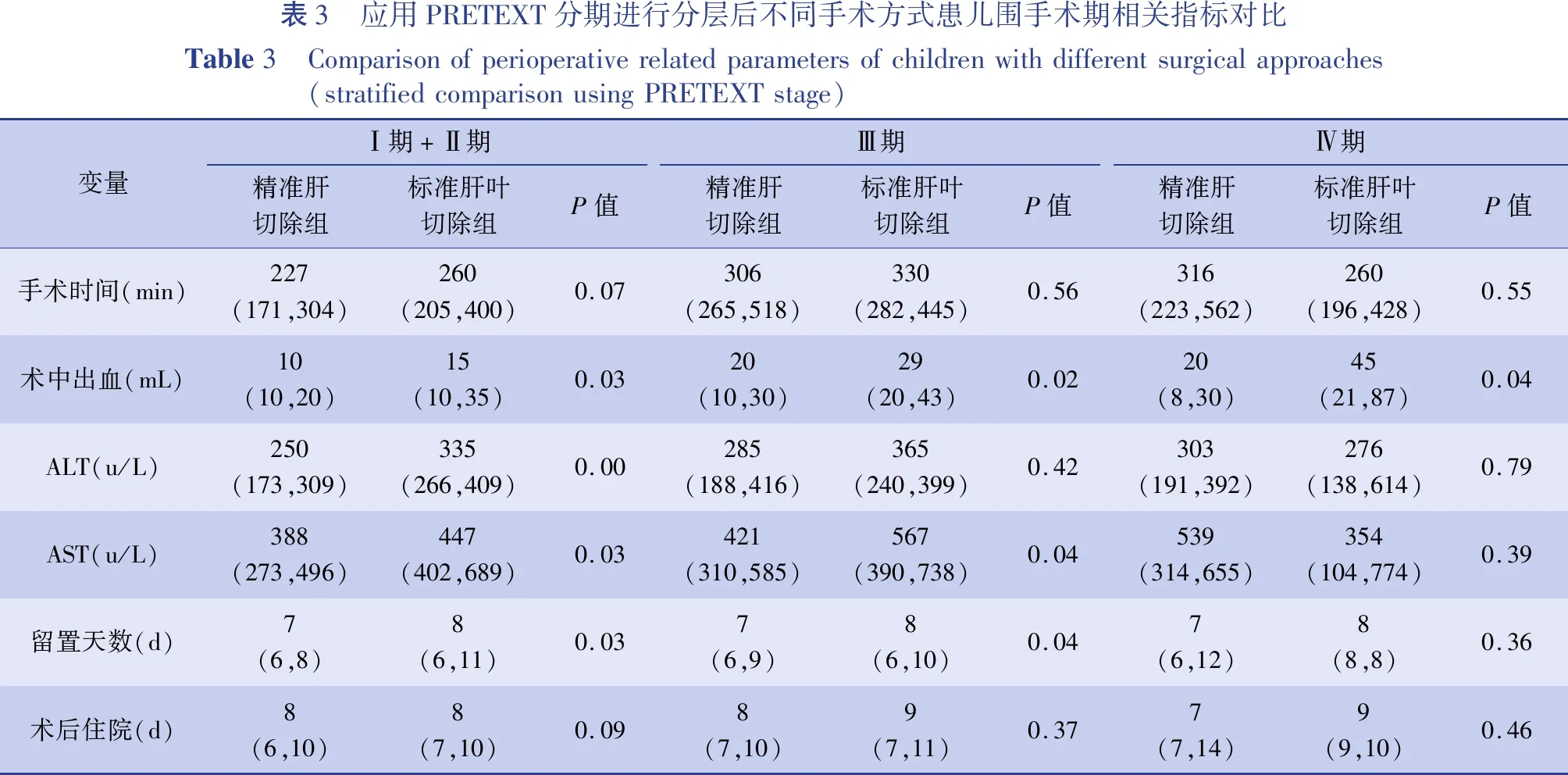
表3 应用PRETEXT分期进行分层后不同手术方式患儿围手术期相关指标对比Table3 Comparisonofperioperativerelatedparametersofchildrenwithdifferentsurgicalapproaches(stratifiedcomparisonusingPRETEXTstage)变量Ⅰ期+Ⅱ期精准肝切除组标准肝叶切除组P值Ⅲ期精准肝切除组标准肝叶切除组P值Ⅳ期精准肝切除组标准肝叶切除组P值手术时间(min)227(171,304)260(205,400)0.07306(265,518)330(282,445)0.56316(223,562)260(196,428)0.55术中出血(mL)10(10,20)15(10,35)0.0320(10,30)29(20,43)0.0220(8,30)45(21,87)0.04ALT(u/L)250(173,309)335(266,409)0.00285(188,416)365(240,399)0.42303(191,392)276(138,614)0.79AST(u/L)388(273,496)447(402,689)0.03421(310,585)567(390,738)0.04539(314,655)354(104,774)0.39留置天数(d)7(6,8)8(6,11)0.037(6,9)8(6,10)0.047(6,12)8(8,8)0.36术后住院(d)8(6,10)8(7,10)0.098(7,10)9(7,11)0.377(7,14)9(9,10)0.46
三、生存状况
本次纳入研究的134例患儿中,接受精准肝切除术88例,标准肝叶切除术46例;两组患儿接受随访的中位时间为31个月;其中精准肝切除组20例出现复发或转移,占22.7%;8例因肿瘤复发或转移死亡;标准肝叶切除组12例出现复发或转移,占26.1%;4例因复发或转移死亡;1例因化疗并发症死亡。分别比较两组患儿的2年无事件生存率(events free survival rate,EFS)和2年总体生存率(overall survival,OS),结果显示精准肝切除组与标准肝叶切除组2年EFS分别为81.0%与72.5%,差异无统计学意义(P=0.38);两组患儿的2年OS分别为90.6%和88.5%,差异无统计学意义(P=0.75),见图2、图3。按PRETEXT不同分期分层后对两组患儿的预后进行矫正后再次比较,PRETEXT Ⅲ期精准肝切除组的2年OS高于标准肝叶切除组(P=0.04),其余各分期患儿两组间预后无显著差异,见图4至图6。
图2 两组2年EFS对比(1=精准肝切除组,2=标准肝叶切除组,P=0.38) 图3 两组2年OS对比(1=精准肝切除组,2=标准肝叶切除组,P=0.75) 图4 PRETEXT Ⅰ期及Ⅱ期两组2年EFS与OS对比(1=精准肝切除组,2=标准肝叶切除组,P1=0.06,P2=0.86) 图5 PRETEXT Ⅲ期两组2年EFS与OS对比(1=精准肝切除组,2=标准肝叶切除组,P1=0.31,P2=0.04) 图6 PRETEXT Ⅳ期两组2年EFS与OS对比(1=精准肝切除组,2=标准肝叶切除组,P1=0.25,P2=0.42)
Fig.2 Comparison of 2-year EFS between precise and regular hepatectomy groups (1=precision group,2=regular group,P=0.38) Fig.3 Comparison of 2-year OS between precision and regular hepatectomy groups (1=precision group,2=regular group,P=0.75) Fig.4 Comparisons of 2-year EFS and OS between PRETEXT Ⅰ/Ⅱ precision and regular lobectomy groups(1=precision group,2=regular group,P1=0.06,P2=0.86) Fig.5 Comparisons of 2-year EFS and OS between PRETEXT Ⅲ precision and regular lobectomy groups(1=precision group,2=regular group,P1=0.06,P2=0.86) Fig.6 Comparisons of 2-year EFS and OS between PRETEXT Ⅳ precision and regular lobectomy groups(1=precision group,2=regular group,P1=0.06,P2=0.86)
讨 论
近年来,以铂类为基础的各类化疗药物联合应用为肝母细胞瘤的手术切除创造了条件,使肿瘤得以完整切除的机会大大增加[4]。随着外科治疗水平的不断进步,“精准外科”这一概念也逐渐被广泛接受并应用于包括肝脏肿瘤在内的各类肿瘤患儿的临床诊疗中,以达到最大化清除目标病灶、最大化保护器官结构和功能以及最大化控制医源性损害的目的[5]。儿童肝母细胞瘤发病相对隐匿,早期症状不典型,就诊时往往肿瘤体积已经较大,可累及2~3个甚至更多肝叶[6]。同时,肝母细胞瘤不仅体积相对较大,而且形态不规则,其周边可以留存较多正常的肝实质,因此简单地按叶间分割切除肿瘤会损失较多的肝组织。此外,经过规范治疗后,肝母细胞瘤患儿的远期预后往往较好,对于长期生存质量的要求相对比较高,因此小儿外科医生在进行肿瘤切除时,需要考虑选择合适的手术方式。在本次研究中,我们对两种不同术式患儿的相关临床特征进行了对比,发现精准肝切除组患儿肿瘤体积相对更大,并且肿瘤位置分布于肝脏中部或侵犯3个以上肝叶的比例更高,这也从另一个角度说明对于此类患儿需要在手术切除时选择更加精准的方式,以减少残肝组织的损失,尽可能保留正常肝组织,从而保证术后肝功能维持稳定。
本次研究中,我们对大部分病例采取了精准肝切除的手术策略,精准肝切除的概念即并非严格按照各肝叶的解剖界限规则性切除一个或多个肝叶,而是根据肿瘤分布的位置及与周围主要血管及胆管的毗邻与侵犯情况,进行肝段或亚段水平的不规则切除,以期在保证肿瘤完整切除以及远期预后良好的前提下,合理减轻手术打击,降低术后并发症发生率,促进患儿尽快从手术中恢复,便于进行后续治疗[7]。
肝脏肿瘤手术中一个需要关注的重点是术中出血的问题,因为出血可能导致低血容量性休克,危及生命,还可造成手术视野不清晰,干扰操作,影响手术效果,并导致凝血物质消耗,造成凝血功能障碍以及术后创面及腹腔继发感染等并发症。既往采用较多的规则性肝叶切除术是以肝脏血管分布规律为指导的切割方式,主要目的是为了减少出血。随着肝脏切割止血技术的进步和设备的更新,规则性肝叶切除已经不是必须的要求,而是更加强调在保证完整切除的前提下,尽量保存正常肝脏实质。精准肝切除术中采用微波刀分离切割与创面止血同时进行的方式,沿肿瘤边缘由浅入深劈开肝组织,暴露肝脏门脉与静脉系统分支及胆管等结构,在直视状态下将上述管道结构逐一辨认、处理,避免盲目操作,肝脏切面相对平坦,便于在肿瘤切除后,进行进一步瘤床止血等处置。本研究中,精准肝切除组患儿出血量明显少于标准肝叶切除组,提示肝脏精准切除可以有效控制术中出血。评估肝脏手术的创伤性刺激的相对简便易行的方法是测定ALT、AST等相关血清学指标。ALT与AST在肝细胞中的浓度要明显高于血液,当肝细胞由于创伤或缺血再灌注损伤等原因被破坏时,二者大量释放入血,可以在一定程度上反映手术打击的严重程度[8]。本次研究中,精准肝切除组患儿术后第1天测定的血清ALT与AST的总体水平低于标准肝叶切除组,表明精准肝切除对于控制手术打击的整体效果要优于标准肝叶切除。肝母细胞瘤患儿绝大多数术后需要进行辅助化疗等后续治疗,而缩短手术后恢复时间,可以使患儿术后得到更加及时有效的治疗。本次研究中,精准肝切除组患儿术后腹腔引流管平均留置天数要显著低于标准肝叶切除组,说明精准肝切除手术可以有效缩短术后恢复时间,加速患儿的康复过程,为后续治疗提供基础。
虽然精准肝切除需要更加详细的术前评估和更加细致的术中解剖操作,并可能由此带来手术时间延长等问题。但随着术者经验技巧的积累以及设备工具的优化,上述问题已逐步得到解决。本次研究中,两组患儿的手术持续时间并无统计学差异,可见在通过术前影像学辅助检查准确定位以及手术切除技术可以得到保障的前提下,精准肝切除手术所花费的时间已与标准肝叶切除术相当,并不会因手术时间的延长而增加手术风险。肝脏肿瘤手术后可能出现包括胆瘘在内的一系列并发症,本研究中,两组患儿术后并发症的发生率分别为17.0%(精准肝切除组)和17.4%(标准肝叶切除组),并无显著性差异,且经治疗后均逐渐恢复,术后住院时间也无明显差异,未对后续治疗造成明显影响[9,10]。
肝母细胞瘤目前较为公认的分期系统主要包括PRETEXT分期系统以及改良EVANS分期系统。其中EVANS分期系统主要根据患者的病理类型、扩散转移情况以及手术切除与残留情况,在手术后进行分期。考虑到上述相关术后指标在文章结果部分中已进行分析,故未再基于术后分期来对两种不同手术方式的患者预后进行对比。同时由于本研究中PRETEXT Ⅰ期患儿仅2例,进行统计学分析较困难;且现阶段关于肝母细胞瘤的诊疗规范中,对于PRETEXT Ⅰ期与Ⅱ期患者相关的诊疗内容存在一定相似性,故将PRETEXT Ⅰ期与Ⅱ期患者合并为一组进行统计比较。经回顾性比较分析,采用不同术式的两组患者PRETEXT分期、SIOPEL危险度分级和主要血管受侵犯程度等临床特征并无显著差异。在对于不同手术方式患儿的远期预后进行比较时,发现两组患儿总体并无显著差异,其中精准肝切除组PRETEXT Ⅲ期患儿的远期预后甚至优于标准肝叶切除组,也提示了采用精准肝切除术式治疗肝母细胞瘤,其远期效果可以得到保障与文献结果一致[11]。
总体看来,在对患儿进行准确个体化评估的前提下,儿童肝母细胞瘤外科治疗可以遵循精准外科的理念,通过精准肝切除的手术方式,达到完整去除肿瘤病灶、一定程度上减轻手术打击、减少术后并发症以及加快恢复的目的,从而为后续治疗打下良好基础,得到较为满意的预后。
