苹果茎沟病毒外壳蛋白抗体制备与应用
2020-06-04谭嘉琦韩秀清成思琼吴云锋郝兴安
谭嘉琦,韩秀清,成思琼,吴云锋,郝兴安
(1.西北农林科技大学,陕西杨凌 712100;2.陕西新世界果业集团有限公司,陕西杨凌 712100)
苹果茎沟病毒(Applestemgroovingvirus, ASGV)是一种寄主范围广泛的潜隐性病毒,一般不表现出明显的外部症状,但影响嫁接亲和性,造成果实产量和品质下降[1]。ASGV寄主范围广泛,除了苹果外,还侵染梨、柑橘、樱桃、杏等果树和百合等多种寄主[2-4]。ASGV在中国苹果产区发生普遍,调查显示国内主要苹果产区西北高原果区、渤海湾果区、黄河故道果区主栽苹果品种普遍带毒,带毒株率为33.4%~100%[5]。
ASGV是发形病毒属(Capillovirus)的代表种。ASGV粒子为弯曲线状[6-7],病毒基因组约6.5kb,正义单链RNA。基因组RNA 含有2个开放阅读框(ORF),编码甲基转移酶(Mt)、外壳蛋白(Coat protein,CP)和运动蛋白(Movement protein,MP)等多个蛋白[8-10]。ASGV病毒MP基因与CP基因相对保守,且CP基因的保守性更强[11-13]。
ASGV在栽培品种上不引起明显症状,这对田间病害的识别与诊断带来困难[14-15]。实施苗木脱毒及无毒栽培,可有效控制病害发生蔓延。建立高效灵敏的检测技术,成为解决种苗检疫、抗病性早期鉴定等基本问题的前提,也是果树无毒化栽培的基本保障[16]。因此,对田间样品及脱毒苗木进行病毒检测,是控制病害的重要环节[17-18]。不仅如此,基于血清学技术,对病毒蛋白进行表达分析是研究病毒与寄主互作的重要方法[19-20]。因此,针对ASGV建立血清学检测技术,不仅可以对田间样品和脱毒苗木进行病毒检测,也可以分析病毒蛋白表达。本研究利用原核表达系统获得ASGV的外壳蛋白,并制备多抗血清。利用该蛋白建立针对ASGV的Western blot和DAS-ELISA检测技术。这为病毒的田间样品及脱毒苗木检测、以及病毒蛋白的功能研究提供了技术手段。
1 材料与方法
1.1 材料与试剂
ASGV毒源采自陕西杨凌果园,茎尖培养结合热处理获得的脱毒组培苗由陕西果业集团提供。大肠杆菌DH5α、 BL21及表达载体pET-32a由西北农林科技大学植物病毒学实验室保存;PCR 产物纯化试剂盒、质粒提取试剂盒、pGEM-T Vector 购自Promega 公司;TaqDNA 聚合酶、逆转录酶、dNTPs、氨苄青霉素、卡纳霉素、 DNA marker、IPTG、X-gal、Trizol 等购自大连宝生物公司(TaKaRa)。其他化学试剂均为国产化学纯。引物根据NCBI数据库已发表基因序列设计,由生工生物工程(上海)股份有限公司合成。用于克隆ASGV CP基因的引物序列分别为ASGV-CP1:5′-ATGAGTTTGGAAGACGTGC-3′,ASGV-CP2:5′-CTAACCCTCCAGTTCCAGA-3′。重组表达载体引物为ASGV-CP3: 5′-CG- CGGATCCAGTTTGGAAGACGTGC-3′,ASG- VCP4:5′-CCGGAATTCCTAACCCTCCAGTT- CCA-3′,其中下划线部分分别为EcoRⅠ和BamHⅠ酶切位点。
1.2 方 法
1.2.1 苹果叶片总RNA提取 采集苹果叶片,液氮研磨后采用Trizol试剂盒提取叶片总RNA,具体操作参照说明书。测定核酸OD260/OD280值、结合1.2%琼脂糖凝胶电泳检测RNA纯度及完整性。
1.2.2 ASGV cp基因克隆 以苹果叶片总RNA为模板,参照M-MLV逆转录试剂盒说明书合成cDNA第1链。反转录引物为oligod(T)-18。以反转录产物为模板,分别进行PCR扩增。反应条件为:94 ℃变性4 min,94 ℃ 45 s,45 ℃ 1 min,72 ℃ 1 min,30 个循环,72 ℃延伸10 min。PCR 产物经纯化试剂盒纯化后与pGEM-T Vector连接,热激法转化到DH5α大肠杆菌中,在LB/Amp/IPTG/X-gal 平板上筛选克隆,挑取阳性克隆送生工生物工程(北京)股份有限公司测序,测序结果采用BLASTn工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行在线比对,采用ClustalW (http://www.ebi.ac.uk/Tools?clustalw2/index.html)软件进行序列分析。
1.2.3 原核表达载体构建 以获得的含有目标基因的质粒为模板,PCR扩增添加酶切位点,扩增条件同上。PCR产物连接到pGEM-T Vector上,选取测序验证的阳性克隆,经EcoRⅠ和BamHⅠ双酶切后,与同样酶切处理的pET30a在16 ℃下连接过夜,连接产物转化大肠杆菌DH5α后,挑取克隆并提取质粒酶切鉴定。
1.2.4 重组融合蛋白的诱导条件优化 将酶切鉴定阳性的质粒转化大肠杆菌BL21,鉴定的阳性单克隆37 ℃振荡培养过夜后,按1%接种量接种到新的LB液体培养基(含有100 mg·L-1Kanamycin)中,分别在28 ℃、32 ℃和37 ℃振荡培养至OD600达到0.6 ~ 0.8 时,添加终浓度为0.5 mmol·L-1的IPTG 诱导0 h、2 h、4 h和6 h,分别收集菌体。用适量的细胞裂解缓冲液悬浮菌体,经超声波破碎,12 000 r·min-1离心10 min,分离上清液与沉淀,悬浮沉淀后进行SDS-PAGE 分析。以未诱导培养物为阴性对照。
1.2.5 蛋白纯化与抗体制备 在最适表达条件下诱导表达目的蛋白,收集菌体后经超声波破碎,离心收集的上清通过His-Tag层析柱进行层析纯化,用平衡缓冲液漂洗去除杂蛋白后洗脱目的蛋白。纯化后的目的蛋白委托武汉爱博泰克生物科技有限公司制备抗体。
1.2.6 蛋白免疫印迹分析 提取苹果叶片总蛋白,SDS-PAGE电泳分离后电转移到PVDF膜,封闭后加入适量稀释的抗体,再加入二抗羊抗兔IgG-HRP,进行Western blot 分析。
1.2.7 DAS-ELISA检测 包被缓冲液稀释抗体后加入酶联板,37 ℃孵育2 h。取病叶用PBS缓冲液( pH 6.5) 研磨,离心后取上清滴加至酶联板,4 ℃孵育过夜。加入稀释的酶标抗体37 ℃孵育2 h。加入底物后用酶标仪在405 nm处读取OD值。
2 结果与分析
2.1 ASGV CP基因克隆及表达载体构建
提取苹果叶片总RNA后,采用引物ASGV- CP1/2扩增ASGV CP基因。扩增产物测序结果表明,目标片段为714 bp,预测编码237个氨基酸。所扩增基因与GenBank数据库(http://www.ncbi.nlm.nih.gov/)中ASGV不同分离物的 CP基因核苷酸同源率为88.80%~91.90%。采用引物ASGV-CP3/4在目标基因两端添加酶切位点EcoRⅠ和BamHⅠ,回收酶切产物并克隆至原核表达载体pET30a(+)。经PCR和测序验证,序列正确的载体命名为pE-ASGV-CP。融合表达的重组蛋白含有6×his标签,用于蛋白 纯化。
2.2 ASGV CP的诱导表达
将pECASGV-CP转化大肠杆菌BL21后诱导表达,SDS-PAGE 分析表明:与阴性对照比较,含有pE-ASGV-CP的BL21经IPTG诱导,在35 ku处出现预期的特异性蛋白表达条带。在37 ℃ 培养条件下,诱导后2 h即出现特异性条带,诱导 4 h和6 h后该条带表达量逐渐略有增加,但变化量不大。在28 ℃、32 ℃ 和37 ℃表达条件下诱导4 h后,各温度条件下均获得目标蛋白的特异性表达,表达量基本一致(图1)。进一步经超声波破碎后分析发现,目标蛋白在各温度条件下均出现在沉淀中,上清液中几乎不可见目标蛋白的表达。表明目标蛋白是以包涵体的形式在细胞中获得表达。洗脱后纯化蛋白主要在目标蛋白洗脱液中,在杂蛋白洗脱液中几乎不可见目标蛋白(图2)。
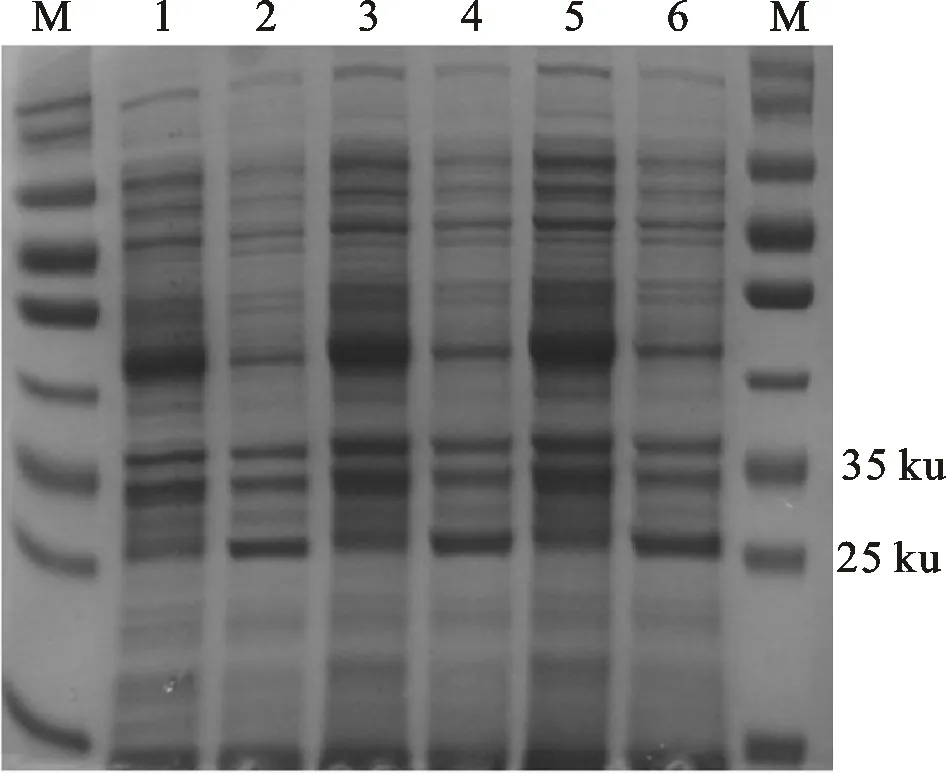
M.预染蛋白Marker;1、3、5.pE-ASGV-CP分别在28 ℃、 32 ℃和37 ℃的非诱导表达;2、4、6.pE-ASGV-CP分别在28 ℃、32 ℃和37 ℃的IPTG诱导表达
M.Pre-stained protein ladder,1,3,5.BL21 control of pE-ASGV-CP inE.coilat 28 ℃,32 ℃ and 37 ℃; 2,4,6.Induced pE-ASGV-CP expression inE.coilwith IPTG at 28 ℃,32 ℃ and 37 ℃
图1 ASGV CP原核表达分析
Fig.1 Protein expression of ASGV CP inE.coil

M.预染蛋白Marker;1.pE-ASGV-CP非诱导表达;2.pE-ASGV-CP的IPTG诱导表达;3.pE-ASGV-CP诱导表达经超声破碎后上清液;4、5.pE-ASGV-CP诱导表达经超声破碎后沉淀物;6、7、8.非目标蛋白纯化;9.ASGV CP纯化
M.Pre-stained protein ladder;1.BL21 control of pE-ASGV-CP inE.coil;2.IPTG induced pE-ASGV-CP expression inE.coil;3.Supernatant of pE-ASGV-CP protein expression broken by ultrasonic wave;4,5.Precipitation of pE-ASGV-CP protein expression broken by ultrasonic wave; 6,7,8.Elution of non-targeted protein; 9.Elution of ASGV CP
图2 ASGV CP过柱纯化
Fig.2 Protein purification of ASGV CP with column
2.3 抗体制备及检测
纯化的蛋白委托公司制备多克隆抗体。制备的抗体采用ID-ELISA测定效价。将诱导表达的ASGV CP蛋白(500 ng/mL)包被酶联板,采用ELISA法测定抗体效价。当血清稀释度达 12 800后,其P/N值(OD405抗血清/OD405阴性血清)仍大于2.0,这表明所制备的抗体效价达到 1/12 800以上。
以稀释2 000 倍的抗血清作为二抗,提取苹果叶片总蛋白后,采用Western blot进行蛋白杂交分析。结果显示,在预期大小的位置处,所制备抗体能与植物总蛋白发生特异性反应。抗体对目标蛋白结合的特异性较好,背景清晰,且与阴性对照没有特异性反应(图3)。

M.预染蛋白Marker;1、3.ASGV感染苹果样品;2、4.健康苹果样品
M.Pre-stained protein ladder;1,3.Total protein of ASGV infected apple; 2,4.Negative control of healthy apple
图3 ASGV CP抗体Western Blot 分析
Fig.3 Western Blot analysis of ASGV CP
特异性评价:以脱毒组培苗为健康对照,以分别感染ASGV、ASPV和ACLSV的苹果组培苗为材料,研磨提取健康汁液和病汁液包被酶标板,采用DAS-ELISA法测定所制备抗体特异性。分析结果表明,该抗体仅与ASGV样品发生反应,与其他病毒样品及健康对照均无血清学反应。
2.4 苹果样品检测及应用
2.4.1 高通量检测及与RT-PCR方法的比较 取23份经RT-PCR检测为阳性的田间苹果样品,采用制备的抗体通过DAS-ELISA法检测ASGV。检测结果表明其中21份为ASGV阳性。进一步分析2份阴性样品发现,其RT-PCR检测表现为弱阳性。对38份经RT-PCR检测为阳性的带毒组培苗进行DAS-ELISA检测,所有的样品均可检出ASGV。这表明本研究所制备的ASGV抗体可通过DAS-ELISA法用于ASGV的检测,检测结果与RT-PCR法基本一致。
2.4.2 陕西多地苹果样品检测 采用DAS-ELISA法测定陕西主要苹果产区ASGV发生情况。检测结果表明,陕西各主要苹果产区ASGV均普遍发生。其中富县(71.3%)、洛川(75.3%)、宜君(78.9%)、白水(73.8%)、耀州(74.5%)等地的发生率均在70%以上;黄陵(66.7%)、彬州(64.4%)、陇县(62.3%)、千阳(65.7%)、礼泉(63.8%)、扶风(67.5%)、歧山(63.6%)等地 ASGV发生率在60%~70%;低于60%的仅有乾县(59.6%)和富平(58.7%)两个产区。
采用DAS-ELISA法对苹果脱毒苗进行检测,ASGV的带毒率为6.25%。其中,T337的 8株脱毒苗、玉华早富的8株脱毒苗、以及丽噶的8株脱毒面未检出ASGV;富士冠军的8株脱毒苗中,有2株为ASGV阳性。
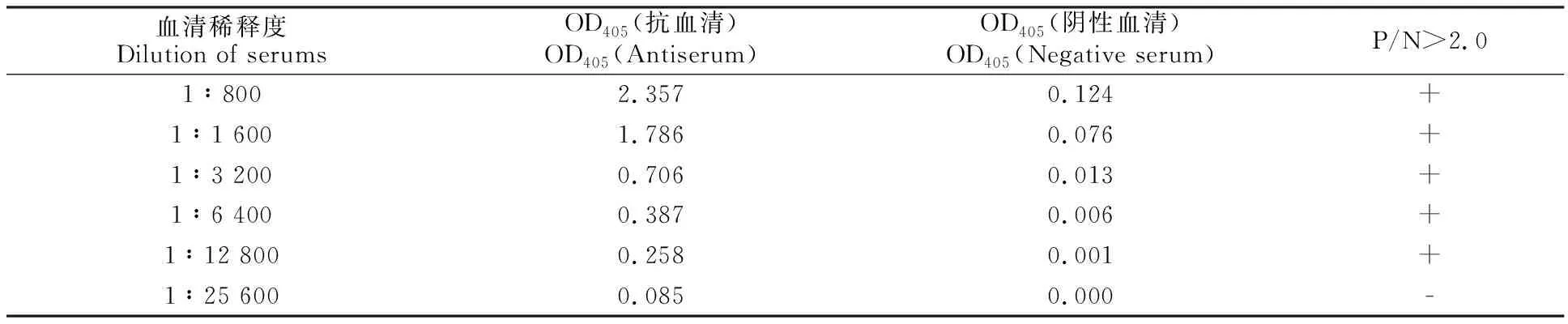
表1 ID-ELISA测定CP抗血清效价Table 1 Titer determination of prepared antiserum against recombinant CP by ID-ELISA
注:P/N值为OD405(抗血清)/ OD405(阴性血清)。P/N值大于2.0为阳性结果。如果OD405(阴性血清)值小于0.05,则在P/N值计算中取0.05。
Note:P/N is OD405(antiserum)/ OD405( negative serum). The positive result means that P/N value is over 2.0. If the value of OD405( Negative serum) is less than 0.05,0.05 is taken for P/N value calculation.

表2 DAS-ELISA测定抗血清特异性Table 2 Specificity evaluation of prepared antiserum by DAS-ELISA
注:OD405为抗血清值,健康样品的OD405阴性血清值为0.012。
Note:OD405is for antiserum,and OD405for negative control from healthy samples is 0.012.
3 讨 论
基于血清学的病毒蛋白检测是病毒研究的重要工具[21-22]。一方面,在病毒检测中,采用DAS-ELISA等血清学技术可以实现病毒材料的高通量分析,适用于对田间样品和脱毒材料的初筛检测[23-24];另一方面,病毒蛋白的表达在病毒与寄主互作过程中发挥重要作用,对寄主中病毒蛋白表达的检测需要利用相应抗体[19-20]。
本研究采用原核表达的方法制备ASGV CP蛋白,纯化后制备蛋白抗体。经DAS-ELISA和Western blot分析,所制备的抗体可用于这两种检测方法。在本研究中,采用DAS-ELISA法分别检测陕西苹果主要产区ASGV病毒的发生情况。检测结果表明,ASGV在陕西苹果主要产区严重发生,各产区ASGV发生率在60%以上。基于血清学的DAS-ELISA检测方法具有检测样品制备简单、仪器设备要求较低、低成本和高通量等优势,适合于进行田间样品的大规模检测。病毒脱除是控制苹果病毒病的主要策略和措施[25]。在病毒脱除的各环节中,进行病毒检测以剔除带毒苗是获取无毒苗木的重要内容。本研究采用DAS-ELISA法测定脱毒组培苗的ASGV带毒情况。检测结果发现脱毒苗带毒率较低,且检测结果与RT-PCR法一致。同时,本研究所制备的抗体仅与ASGV发生反应,而与潜隐病毒ASPV和ACLSV不存在血清学反应。在含有ASGV的混合感染样品中,也可以检测到ASGV。不含有ASGV的混合感染样品,则表现为血清学阴性反应。这表明本研究制备的抗体可用于脱毒苗的ASGV病毒检测。
外壳蛋白被认为参与病毒的侵染过程[26-27],CP作为ASGV的结构蛋白,其表达和分布与病毒的侵染与复制密切相关。但是,与 ASGV CP互作的寄主因子目前还不清楚。为此,需要检测病毒侵染过程中CP的表达量变化,并分析其与潜在的寄主因子互作关系。本研究采用Western blot分析苹果叶片中病毒蛋白表达。所制备的抗体与健康叶片总蛋白无血清学反应,而与ASGV感染叶片的总蛋白有特异性条带表现。这表明本研究做制备的抗体可用于检测植物材料中的病毒蛋白表达。
