丙酮酸激酶M2在骨肉瘤中的表达及其生物学功能
2020-06-02鞠薇薇于生金林黎娟吕秀梅滕小宇江黎黎
鞠薇薇, 于生金, 林黎娟, 吕秀梅, 滕小宇, 江黎黎*
(1.辽东学院 医学院 分子医学研究室, 辽宁 丹东 118003; 2. 丹东市第一医院 病理科, 辽宁 丹东 118003)
骨肉瘤是儿童和青少年时期最常见的高级别恶性肿瘤,早期就可以发生远处转移.近年来,随着诊疗手段的进步和靶向治疗的成熟,5年存活率有所提升,但是由于该肿瘤具有易转移、易复发和肿瘤耐药已发生等特点,增加了骨肉瘤患者的不良预后,骨肉瘤依然是全世界儿童癌症相关死亡的主要原因[1].因此,深入了解骨肉瘤的发生及发展的分子机制,寻找有效的治疗策略和分子靶标对于骨肉瘤治疗至关重要.丙酮酸激酶(pyruvate kinase,PK)是糖酵解的关键酶,催化磷酸烯醇式丙酮酸生成丙酮酸[2].PK具有4种同工酶,L型、R型、M1型和M2型,其中M2型即丙酮酸激酶M2(PKM2).通常不同组织和细胞表达不同亚型的丙酮酸激酶,而在肿瘤的形成过程中,丙酮酸激酶亚型的表达都逐渐失去其组织特异性[3],并最终转变为以表达PKM2为主,PKM2的高表达在肿瘤组织中是一种普遍存在的现象,而PKM2的表达水平与多种肿瘤的临床分期和病理分级相关[4].PKM2在骨肉瘤方面的功能及分子机制方面尚不清楚.
本研究拟检测PKM2在骨肉瘤组织中的表达水平及其与骨肉瘤患者临床病理指标之间的关系,并初步探讨其中可能的分子机制,以期为深入研究PKM2在骨肉瘤中的作用提供临床和实验依据.
1 资料与方法
1.1 资料与材料
1.1.1 患者资料
收集丹东市第一医院2007年1月至2013年12月期间手术切除的骨肉瘤患者组织标本90例.所有病例经病理确诊,且患者术前均未经放化疗及其他生物治疗.入选患者均知情同意,临床信息见表1.同时,利用https://hgserver1.amc.nl/cgi-bin/r2/数据库中的88例骨肉瘤患者分析骨肉瘤组织中PKM2mRNA表达水平与患者生存预后的关系.
1.1.2 细胞及试剂
细胞系U2OS和MG63购自中国科学院细胞库,兔抗人PKM2多克隆抗体(15822-1-AP)购自美国Proteintech公司,鼠抗人单克隆抗体P21(F-5)、P27(F-8)、cyclinD1(A-12)、β-actin(C-2)均购自美国Santa Cruz公司,免疫组化用一抗稀释液、通用二抗(PV-6000)及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司.蛋白质印记所用二抗购自美国Cell Signaling Technology公司.PKM2抑制剂Shikonin购自美国Sigma-Aldrich公司.
1.1.3 实验动物
8周龄裸鼠10只,雄性,平均体质量20 g,购自北京维通利华公司.
1.2 方法
1.2.1 免疫组化染色及评分
免疫组化染色按照常规程序利用德国Dako公司 Link48全自动免疫组化仪进行染色,一抗用抗体稀释液1∶200稀释.免疫组化结果由两名病理学家独立盲评,评分方案为:0,无染色;1+,胞质弱阳性;2+,胞质染色中等强度;3+,胞质强阳性.评分为2+或3+的肿瘤为高表达,评分为0或1+的肿瘤为低表达.
1.2.2 细胞培养及沉默细胞系的构建
U2OS细胞用含有质量分数为10%胎牛血清的培养液McCoy′s 5A培养,MG63细胞用含有质量分数为10%胎牛血清的培养液MEM培养,置于37 ℃、体积分数为5% CO2的恒温培养箱中.将PKM2-shRNA序列5′-GTTCGGAGGTTTGATG-AAATC-3′插入到慢病毒载体pLKO.1中,构建沉默PKM2的质粒;随后在293T细胞中包装病毒.48 h后收集病毒分别感染U2OS和MG63细胞,嘌呤霉素筛选后获得稳定沉默PKM2的U2OS和MG63细胞.
1.2.3 蛋白质印迹
采用浓度分别为50 mmol/L的Tris-HCL (pH=7.5)、150 mmol/L的NaCl、体积分数分别为1%的NP-40、0.5%脱氧胆酸盐、0.1%十二烷基硫酸钠组成的裂解液提取细胞内蛋白,BCA法测量蛋白浓度并均一.50 μg总蛋白利用质量分数为10%凝胶电泳分离,然后250 mA转膜2 h转移到PVDF膜.质量分数为5%脱脂奶粉室温封闭1 h,一抗4 ℃过夜孵育,二抗室温1 h孵育.使用增强型化学发光试剂检测系统检测信号,Western blot成像仪成像,Image J 软件分析蛋白条带灰度值.
1.2.4 CCK8绘制生长曲线
取对数生长期细胞,制备单细胞悬液并计数,于96孔板内每孔接种1 000个细胞,不同时间点(24、48、72、96及120 h)在对应的孔板中分别加入10 μL的CCK8溶液,孵育4 h后用酶标仪测各孔的光密度(optical density, OD),绘制生长曲线.
1.2.5 二维克隆形成实验
胰酶消化细胞制备单细胞悬液,于6孔板中每孔接种1 000个细胞,两周后弃去培养液,在-20 ℃用甲醇固定克隆6 min,结晶紫溶液室温染色.显微镜下计数>50个细胞的克隆数.
1.2.6 Soft agar克隆形成实验
用双蒸水配制质量分数分别为0.7%和1.2%的琼脂糖,高压灭菌后置42 ℃水浴中保持融化状态.取等体积的质量分数为1.2%的琼脂糖和2倍DMEM混匀,每孔1.5 mL加入6孔板,室温凝固.制备单细胞悬液,调整细胞密度为5×104/mL,取等体积的质量分数为0.7%的琼脂糖和2倍DMEM混匀,加入100 μL细胞悬液混匀,取1 mL加入已经固化的下层胶上.37 ℃孵箱培养14 d,结晶紫1 h染色.计数比较各组克隆形成情况.
1.2.7 Transwell实验
用不含血清的培养液制备单细胞悬液并计数,上室中加入1×104细胞,在下室中加入500 μL含质量分数为10%胎牛血清的培养液; 16~24 h后,棉签擦拭上室中未穿过小室膜的细胞,结晶紫染色后在显微镜下采集图像,光学显微镜下随机计数并进行统计分析.
1.2.8 划痕愈合实验
制备单细胞悬液,每孔5×105细胞接种于6孔板中,培养16~24 h后形成单层细胞.用10 μL移液抢枪头或者无菌牙签在细胞表面呈“一”字划痕,PBS清洗至无脱落细胞,更换无血清培养基继续培养,分别于24、48 h在显微镜下拍照并测量划痕宽度.
1.2.9 动物实验
8周龄裸鼠10只,SPF级屏障系统饲养.裸鼠随机分成2组,对照组shctrl(5只)和PKM2沉默组shPKM2(5只);取两组的对数生长期U2OS细胞shctrl和shPKM2,制备单细胞悬液,离心后用生理盐水清洗2次.两组细胞以5×105/点接种于裸鼠腹股沟皮下,观察成瘤情况,每天测量肿瘤直径,计算肿瘤体积(肿瘤体积=长×宽2/2)于接种后23 d麻醉小鼠,剥取瘤块.
1.2.10 流式细胞学分析
取对数生长期U2OS和MG63相关细胞,制备单细胞悬液至流式管内,150×g/min离心去上清,冰PBS冲洗细胞2~3次,体积分数为75%乙醇4 ℃固定4 h,每1 mL PBS中加入20 μL碘化丙锭(质量浓度为50 μg/mL)和50 μL RNase (质量浓度为10 mg/mL)制备上样缓冲液,每管样品用1 mL上样缓冲液重悬后,避光放置10 min,用美国贝克曼 Quanta SC流式细胞仪检测细胞周期.
1.3 统计学方法
2 结果
2.1 PKM2在骨肉瘤组织中的表达及其与患者临床病理指标之间的关系
免疫组织化学染色结果(图1A)显示,PKM2的阳性信号主要定位在骨肉瘤细胞的胞浆.根据染色评分结果,将90例骨肉瘤组织分成两组,高表达组51例,低表达组39例.分析PKM2表达水平与患者年龄、性别、肿瘤直径、远处转移及临床分期等临床病理指标之间的关系(表1).肿瘤直径≥5 cm的病例中PKM2的高表达率83.3%(30/36),远远高于直径<5 cm的病例(图1B).同时PKM2的表达水平与肿瘤远处转移(2=7.30,P=0.007)及临床分期均呈正相关(2=8.44,P=0.004)(图1C, D).
Kaplan-Meier单因素生存分析表明,PKM2的表达水平与患者总生存(图1E)和无转移生存(图1F)之间存在较强的相关性,组织中高表达PKM2的骨肉瘤患者预后较差.同时Cox多因素风险模型显示,除了肿瘤远处转移,PKM2高表达也是骨肉瘤患者生存预后的独立危险因素(P=0.03,表2).此外,经分析https://hgserver1.amc.nl/cgi-bin/r2/main.cgi的数据,结果也表明不管是总生存还是无转移生存,PKM2mRNA高表达的患者预后均较差(图1G, H).
2.2 沉默PKM2对骨肉瘤细胞增殖和迁移的影响
在骨肉瘤细胞系U2OS中沉默PKM2的表达(图2A),细胞的增殖能力显著被抑制(图2B,P<0.05).同时,二维克隆形成实验(图2C)和Soft agar克隆形成实验(图2D)结果发现,沉默PKM2的表达可以显著抑制细胞的二维克隆形成(t=11.28,P<0.01)及悬浮克隆形成(t=5.42,P<0.01)的能力.
划痕愈合实验(图2E)和Transwell迁移实验(图2F)结果显示,沉默PKM2的表达对细胞迁移能力也有显著的抑制作用(P<0.05).在骨肉瘤细胞系MG63中,重复上述实验,得到一致的结果.沉默PKM2后,细胞的增殖能力、克隆形成能力以及迁移能力均受到显著的抑制(P<0.05, 图3).而且小鼠体内成瘤实验结果显示沉默PKM2可以显著抑制肿瘤的生长(t=3.80,P=0.02)(图3F, G).
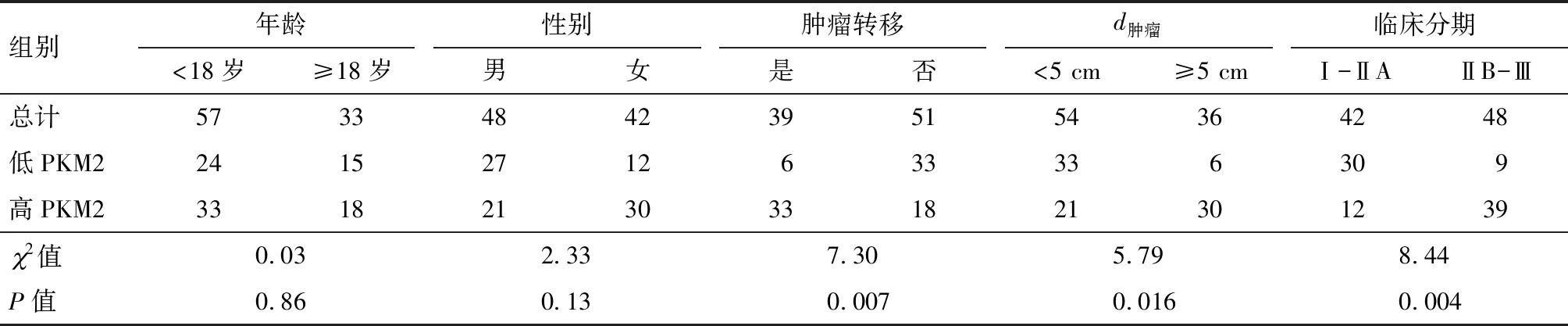
表1 PKM2蛋白表达水平与骨肉瘤患者临床病理指标

表2 骨肉瘤患者预后的多因素生存分析
2.3 抑制PKM2的活性对骨肉瘤细胞增殖和迁移的影响
利用PKM2的抑制剂shikonin作用于骨肉瘤细胞系U2OS和MG63,检测细胞的增殖、克隆形成以及迁移能力的变化.首先应用质量浓度为0.2 mg/L的shikonin作用于骨肉瘤细胞,与对照组相比,细胞的增殖明显受到抑制(图4A).而且,骨肉瘤细胞对该抑制剂有明显的质量浓度依赖性(图4B).此外,应用shikonin后细胞克隆形成以及迁移能力也受到显著的抑制(图4C, D).

A:免疫组化DAB染色检测PKM2在骨肉瘤组织中的表达(×200);B:PKM2表达水平与肿瘤直径之间的关系;C:PKM2表达水平与肿瘤转移之间的关系;D:PKM2表达水平与临床分期之间的关系;E:PKM2 对骨肉瘤患者总生存的影响;F:PKM2对骨肉瘤患者无转移生存的影响;G:PKM2mRNA对骨肉瘤患者总生存的影响;H:PKM2mRNA对骨肉瘤患者无转移生存的影响.
A: PKM2 expression in osteosarcoma tissues (DAB,staining×200); B: The relationship of PKM2 expression level and tumor diameter; C: The relationship of PKM2 expression level and distant metastasis; D: The relationship of PKM2 expression level and clinical stage; E: The effect of PKM2 expression on the overall survival; F: The effect of PKM2 expression on the metastasis-free survival; G: The effect of PKM2 mRNA expression on the overall survival; H: The effect of PKM2 expression on the metastasis-free survival.
图1 PKM2在骨肉瘤组织中的表达水平及其与肿瘤特征和患者预后的关系
Fig.1 PKM2 expression in osteosarcoma and the relationships with clinicopathological features
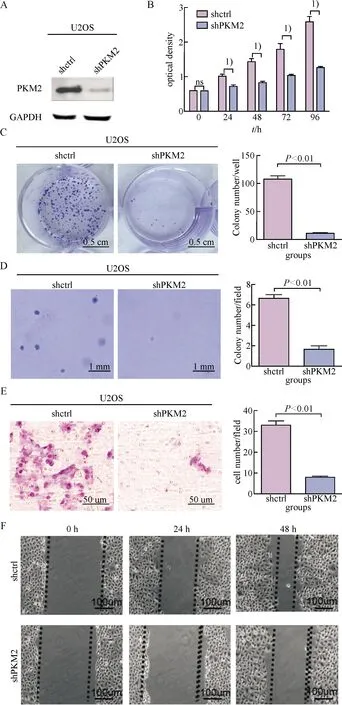
A:Western blot检测PKM2沉默效率;B:沉默PKM2对细胞增殖的影响, 1)两组比较,P<0.05;C:沉默PKM2对细胞克隆形成的影响;D:沉默PKM2对细胞悬浮克隆形成能力的影响;E:沉默PKM2对细胞迁移的影响;F:沉默PKM2对细胞迁移愈合能力的影响.
A: The expression of PKM2 was detected by Western blotting; B: The proliferation of shPKM2 and control cells was detected,1)P<0.05; C: The colony formation of shPKM2 and control cells was detected by colony formation assay; D: The colony formation of shPKM2 and control cells was detected by soft agar colony formation assay; E: The migration of shPKM2 and control cells was detected by transwell; F: The migration of shPKM2 and control cells was detected by wound-healing assay.
图2 沉默PKM2对骨肉瘤细胞U2OS生物学行为的影响
Fig.2 The effects of silencing PKM2 on the biological behaviors of osteosarcoma cell line U2OS
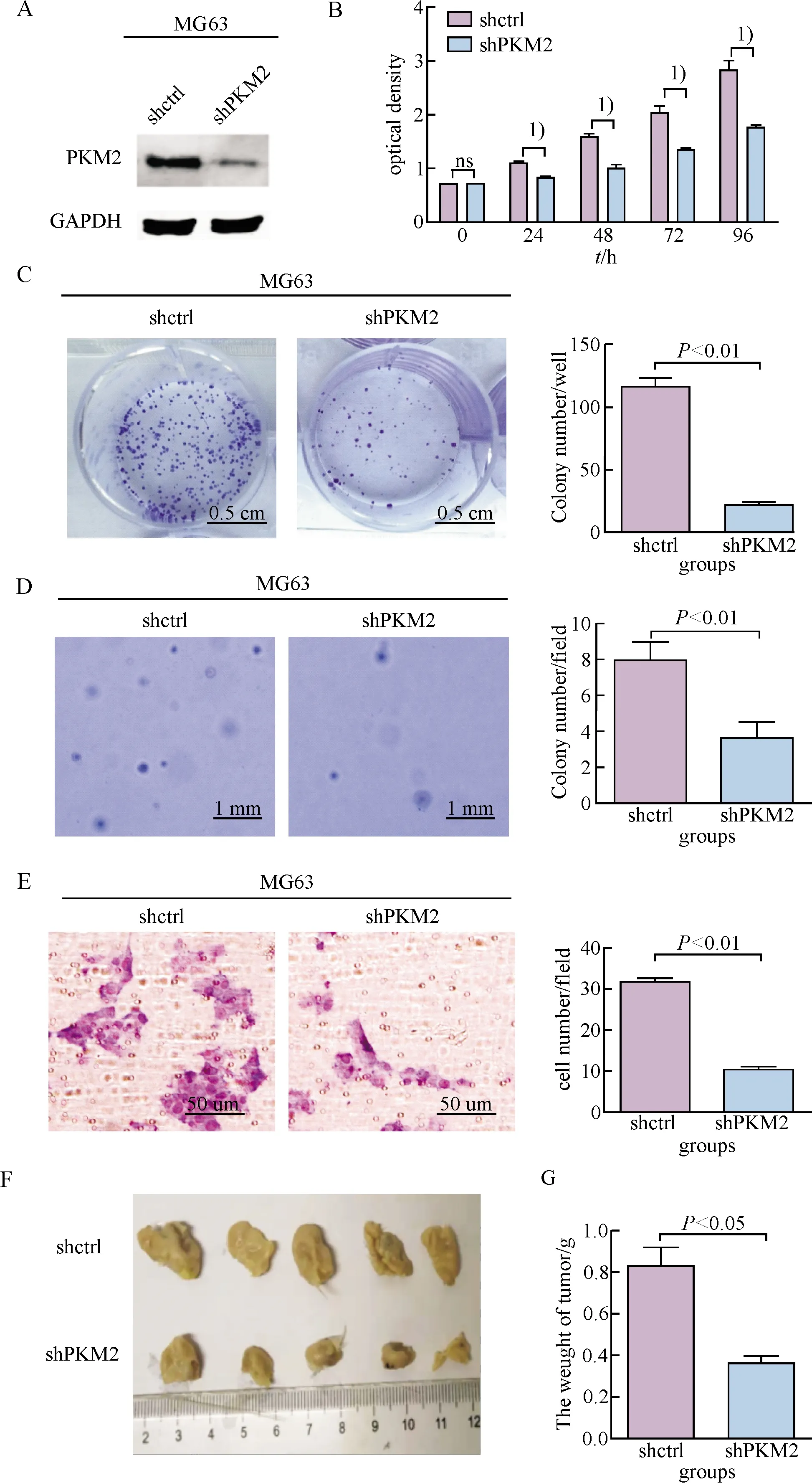
A:Western blot检测PKM2的表达水平;B:沉默PKM2对细胞增殖的影响, 1)两组比较,P<0.05;C:沉默PKM2对细胞克隆数量的影响;D:沉默PKM2对细胞悬浮克隆形成数量的影响;E:沉默PKM2对细胞迁移的影响;F:沉默PKM2对小鼠体内成瘤的影响;G:小鼠瘤块质量的差异.
A: The expression of PKM2 was detected by Western blotting, 1)P<0.05; B: The proliferation of shPKM2 and control cells was detected; C: The colony formation of shPKM2 and control cells was detected by colony formation assay; D: The colony formation of shPKM2 and control cells was detected by soft agar clony formation assay; E: The migration of shPKM2 and control cells was detected by transwell; F: The effect of shPKM2 on tumor proliferation in mice; G: The weight of tumor in mice.
图3 沉默PKM2对骨肉瘤细胞MG63生物学行为的影响
Fig.3 The effects of silencing PKM2 on the biological behaviors of osteosarcoma cell line MG63
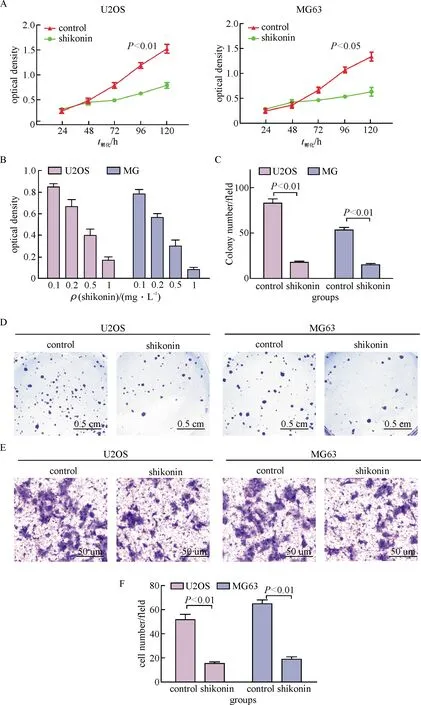
A: 0.2 mg/L shikonin对细胞增殖的影响;B:不同浓度shikonin 对细胞增殖的影响;C:shikonin对细胞克隆形成的影响;D:细胞克隆形成计数统计;E:shikonin对细胞迁移能力的影响;F:迁移细胞数统计.
A: The proliferation of shikonin and control cells was detected by MTT method; B: The effect of different dose of shikonin on cell detected; C: The colony formation of shikonin and control cells was detected by colony formation assay; D: Statistics of cell clone formation; E, The migration of shikonin and control cells was detected by transwell; F, Statistics of migration cell.
图4 PKM2抑制剂shikonin对骨肉瘤细胞U2OS和MG63生物学行为的影响
Fig.4 The effects of PKM2 inhibitor shikonin on the biological behaviors of osteosarcoma cell line U2OS and MG63
2.4 PKM2对骨肉瘤细胞周期和凋亡的影响
通过以上实验,已经明确PKM2在骨肉瘤细胞中高表达,而且PKM2可促进骨肉瘤细胞的增殖和迁移.采用流式细胞术检测PKM2对细胞周期的影响,结果显示,不管是利用PKM2抑制剂shikonin还是利用小RNA沉默PKM2,骨肉瘤细胞系U2OS的G1期细胞比例显著增多(P<0.05),即抑制PKM2可以使骨肉瘤细胞阻滞在G1期(图5A, B).
为了探讨其中的分子机制,利用Western blot方法检测抑制PKM2对骨肉瘤细胞CyclinD1表达水平的影响,结果提示抑制PKM2可以抑制CyclinD1的蛋白表达,促进p21Cip1和p27Kip1的表达(图5C).
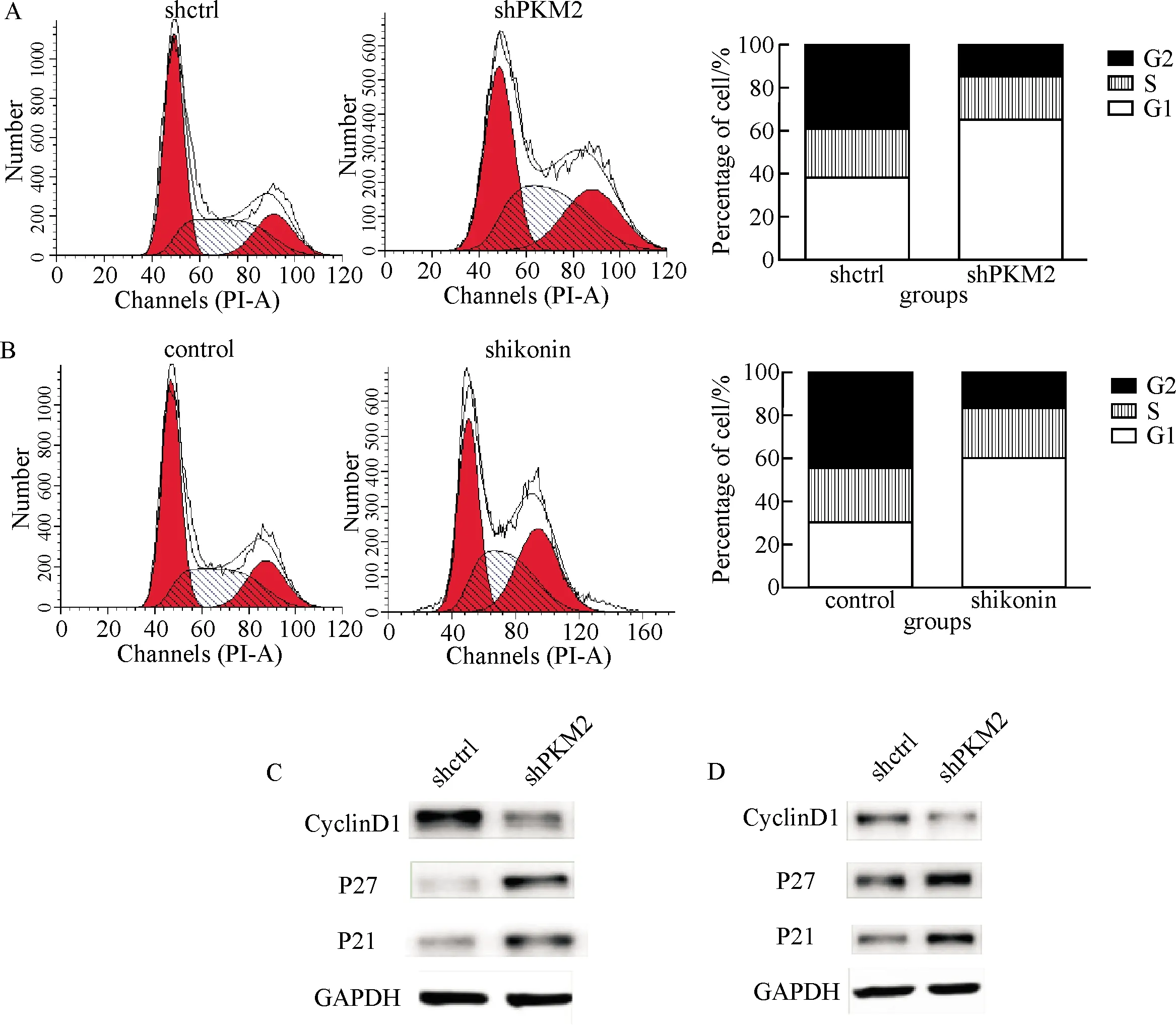
A: The effect of shikonin on cell cycle; B: The effect of shPKM2 on cell cycle; C: The effect of shPKM2 on CyclinD1, P21 and P27 expression; D: The effect of shikonin on CyclinD1, P21 and P27 expression.A.沉默PKM2对细胞周期的影响;B.抑制剂shikonin对细胞周期的影响;C.沉默PKM2对细胞内CyclinD1、p21、p27表达水平的影响;D.抑制剂shikonin对细胞内CyclinD1、P21、P27表达水平的影响.
3 讨论
恶性肿瘤不仅是一种与基因有关的疾病,更是一种能量代谢性疾病.肿瘤细胞为了满足其快速增殖的需要,其利用核酸、氨基酸、脂质和碳水化合物等物质的量必须翻倍,所以肿瘤细胞必将调整其代谢行为,尽可能利用可获取的营养物质,特别是对糖类物质的快速利用和消耗[5].与正常细胞代谢葡萄糖的方式不同,大多数肿瘤细胞即使在氧气充足时依然优先选择产生大量乳酸的糖酵解途径进行葡萄糖代谢,这种特有的能量获取方式被称为“Warburg 效应”[6]. 目前,“Warburg效应”作为肿瘤的一个典型标志已被广泛认可[7],而且在Cell杂志发表的综述上已经将该特性列入肿瘤十大特征之一[8].
丙酮酸激酶是葡萄糖代谢的关键酶,其活性决定着细胞的糖酵解方式和代谢底物水平.PKM2是丙酮酸激酶的一个亚型,PKM2的表达可能与Warburg效应直接相关[9-10].除了调控代谢,PKM2还可进入细胞核,参与基因转录调控[11].同时,PKM2作为蛋白激酶可以激活100多种蛋白,其中包括ERK1/2,PKM2的持续活化促进肿瘤细胞的增殖和迁移[12].研究发现PKM2在多种上皮来源的肿瘤细胞中高表达,而且PKM2的表达水平与肿瘤的临床分期和病理分级呈正相关[13-15].但间质来源的肿瘤PKM2的表达情况及其在骨肉瘤中的作用尚未清楚.
在本研究中,检测PKM2在骨肉瘤组织中的表达水平,并分析PKM2的表达水平与骨肉瘤患者临床病理指标之间的关系,结果发现PKM2表达水平与肿瘤直径、远处转移和临床分期有关,即PKM2高表达的患者肿瘤体积较大、容易发生远处转移、临床分期较高;而且,癌组织中PKM2表达水平较高的骨肉瘤患者不管是总生存还是无转移生存,预后均较差,PKM2高表达是骨肉瘤患者的独立预后因素.因此推测PKM2在骨肉瘤的恶性进展过程中可能发挥着重要的作用,与PKM2在其他肿瘤中的临床意义是一致的[16].
同时,本研究细胞实验结果进一步对临床实验结果进行了佐证,PKM2沉默后,骨肉瘤细胞的增殖、克隆形成及迁移能力均受到显著的抑制;而且小鼠体内成瘤能力也受到显著的影响,PKM2沉默组细胞的肿瘤体积明显小于对照组.同时,利用PKM2的抑制剂也得到了相同的结果,应用shikonin后,细胞的增殖能力、克隆形成能力、迁移能力均受到抑制,与PKM2在其他肿瘤细胞的生物学功能和意义是一致的[10].为探究其中的分子机制,利用流式细胞术检测了PKM2对骨肉瘤细胞的细胞周期和凋亡的影响.本研究结果显示抑制PKM2可以使细胞周期阻滞在G1期,而且抑制PKM2后骨肉瘤细胞内CyclinD1的表达水平显著下降,p21和p27的表达水平增加,提示PKM2通过调控细胞周期蛋白的表达水平进而影响细胞周期.而PKM2是如何影响骨肉瘤细胞迁移能力需要进一步研究.
综上所述,本研究结果表明,PKM2在骨肉瘤恶性进展过程中起着重要作用,有可能成为骨肉瘤靶向生物治疗的潜在靶点.
