纵向分层应变评价早期系统性红斑狼疮左心室收缩功能及同步性改变
2020-06-02王方方张瑞芳武丽娜张秀婷
王方方,张瑞芳,武丽娜,张秀婷
(郑州大学第一附属医院超声科,河南 郑州 450052)
系统性红斑狼疮(systemic lupus erythematosus, SLE)为常见全身性结缔组织疾病,可累及多个脏器,心血管(cardiovascular, CV)为最常及累部位之一。心血管疾病(cardiovascular disease, CVD)是SLE患者致残和死亡的重要原因之一[1]。超过50%的SLE患者心脏受累时并无明显临床症状[2],但常规检查对此类亚临床心脏损伤并不敏感。本研究应用纵向分层应变技术分析SLE患者左心室心肌收缩功能及同步性,评价早期SLE左心室心肌改变。
1 资料与方法
1.1 一般资料 收集2019年4月—6月郑州大学第一附属医院诊治的42例SLE患者,男4例,女38例,年龄19~59岁,平均(36.9±11.3)岁,病程1个月~11年。纳入标准:①符合1997年美国风湿病学会SLE诊断标准;②左心室射血分数(left ventricular ejection fraction, LVEF)>55%;③不伴先天性心脏病、心肌病、冠心病、严重瓣膜病、中-大量心包积液、原发性高血压、糖尿病及严重肝肾功能不全等;④患者知情同意。排除标准:①年龄<18岁或>65岁;②超声图像质量欠佳或斑点追踪不成功;③合并其他结缔组织病;④妊娠期或哺乳期患者。采用SLEDAI-2000评分系统评估SLE疾病活动性指数(systemic lupus erythematosus disease activity index, SLEDAI),并据此将患者分为非活动期SLE(SLEDAI积分0~4分,SLE-)及活动期SLE(SLEDAI积分≥5分,SLE+)2个亚组。收集同期30名健康体检者作为对照组,男3名,女27名,年龄21~58岁,平均(37.1±9.7)岁,均排除高血压、糖尿病及心肺疾病等。
1.2 仪器与方法 采用GE Vivid E9彩色多普勒超声诊断仪,M5s二维探头,配有具备2D-strain功能的Echo PAC工作站。嘱受检者左侧卧,连心电图,待图像显示清晰且稳定后,采集包含3个心动周期的3个心尖切面(两腔心、三腔心、四腔心)的动态图像(40~80帧/秒)并储存于硬盘。采用盲法行脱机分析,打开Q-Analysis/2D strain模式,于收缩期图像手动描记心内膜边界,软件自动将左心室壁分成内、中、外3层,调整描记点以确保追踪满意。完成3个切面分析后,系统自动显示左心室17节段3层心肌纵向应变(longitudinal strain, LS)及相应的应变曲线、牛眼图及LS达峰时间的标准差(peak strain dispersion, PSD)。对以上指标均测量3次,取平均值。
1.3 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布的连续变量,采用独立样本t检验比较2组间均数,以单因素方差分析进行多组(包括亚组)均数比较,两两比较用LSD法。分类变量用百分数表示,2组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料及常规超声心动图参数比较 SLE组静息心率(resting heart rate, RHR)、收缩压、血脂代谢异常比例均高于对照组(P均<0.05); LVEF低于对照组减(P<0.01),但在正常范围内。组间其余资料及常规超声参数差异均无统计学意义(P均>0.05)。见表1。SLE组中,SLE+亚组补体C3低于SLE-亚组(P<0.05),2亚组间其余常规资料差异均无统计学意义(P均>0.05)。见表2。
2.2 分层应变参数比较 SLE组左心室各层及各节段心肌间LS仍保存梯度特征,即心内膜下整体心肌LS(global LS of endo-myocardium, GLSendo)>中层心肌整体LS(global LS of mid-myocardium, GLSmid)>心外膜下心肌整体LS(global LS of epi-myocardium, GLSepi)(P均<0.05);心尖段>中间段>基底段(P均<0.05)。见图1。与对照组比较,SLE组左心室整体、基底段及中间段心内膜下心肌LS(LS of endo-myocardium, LSendo)、中层心肌LS(LS of mid-myocardium, LSmid)、心外膜下心肌LS(LS of epi-myocardium, LSepi)均低于对照组(P均<0.05),心尖段3层心肌LS差异均无统计学意义(P均>0.05)。SLE组内,SLE+亚组左心室整体、基底段及中间段心内膜下心肌LS(LS of endo-myocardium, LSendo)、中层心肌LS(LS of mid-myocardium, LSmid)、心外膜下心肌LS(LS of epi-myocardium, LSepi)均低于对照组(P均<0.05),心尖段3层心肌LS差异均无统计学意义(P均>0.05);SLE-组左心室整体、基底段心内膜下心肌LS均低于对照组(P均<0.05)。2个SLE亚组之间整体及节段性3层心肌LS差异均无统计学意义(P均>0.05)。见表3、4及图2、3。
2.3 同步化参数比较 与对照组PSD[(30.27±9.86)ms]比较,SLE组PSD[(51.85±12.16)ms]升高(t=5.286,P<0.01),见图4;其中SLE-亚组[(49.00±12.82)ms]与SLE+亚组 [(52.83±11.82)ms]均升高(F=5.866,P<0.01),亚组间差异无统计学意义(P=0.369)。
表1 2组基本资料及常规超声指标比较(±s)
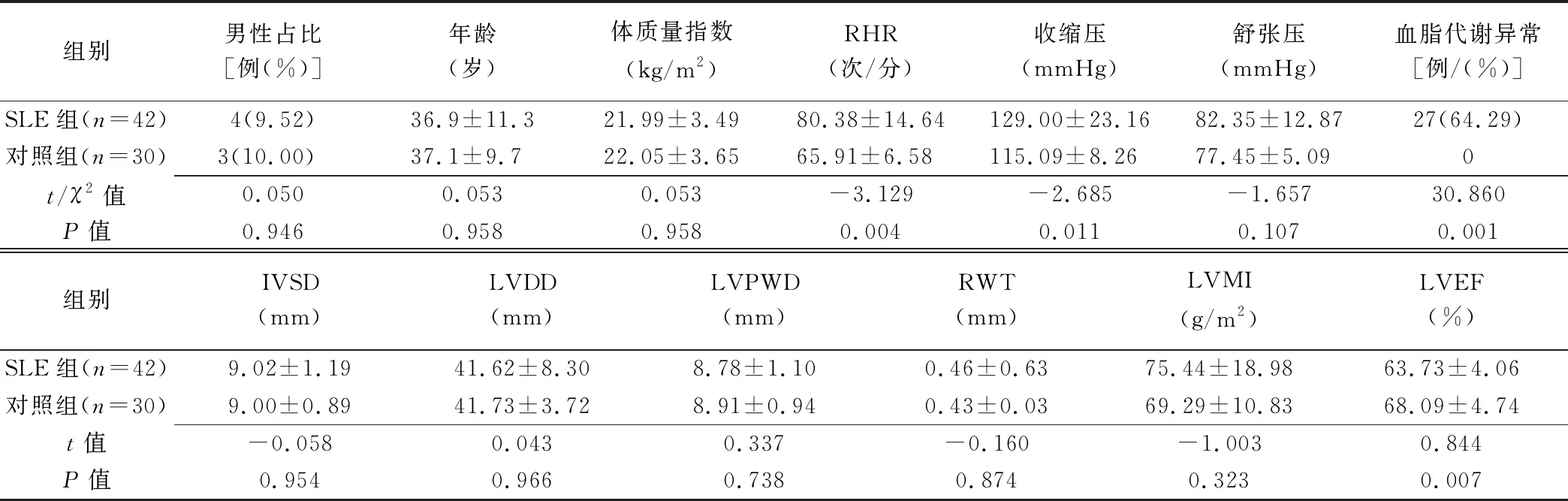
表1 2组基本资料及常规超声指标比较(±s)
组别男性占比[例(%)]年龄(岁)体质量指数(kg/m2)RHR(次/分)收缩压(mmHg)舒张压(mmHg)血脂代谢异常[例/(%)]SLE组(n=42)4(9.52)36.9±11.321.99±3.4980.38±14.64129.00±23.1682.35±12.8727(64.29)对照组(n=30)3(10.00)37.1±9.722.05±3.6565.91±6.58115.09±8.2677.45±5.090t/χ2值0.0500.0530.053-3.129-2.685-1.65730.860P值0.9460.958 0.958 0.004 0.011 0.107 0.001 组别IVSD(mm)LVDD(mm)LVPWD(mm)RWT(mm)LVMI(g/m2)LVEF(%)SLE组(n=42)9.02±1.1941.62±8.308.78±1.100.46±0.6375.44±18.9863.73±4.06对照组(n=30)9.00±0.8941.73±3.728.91±0.940.43±0.0369.29±10.8368.09±4.74t值-0.058 0.043 0.337 -0.160 -1.003 0.844 P值0.954 0.966 0.738 0.874 0.323 0.007
注:IVSd:室间隔舒张末期厚度(interventricular septum thickness at end-diastole);LVEDD:左心室舒张末期内径(left ventricle end-diastolic dimension);LVPWD:左心室后壁舒张末期内径(left ventricular posterior wall depth);RWT:相对室壁厚度(relative wall thickness);LVMI:左心室质量指数(left ventricular weight index)
表2 SLE组内2亚组间基本资料比较(±s)

表2 SLE组内2亚组间基本资料比较(±s)
组别发作次数补体C3(g/L)补体C4(g/L)红细胞沉降率(mm/h)C反应蛋白(mg/L)SLE-亚组(n=22)2.79±1.480.89±0.270.20±0.0724.50±18.073.36±4.48SLE+亚组(n=20)2.17±1.270.65±0.370.15±0.1237.17±29.797.20±12.66t值1.136 2.057 1.235 -1.333 -1.063 P值0.267 0.029 0.229 0.195 0.298

图1 心尖三腔心切面左心室内、中、外3层心肌的整体LS值及应变曲线 A.对照组; B.SLE组
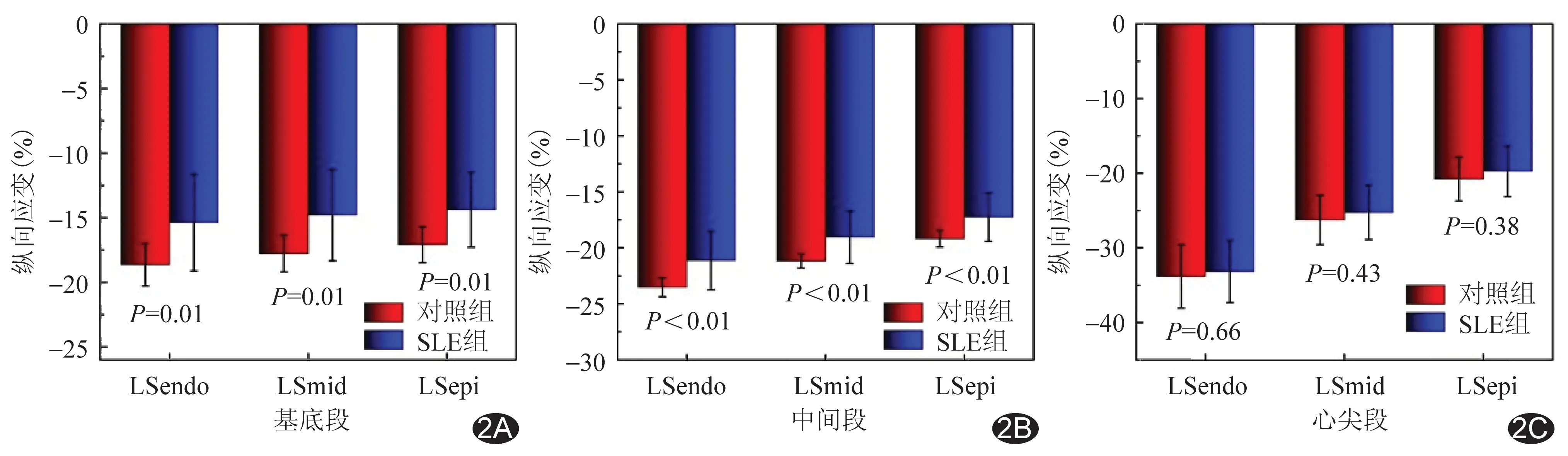
图2 SLE组与对照组左心室节段性3层心肌LS A.基底段; B.中间段; C.心尖段
表3 SLE组与对照组整体分层LS参数比较(%,±s)

表3 SLE组与对照组整体分层LS参数比较(%,±s)
组别GLSendo GLSmidGLSepiSLE组(n=42)-22.58±2.49-19.58±2.16-17.40±2.46对照组(n=30)-24.55±1.14-21.48±0.95-18.89±0.95t值-3.306 -3.717 -2.657 P值0.002 0.001 0.012
表4 各SLE亚组与对照组整体分层LS参数比较(%,±s)

表4 各SLE亚组与对照组整体分层LS参数比较(%,±s)
组别GLSendo GLSmidGLSepi对照组(n=30)-24.55±1.14-21.48±0.95-18.89±0.95SLE-组(n=22)-22.42±1.83*-20.02±1.52-17.86±1.33SLE+组(n=20)-22.18±3.14*-19.08±2.70*-16.52±3.41*F值3.488 4.786 2.908 P值0.042 0.015 0.046
注:*:与对照组比较P<0.05
3 讨论
相比普通人群,SLE患者出现不良心血管事件风险增加50倍[3]。SLE累及心肌引起心律失常、扩张型心肌病或心力衰竭等是患者死亡的独立预测因素[4],考虑以下因素参与其机制[5]:①心肌炎,免疫复合物沉积使补体激活,在心肌血管壁及肌束间出现补体及免疫球蛋白颗粒沉积,尤其疾病处于活动期时;②冠状动脉病变,主要累及微小血管,病理改变为免疫介导的血管损害及免疫复合物沉积,产生冠状动脉炎症,导致冠状动脉管腔狭窄甚至阻塞及远端小范围心肌灶性纤维化;③长期用药引起高血压、脂质代谢紊乱、糖尿病等,加速和导致动脉硬化。
SLE患者存在心脏自主神经功能障碍。RHR是评估自主神经功能障碍的无创指标。本研究中SLE组RHR明显高于对照组。既往研究[6]表明,RHR越高,SLE患者动脉僵硬度和全身低度炎症水平越高,提示维持RHR在正常范围较低水平可能对心血管有益。本研究中SLE组收缩压及血脂代谢异常比例均增高,可能与SLE患者常伴狼疮性肾炎及长期使用激素等药物治疗有关;SLE组与对照组IVSd、LVDED、LVPWD、RWT、LVMI差异均无统计学意义,LVEF虽减低但仍在正常范围内,提示常规超声心动图并不能敏感检出SLE患者左心室心肌早期改变。
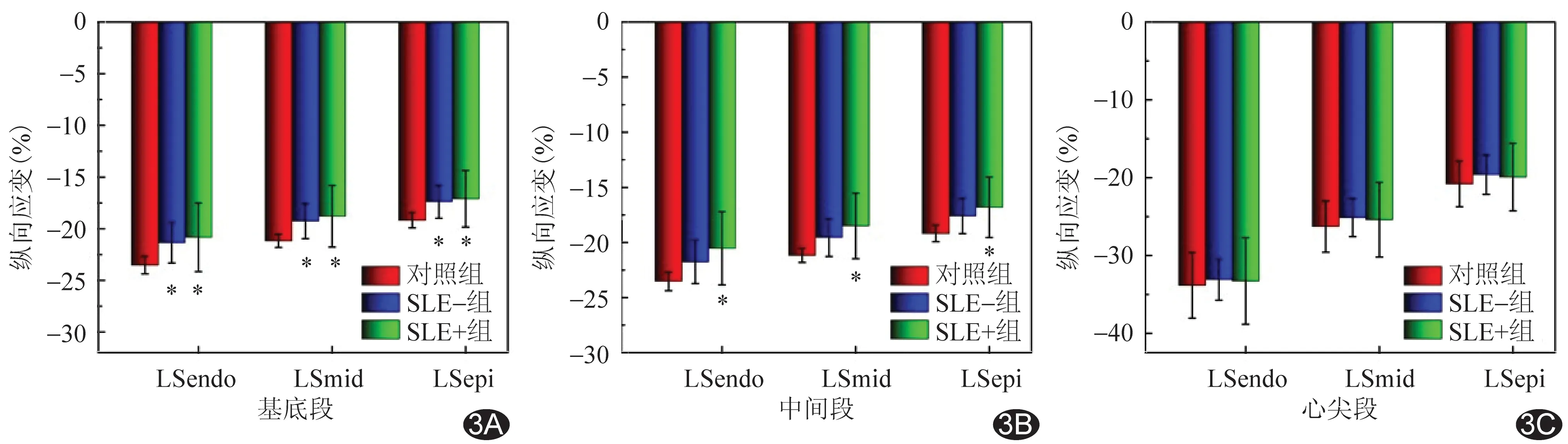
图3 SLE亚组与对照组左心室节段性3层心肌LS比较 A.基底段; B.中间段; C.心尖段(*:与对照组比较P<0.05)
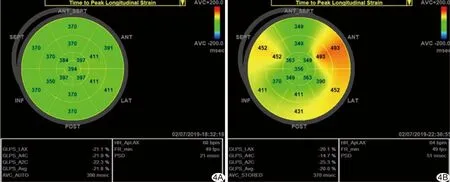
图4 17节段LS达峰时间牛眼图 A.对照组; B.SLE组
本研究结果显示SLE患者左心室心肌LS梯度特征仍与普通人保持一致,由内而外逐层递减,自基底到心尖逐段递增[7],但SLE组整体及节段性3层心肌LS均已低于对照组,提示左心室心肌受累时,应变峰值减低早于应变梯度改变。SLE组心尖段各层心肌LS与对照组差异均无统计学意义,提示SLE亚临床左心室纵向收缩功能受损首先出现在基底段和中间段,而左心室几何中心在近心尖处,该处心肌对保持左心室沿几何中心扭转及维持心腔内血流推向主动脉瓣口压力有重要作用,心尖段心肌功能受损相对滞后可能是SLE患者左心室心肌早期受损而LVEF保持在正常范围的原因之一。既往研究[8-9]发现SLE患者早期左心室GLS减低,但未对各层心肌进行逐层追踪分析,而内、中、外3层心肌对损伤的反应不尽相同[10]。作为评估心肌运动协调性的指标,PSD临床潜力巨大[11]。本研究应用分层应变技术对左心室心肌进行整体及节段性分层应变分析,发现SLE组PSD高于对照组,提示SLE患者存在亚临床左心室室壁运动同步性下降。多项研究[12-13]证实以二维斑点追踪成像获得LS对预测不同心脏疾病模型具有高度临床价值,应用基于二维斑点追踪成像的心肌分层应变成像评价SLE患者心脏损伤及预后临床应用潜力巨大。
SLE患者病情呈稳定与复发交替。既往研究[14]表明,C3水平与动脉粥样硬化性心血管疾病关系密切,提示控制C3水平有可能减少SLE患者心肌功能损伤。本研究中活动期与非活动期SLE患者补体C3差异有统计学意义,而LS和PSD差异均无统计学意义,考虑与样本量较少有关;SLE组中2个亚组左心室心肌纵向收缩功能及同步性均有不同程度改变,且活动期患者心肌受累范围相对较大,表明随病情进展,心内膜下心肌首先受累,其次是中间、心外膜下心肌。负责纵向运动的心内膜下心肌主要参与微血管疾病[15],采用纵向分层应变评估心肌异常程度可能为评价SLE病情进展提供参考;但目前尚缺乏相应的诊断标准,其潜在临床价值有待证实。
本研究的局限性:①分层应变技术对超声图像质量及受检者心率要求高,心内膜显示不清时追踪质量差,对心率变异大者无法生成牛眼图;②未与心脏MRI进行比较;③仅分析LS参数,未观察病情活动程度、病程、药物治疗时间及剂量等对左心室收缩功能的影响,有待进一步深入。
综上,纵向分层应变技术能较敏感地评估SLE患者亚临床左心室收缩功能及同步性改变,早期识别并监测心肌损伤,对临床及时进行有效干预有一定参考意义。
