NUP155基因突变与不明原因夜间猝死综合征及心律失常的关联性
2020-06-02黄二文郑晶晶成建定孙宏钰
任 涵,黄二文,郑晶晶,成建定,孙宏钰
(1.中山大学中山医学院法医学系,广东广州 510080;2.广东省法医学转化医学工程技术研究中心,广东 广州 510080)
不明原因夜间猝死综合征(sudden unexplained nocturnal death syndrome,SUNDS)是指发生于夜间或休息时无明显致死因素的一种猝死综合征[1]。SUNDS 的特点为:①男性居多(>90%);②死者年龄大多介于20~40 岁之间;③主要发生在东南亚或来自于东南亚的人群;④无重大疾病史;⑤在夜间睡眠或休息时出现典型症状,如呻吟和呼吸急促;⑥通过系统的法医病理学检查和毒物分析,未发现明显死因[2]。心脏离子通道疾病导致的原发性心律失常一直以来被认为是造成SUNDS的重要原因,如长QT 综合征、Brugada 综合征等[3-4]。核孔蛋白155(nucleoporin 155,NUP155)是组成核孔复合体(nuclear pore complex,NPC)的一种核孔蛋白(nucleoporin,NUP),人源NUP155蛋白含1391 个氨基酸残基,相对分子质量为155 ku[5]。NPC 是一种复杂的大分子结构,横跨两层核膜,介导细胞质和细胞核之间大分子物质的双向转运。NPC通过控制蛋白和mRNA 的转运,在调控基因表达中发挥重要作用。根据NUP 的功能可将其分为3 类:①跨膜NUP:将NPC 锚定在核膜上;②结构NUP:参与组装核孔的支架蛋白;③含有FG(苯丙氨酸-甘氨酸)的非结构NUP:形成核孔的渗透屏障和运输通道[6]。NPC 的结构支架可以看作由三个环堆叠而成[7]。细胞质环和核质环主要由保守的NUP107-NUP160 复合体构成,又被称为Y复合体[8-9]。夹在这两个外环之间的是内环,内环主要由NUP93 复合体(包括NUP93、NUP155、NUP53和两个旁系同源异构体NUP205和NUP188)组成[10]。2004 年,Oberti 等[11]发现一个乌拉圭房颤家系中的房颤患者在胎儿期或婴儿期即发病,并且最终都发生婴幼儿猝死。2007年,该家系中出生一名新的房颤患者,Zhang 等[12]通过对新生房颤患者进行研究,发现NUP155R39lH 纯合突变与房颤共分离。而家系内R39lH 杂合型突变携带者仅表现心电图P 波延长,未发生房颤和猝死。该研究通过对一个南美洲房颤家系进行基因检测,首次将NPC 与遗传性心律失常和猝死联系起来。然而NUP155基因突变与亚洲人群,尤其是中国汉族人群SUNDS 和心律失常患者的相关性研究仍是空白。本研究对中国汉族人群中SUNDS 和心律失常患者的NUP155进行基因测序分析,从而探讨NU155 基因突变与心律失常及SUNDS 的相关性。
1 材料与方法
1.1 病例资料
收集2005 年1 月至2014 年12 月期间,中山大学法医鉴定中心受理的40 例SUNDS 散发案例,作为SUNDS 组。纳入标准:①中国汉族男性,年龄≥18 岁,②生前体健,无重大疾病,③睡眠中或休息时发生猝死。排除标准:尸体解剖、毒物学、组织学或死亡现场调查有明确死因。除SUNDS案例外,另收集2014 年1 月至6 月就诊于中山大学附属第一医院的30 例心律失常病例,作为临床组。纳入标准:①中国汉族,年龄≥18岁,②快速性心律失常,包括早搏、心动过速、心房颤动、心房扑动、心室颤动,③左室射血分数(left ventricular ejection fractions,LVEF)≥50%。排除标准:彩超或胸片显示心脏结构严重异常。
将SUNDS 和临床组合并为实验组。以千人基因组数据库(1000 Genomes)与ExAC 数据库中东亚人群作为人群对照组。本研究通过中山大学伦理审查会批准,所有受试者均签署知情同意书。
1.2 实验试剂
GoTaq®DNA 聚合酶(普洛麦格北京生物技术有限公司),磁性DNA 半定量提取试剂盒(长春市博坤生物科技有限公司),DNA 提取试剂盒(中国美基生物公司),Qubit®2.0 荧光仪,Illumina HiSeq2500 分析仪。
1.3 测序方法
1.3.1 SUNDS 组基因芯片测序 使用DNA 提取试剂盒(中国美基生物公司)从SUNDS 组患者血样中提取基因组DNA,用文库样本定量检测仪Qubit®2.0 荧光仪定量,并进行全基因组文库制备,进而将含有NUP155基因的探针与SUNDS 全基因组文库混合杂交,使用Illumina HiSeq2500 分析仪对捕获的DNA 文库进行基因芯片测序。对目的区域测序进行过滤等处理,去除结果中的接头和低质量(杂合读取率<20%)和低覆盖度(深度<30)的数据,运用SOAPnuke 软件(http://soap.genomics.org.cn/)与参考基因进行序列比对和标准化分析[13-15]。使用SeqManTMⅡ序列分析软件(DNASTAR 股份有限公司)将测序数据与相应的NUP155基因参考cDNA 序列(NM_153485.3)进行比对。
1.3.2 临床组Sanger 测序 通过磁性DNA 半定量提取试剂盒从30 例临床组的血样中提取其外周血DNA,4 ℃保存备用。查阅Ensembl 基因组数据库,获取人类NUP155的基因序列,设计并合成NUP155基因各外显子引物,引物序列见表1,通过聚合酶链反应(polymerase chain reaction,PCR)扩增其编码区的外显子和外显子-内含子交界区的DNA 片段。
PCR 反应体系总体积30 μL,含GoTaq®DNA聚合酶反应混合液(1×)15 μL,引物混合体系(10 μmol/L)2 μL,模板DNA 2 μL,ddH2O 11 μL。PCR 反应条件:95 ℃2 min;95 ℃30 s,58~61 ℃,40 s,72 ℃50 s,32个循环;72 ℃10 min,4 ℃保存。
北京六合华大基因有限公司完成PCR 扩增产物的纯化和测序。利用GeneTool Lite Version 1.0基因序列分析软件将测序结果与Ensembl 基因组数据库中的NUP155cDNA 序列(NM_153485.3)进行比对。对于发现有突变的样本,重新提取DNA再次扩增和测序以验证结果的准确性。
1.4 统计分析和突变结果预测
使用SPSS 23.0 软件进行统计分析。对样本和人群对照组的等位基因频率进行Pearson 卡方检验或Fisher′s 精确检验(双侧检验,α=0.05)。根据千人基因组计划数据库(1000 Genomes)或Ex-AC 数据库中最小等位基因频率(minor allele frequency,MAF)区分基因突变和序列多态性。若MAF ≥0.01即认定为SNP位点,MAF<0.01则认为是点突变。使用SIFT、PROVEAN(http://provean.jcvi.org/index.php)以 及Polyphen2(http://genetics.bwh.harvard.edu/pph2/index.shtml)预测软件对基因突变结果进行预测。根据《ACMG 遗传变异分类标准与指南》(2007 和2015 年中文版),将所有突变根据其临床意义预测结果分为致病性、可能致病性、不确定、可能良性和良性5 类[16-17]。
2 结果
2.1 SUNDS 组基因突变
在40 例SUNDS 组的NUP155基因片段中,共发现2 个突变位点位于编码区(表2)。其一为NUP155c.4051A >G,p.N1351D 杂合突变,位于第35 号外显子的第1351 位氨基酸由天冬酰胺变为天冬氨酸,经SIFT、Polyphen2 和PROVEAN 软件预测为良性突变,ACMG 预测该突变为可能良性。该研究样本中MAF=0.012 5(1/80),ExAC 数据库中东亚人群中MAF=0.000 05(P<0.05),样本与人群对照组中的等位基因构成比之间差异具有统计学意义,说明SUNDS 与NUP155c.4051A >G,p.N1351D 具有相关性。
另一突变为NUP155c.2995-3012delCCTGGTCCTCCAGTGTTG,p.P999-L1004del 杂合突变,位于第26 号外显子的第999 位~1 004 位氨基酸缺失,这是一个新发现的突变,在1000 Genomes 和ExAC 数据库中未见记录,PROVEAN 软件预测其为有害突变,ACMG 预测该突变具有致病性。
2.2 临床组基因突变
在30 例心律失常临床组的NUP155基因片段中,共发现2 个错义突变(c.485G >T,p.162R >L、c.485G >A,p.162R >Q),1个同义突变(c.516C >T)以及1 个内含子突变(5:37355646 A >G;表2,图1)。
错义突变均位于5 号外显子区域第485 位碱基。其中一例患者为NUP155c.485G>A,p.R162Q杂合突变携带者。NUP155c.485G>A,p.162R>Q由谷氨酰胺取代第162 位的精氨酸,SIFT、Polyphen2 和PROVEAN 软件预测为良性突变,ACMG预测该突变意义不明确。该患者临床表现为非典型房室结折返性心动过速(atrioventricular node reentrant tachycardia,AVNRT),心脏彩超显示心脏结构正常。在临床组中该突变MAF=0.017(1/60),ExAC 数据库中东亚人群中MAF=0.000 05(P<0.05),样本与人群对照组中的等位基因构成比之间差异具有统计学意义,说明心律失常与NUP155c.485G>A,p.R162Q 突变具有相关性。
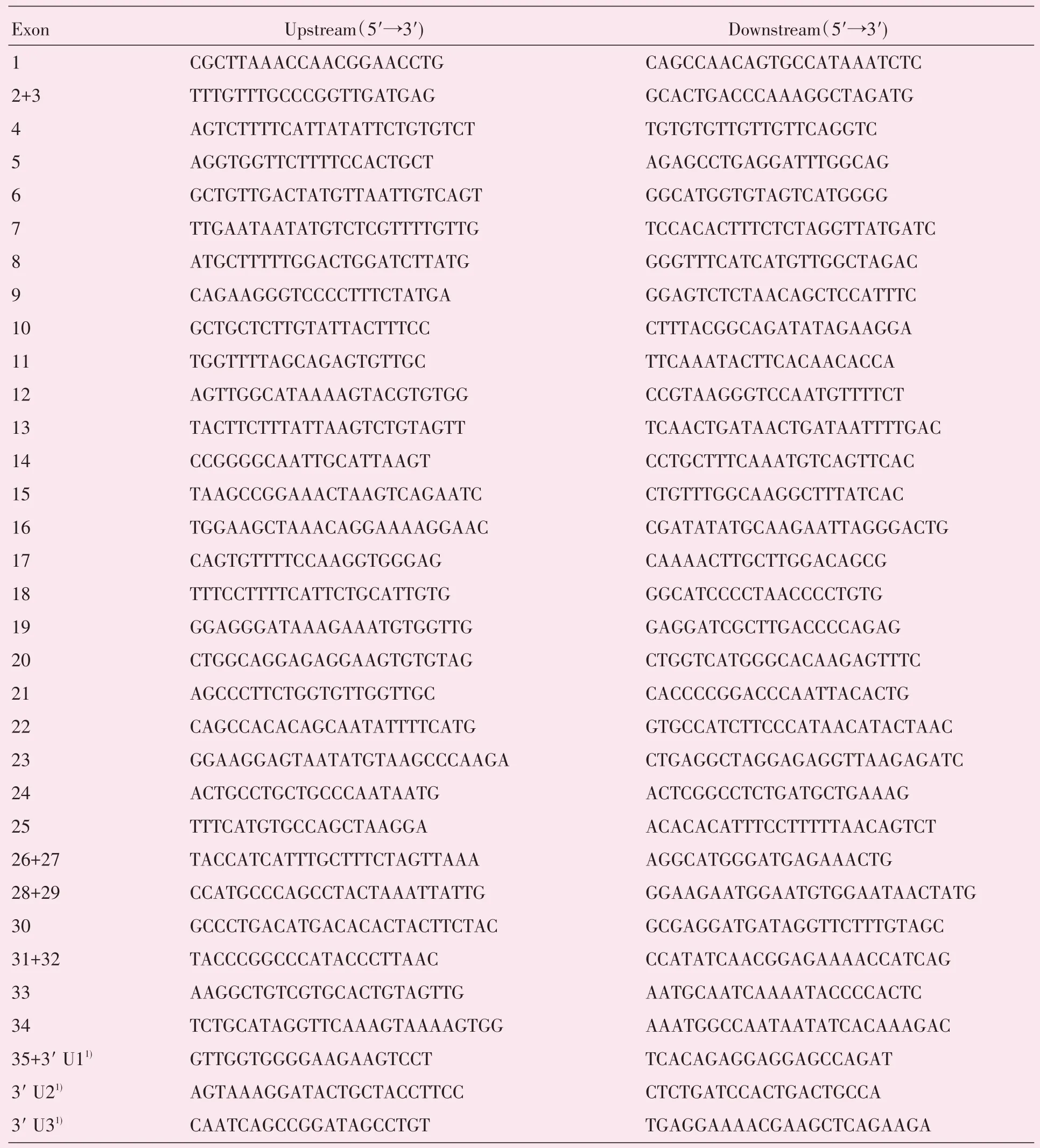
表1 NUP155 基因PCR 引物及结合位置Table 1 PCR primers sequences and binding sites of NUP155
另外发现2 例患者为NUP155c.485G >T,p.162R >L 杂合突变携带者。NUP155c.485G >T p.162R >L第162位氨基酸由精氨酸突变为亮氨酸。Polyphen2和PROVEAN软件预测NUP155c.485G >T 为有害突变,而SIFT 软件预测为良性突变,根据ACMG 指南推测该突变为意义不明确性变异。其中一例患者临床表现为高血压性心脏病伴频发性室性早搏(premature ventricular complexes,PVC)(左右冠窦前壁之间),心脏彩超显示左房增大,左室肥厚。另一例患者临床表现为频发性PVC(右室流出道前间隔部),心脏结构正常。本研究首次发现该位点的等位基因T,在临床组样本中MAF=0.033 3(2/60),在1000 Genomes 和ExAC 数据库中未见等位基因T的记录(P<0.05),样本与人群对照组中的等位基因构成比之间差异有统计学意义,说明心律失常与NUP155c.485G >T,p.162R >L突变有相关性。
NUP155c.516C >T 是一个新发现的同义突变,该位点编码的天冬氨酸不发生改变。另外1个突变是位于内含子Intron 4-5 区域的5:37355646 A >G(P<0.05)。

表2 SUNDS 组和临床组NUP155 基因突变位点Table 2 Variants of NUP155 in SUNDS and clinical cases
2.3 临床组NUP155 多态性
在临床组中共发现6 个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,均位于内含子区域(表3)。临床组SNP 位点的等位基因频率构成比与ExAC 数据库中的东亚人群、1000 Genomes 数据库中的东亚人群、北京汉族和中国南方汉族人群的等位基因频率构成比之间无统计学差异(P<0.05)。
3 讨论
3.1 突变位点与心律失常和SUNDS 的关系
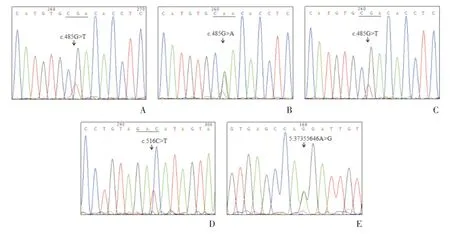
图1 临床组正向测序NUP155 突变峰图Fig.1 Forward sequencing chromatograms of NUP155 variants in clinical group
原发性心律失常可导致猝死。这种猝死案例常无明显的致死因素,给法医的工作带来极大挑战。随着基因测序技术和基因诊断学的发展,原发性心律失常的致病基因逐渐被发现,其中大部分致病基因与离子通道有关[18-19]。核孔蛋白NUP155被证实是房颤的致病基因,且易导致猝死,该发现进一步拓宽了原发性心律失常的遗传学研究范围[12,20]。本研究收集了SUNDS 案例和心律失常临床病例,在对NUP155的外显子和外显子-内含子交界处进行测序后共发现4个非同义突变。
NUP155c.4051A>G,p.N1351D 为罕见突变,在ExAC 数据库东亚人群中的G 等位基因频率=0.00005。SUNDS 组中的该突变携带者属于一猝死家系,两兄弟心电图均存在正常变异Q 波,但死者哥哥不携带该突变。心律失常及SUNDS 的致病基因谱较广泛,除NUP155外,还有SCN5A、RYR2、KCNE1等30 多种致病基因[21-22]。综合以上信息并参考软件预测结果,我们基本可以断定NUP155不是该案例的致病基因,该死者可能携带其他导致心律失常和猝死的突变基因。
NUP155c.2995-3012delCCTGGTCCTCCAGTGTTG,p.P999-L1004del 是本研究新发现的突变。该突变造成第999~1004 位氨基酸缺失。Rayala等[24]通过酵母双杂交实验发现,Gle1 蛋白的N-端第2~29 位氨基酸与NUP155C-端第987~1 159 位氨基酸相结合,并参与了Gle1 介导的mRNA 转运出核膜的一个关键步骤。据此猜测,NUP155c.2995-3012delCCTGGTCCTCCAGTGTTG,p.P999-L1004del 使NUP155 蛋白上的Gle1 结合位点发生变化,导致NUP155 与Gle1 结合异常,影响mRNA的转运。但关于该突变引发猝死的机制仍有待进一步研究。
在本次研究中,共发现3 个病例的NUP155第485 位碱基发生突变,其中一例为NUP155c.485G>A,p.162R >Q,另两例为NUP155c.485G >T,p.162R >L。携带NUP155c.485G >A,p.162R >Q突变的患者心脏结构正常,心电图表现为快-慢型房室结折返性心动过速(atrioventricular nodal reentrant tachycardia,AVNRT)。快-慢型AVNRT的特点为快径前传、慢径逆传,约占AVNRT 的5~10%,常见于儿童,多为病理性或由药物所致,心房最早激动处常在冠状静脉窦口,是房室结左侧后延伸与右侧后延伸之间形成折返导致的心律失常[22-23]。有研究通过二代测序对AVNRT 患者进行基因筛查,发现26.4%患者携带与Na+转运相关的突变基因,19.0%患者携带与心肌Ca2+转运有关的突变基因[24],这提示我们AVNRT 是一种钠和钙转运异常的心律失常,NUP155基因突变通过影响离子通道功能导致AVNRT。
NUP155c.485G >T,p.162R >L 是本研究新发现的突变。携带c.485G >T,p.162R >L 突变的两位患者的心律失常类型均为频发性PVC。目前一般认为频发性PVC 不会直接导致猝死,但PVC可发展为室性心动过速和心室颤动,从而引发猝死,长期频发性PVC 也会导致心脏结构改变,对心脏生理功能造成进一步影响[25-26]。关于PVC 的遗传学研究较少,频发性PVC 与基因突变的相关性尚不明确,就本次研究来看,NUP155第485 位碱基突变与心律失常的关系值得深入探讨。
3.2 NUP155 功能与致心律失常机制
NUP155 N-端存在一段β-折叠,C-端存在α-螺旋,N-端的β-折叠可与多种蛋白相互作用,对于核孔的形成和NPC 的锚定至关重要,从而保证细胞的正常生理活动[27-28]。NUP155 的C-端区域(第589~1388 位氨基酸残基)具有自抑制作用,分裂间期,NUP155 的C-端与其N-端区域(第1~589位氨基酸残基)结合,降低NUP155-NUP53 的交互强度,阻止NPC 装配;而在有丝分裂的NPC 装配过程中,NUP155 C-端通过与NUP93 和NUP53 结合触发构象变化,使NPC 组装得以正常进行[6]。
NUP155基因突变导致心律失常和猝死机制的研究还在不断深入。有研究表明,NUP155R391H 突 变影 响NUP155 与NUP53 和POM121 的结合,从而改变NUP155 在NPC 的定位,并改变NPC 的通透性,影响NPC介导大分子出入细胞核的功能[12,29]。但有研究发现非洲爪蟾蜍相应位点的NUP155R385H 突变仍可定位于NPC 上,不影响NPC 装配[6]。我们据此推测,人类的NUP155突变不影响核孔复合体组装,而是NUP155的某种功能异常导致NPC 功能的轻度偏差,如核转运功能紊乱。NUP155R39lH突变导致热休克蛋白HSP70 mRNA 出核与蛋白入核异常[12],而HSP70 曾被多次报道与房颤发生有关[30-31],由此看来,NUP155突变的NPC 可能因丧失正常的介导HSP70 出入核功能导致某个离子通道表达或功能异常,进而引发心肌细胞动作电位异常导致心律失常及SUNDS。此外,免疫共沉淀和GST 蛋白沉降实验表明核纤层蛋白A/C(lamin A/C)p.Arg399Cys 突变削弱了lamin A/C 和NUP155的相互作用导致房颤的发生发展[32]。由此猜测NUP155 蛋白上lamin A/C 的结合位点的氨基酸残基发生突变也会影响两者的正常结合,对核膜及核孔的结构和生理学功能造成损害。
除上述对NUP155 蛋白特定位点功能进行研究外,研究人员还利用基因敲除研究基因整体的生物学功能。Preston 等[33]对小鼠NUP155+/-胚胎干细胞的转录组进行分析,发现NUP155突变导致大范围的转录组重构,细胞功能重排,最终引起基因调控网络重组,并提出NUP155突变通过影响TRKA和SRSF2基因转录导致房颤。随后Preston 等[34]发现NUP155+/-胚胎干细胞转录组中多种非编码RNA 水平发生变化,其中miR291a、miR291b、miR293 和miR294 的含量显著降低。这些miRNA 是miR290-295 族成员,由典型的干细胞相关因子SOX2、OCT4 和NANOG 调控,这3 种因子均呈下降趋势。这些数据表明,NUP155基因损伤导致miR-SOX2/OCT4/NANOG 调控回路被破坏,提示与NUP155突变相关的转录组重构可能是发生心律失常和猝死的重要因素。
3.3 结论
本研究对中国汉族人群的SUNDS 和心律失常病例进行了NUP155基因筛查,共发现4 个非同义突变(NUP155c.4051A >G,p.N1351D,NUP155c.2995-3012delCCTGGTCCTCCAGTGTTG,p.P999-L1004del,NUP155c.485G >T,p.162R >L和NUP155c.485G >A,p.162R >Q),1 个同义突变(NUP155c.516C >T),1 个内含子突变(5:37355646 A >G)。4 个非同义突变与心律失常或SUNDS 具有相关性。从分子遗传学角度看,这些突变有可能是导致SUNDS 和心律失常的遗传学因素。但NUP155的这4 个突变是否致病及其致病机制尚不明确,下一步应对NUP155蛋白结构域进行深入研究,了解突变位点对NUP155功能的影响,对其病理生理学机制进一步分析、确证,以期为中国汉族人群发生心律失常和SUNDS 进行基因诊断和鉴定提供参考。
