固相萃取/气相色谱-质谱法对土壤中有机氯农药的分析及基质效应研究
2020-06-01刘玲玲孟甜甜董希良张利钧
刘玲玲,孟甜甜,董希良,任 伟,张利钧
(济南市环境研究院,山东 济南 250100)
有机氯农药(Organochlorine pesticides,OCPs)是公认的环境中毒性最大的一类持久性有机污染物和疏水性有机污染物,被全面禁用后,其在环境介质中的浓度显著下降,但低水溶解性和强疏水性的特点使之易吸附在悬浮颗粒物上,并最终累积在沉积物和土壤中[1]。土壤作为OCPs的主要汇和储蓄库[2],不仅具有较强的滞留能力,而且还可作为其他介质的污染源将其重新排放到大气、地下水和生物体等环境中[3],并通过生物积累和放大效应对生态系统和人体健康造成广泛而持久的影响[4]。如已禁用的滴滴涕、六六六等有机氯农药因结构稳定,能够长期残留在土壤中,目前仍被频繁检出[5]。因此,建立一种快速、准确检测土壤中有机氯农药的方法尤为重要。
土壤中农药残留检测主要包括样品前处理和仪器分析两个部分,其中前处理包括提取和净化两种方式,提取方式主要为索氏提取(Soxhlet extraction)[4]、超声提取(Ultrasound extraction)[6]、微波提取(Microwave extraction)[7]、快速溶剂萃取(Accelerated solvent extraction,ASE)[8]及QuEChERS方法[5]等,ASE因具有提取速度快、溶剂消耗量少、自动化程度高等优势,受到越来越多研究工作者的青睐[8-9],国内外很多标准方法也优先推荐该方式[10-11]。净化方式主要有固相萃取(Solid phase extraction,SPE)净化[9]、凝胶色谱净化(Gel permeation chromatography,GPC)[12]方式。其中GPC可同时对多种物质净化,但溶剂消耗量大、耗时较长,不适合批量分析。而SPE净化溶剂消耗量小、可自动化批量处理、操作简单。有机氯农药检测技术主要有气相色谱法(GC)[7]、气相色谱-质谱法(GC-MS)[13]、气相色谱-串联质谱法(GC-MS/MS)[8]、液相色谱-串联质谱法(HPLC-MS/MS)[5]等,GC-MS由于分析速度快、定性能力强,近年来得到广泛应用[13-14]。
基质效应是农残检测中普遍存在的现象,这主要取决于农药的种类、样品类型、检测仪器原理等多个方面。农药的极性及热稳定性是影响基质效应的重要因素,同一农药在不同样品中的基质效应也有差异[15],GC-MS检测时的基质效应主要是农药与硅醇基及其与玻璃衬管表面金属离子间的相互作用所致[16]。对于不同的农药及样品类型,常用的补偿基质效应方法有基质净化法[17-18]、同位素标记法[19-20]、基质匹配校准法[21-22]、加入分析保护剂法[23-24],而GC-MS检测中常采用优化进样技术的方式进行基质补偿[13],实际研究工作中常将多种补偿方法相结合。基质匹配校准法因并未减弱基质效应,且无法获得适用于所有基质的统一空白基质,故存在一定缺陷。基质净化法则从根本上消除可能产生基质效应的共提物,净化效果越好,待测溶液与标准溶液类型越相近,检测结果受基质效应影响的程度就越小,在各种净化方式中,SPE小柱净化效果更为理想[15]。优化进样技术无需复杂的操作即可达到降低基质效应的目的。目前农残基质效应的研究主要集中在农产品中[13,18-21,23-24],而对土壤中有机氯农药基质效应的研究报道较少。本研究通过分析不同SPE净化溶剂和不同进样方式对基质效应的补偿作用,筛选出最优预处理方法,旨在为我国土壤环境中OCPs的快速、准确检测提供参考依据。
1 实验部分
1.1 仪器与试剂
7890B/5977B GC-MS仪(美国安捷伦公司);ASE350快速溶剂萃取仪(美国赛默飞公司);M10平行蒸发浓缩仪(北京莱伯泰科仪器股份有限公司);HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm,美国安捷伦公司);Alpha 1-4LDplus冷冻干燥仪(德国Christ公司);RM200土壤臼式研磨仪、AS200土壤筛分仪(德国莱驰公司);Milli-Q超纯水机(德国默克公司)。
正己烷、丙酮、二氯甲烷(色谱纯,美国Tedia公司);弗罗里硅土小柱(500 mg/6 mL,美国安捷伦公司);无水硫酸钠及石英砂颗粒(分析纯,国药集团化学试剂有限公司);硅藻土颗粒(30~40目,美国赛默飞公司)。
α-六六六、β-六六六、γ-六六六、δ-六六六、p,p′-DDT、p,p′-DDE、o,p′-DDT、p,p′-DDD、六氯苯、α-氯丹、γ-氯丹、艾氏剂、狄氏剂、异狄氏剂、α-硫丹、β-硫丹、灭蚁灵、七氯、环氧化七氯、异狄氏剂醛、硫丹硫酸酯、异狄氏剂酮、甲氧滴滴涕23种有机氯农药混标(质量浓度均为1 000 μg·mL-1,美国AccuStandard公司);标准替代物:四氯间二甲苯、氯茵酸二丁酯和十氯联苯的混标(2 000 μg·mL-1)及内标(五氯硝基苯,1 000 μg·mL-1)均购于美国o2si公司。
1.2 样品前处理
1.2.1 样品采集与制备采集表层土壤(0~20 cm)至洁净的棕色玻璃瓶中,将采样瓶装满、装实,密封,于4 ℃下避光冷藏保存,保存时间不超过10 d。取适量样品混匀,经-55 ℃冷冻干燥后,用土壤臼式研磨仪研磨,过250 μm金属网筛混匀后,置于棕色瓶中备用。
1.2.2 样品提取与净化提取:在萃取腔(34 mL)底部放置专用的玻璃纤维滤膜,滤膜上铺一层硅藻土颗粒。准确称取20.00 g样品,均匀混入硅藻土颗粒,同时加入15 μL 200 μg·mL-1替代物的混标中间液,用硅藻土填满萃取池,于加速溶剂萃取仪中萃取,萃取溶剂为正己烷∶丙酮(体积比1∶1);载气(高纯氮气)压力:1.0 MPa;萃取温度:100 ℃;萃取池压力:10 MPa;预加热平衡时间:3 min;静态萃取时间:5 min;放气时间:2 min;循环次数:2次;总萃取时间:22 min。萃取液收集于250 mL接收瓶中,待净化。
净化:向弗罗里硅土小柱中加入无水硫酸钠及经硝酸处理过的铜粉,分别用5 mL二氯甲烷、10 mL正己烷预淋洗弗罗里硅土小柱,然后将1 mL提取液移入柱内,用10 mL二氯甲烷∶正己烷(体积比1∶9)+10 mL丙酮∶正己烷(体积比1∶9)进行洗脱,待洗脱液全部流出至浓缩杯中后,将其浓缩至约1 mL,再加入3 mL正己烷清洗浓缩杯内壁,再浓缩至1 mL以下,将溶剂完全转换为正己烷。加入8 μL内标物并准确定容至1.0 mL,待测。
1.3 GC-MS条件
1.3.1 色谱条件色谱柱:HP-5ms(30 m×0.25 mm×0.25 μm);进样口温度:250 ℃,脉冲不分流进样,脉冲压力275.8 kPa;进样量:2.0 μL,柱流量:1.0 mL/min(恒流);程序升温:初始温度120 ℃,保持1 min;以12 ℃/min升至180 ℃,保持5 min,再以7 ℃/min升至240 ℃,保持1 min,再以1 ℃/min升至250 ℃,保持2 min,最后以15 ℃/min升至300 ℃,保持2 min。
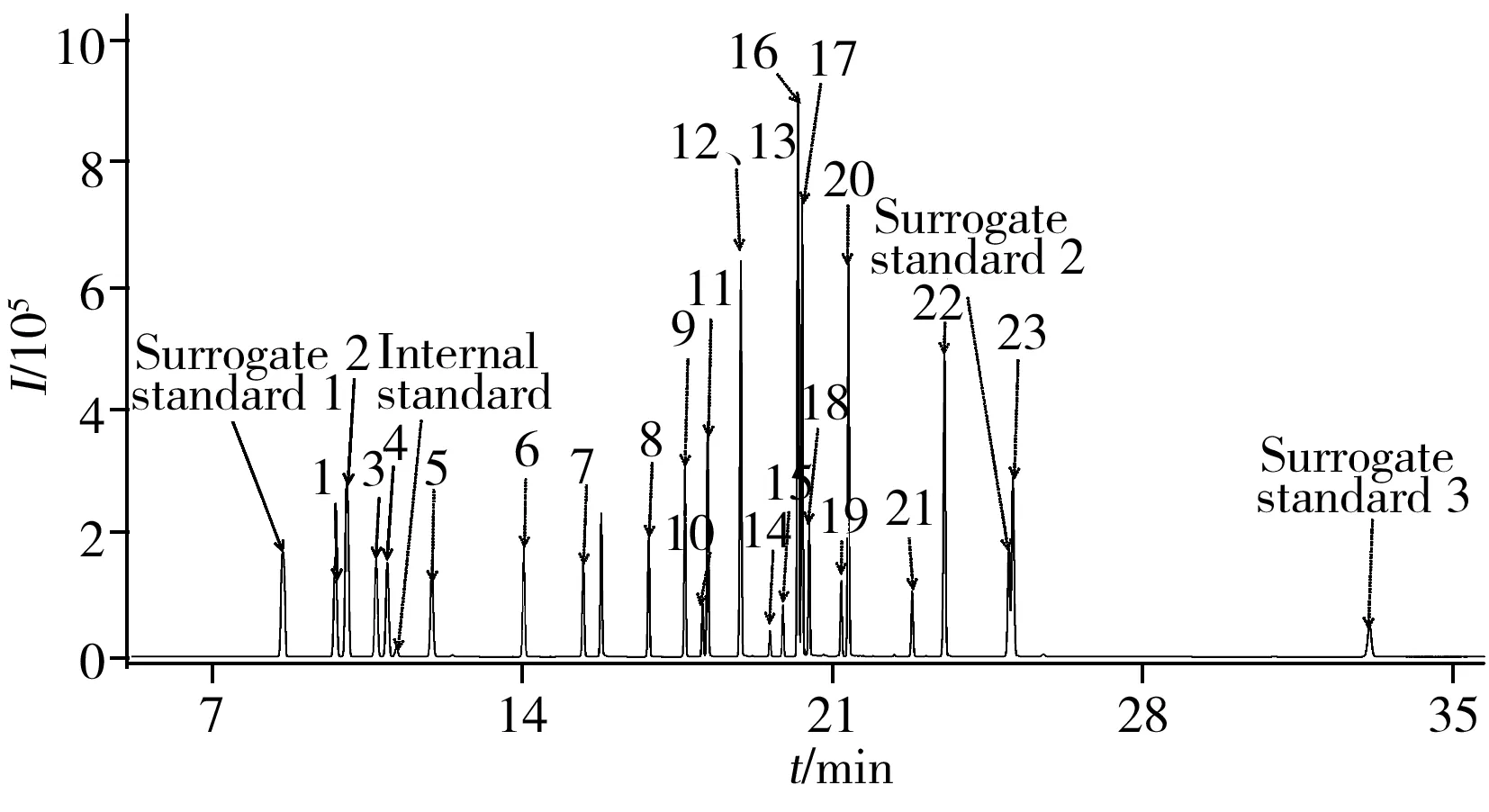
图1 23种有机氯、3种替代物及1种内标标准品的总离子流图Fig.1 TIC of 23 organochlorine pesticides,3 surrogate standards and internal standard the number 1-23 were the same as those in Table 1
1.3.2 质谱条件离子源:电子轰击(EI)离子源;离子源温度:230 ℃;扫描方式:选择离子扫描模式;电离能量:70 eV;传输线温度:280 ℃;溶剂延迟时间:5 min;目标物质谱参数见表1。
2 结果与讨论
2.1 色谱-质谱条件的优化
本实验采用HP-5ms毛细管色谱柱对目标物进行分离,通过全扫描(Scan)和选择离子监测(SIM)模式进行测定,选择丰度高、干扰低的特征离子为定量离子,丰度较高、干扰较低的2个特征离子为定性离子。23种有机氯的SIM离子及保留时间见表1,总离子流色谱图如图1所示。
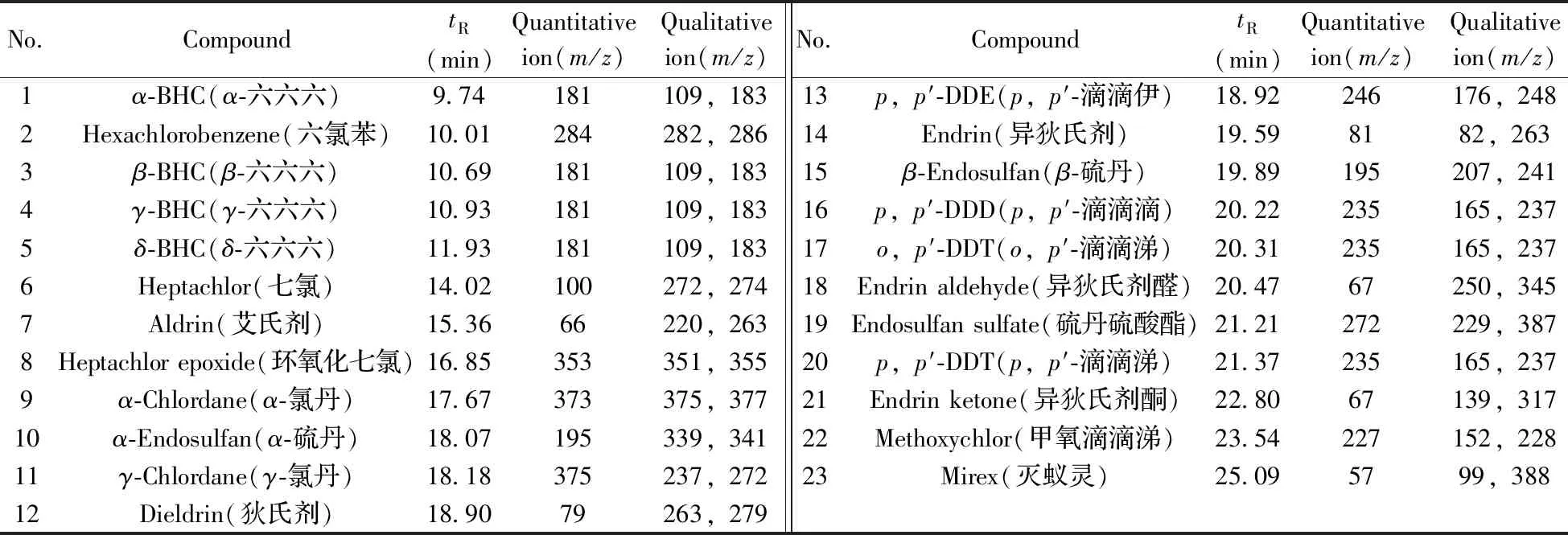
表1 23种有机氯农药保留时间与SIM 离子Table 1 Retention times and selected-ion monitoring ions of 23 organochlorine pesticides
2.2 前处理条件的优化
回收率主要取决于ASE提取溶剂及净化时洗脱溶剂的选择。因此,采用分步加标的方式考察了加速溶剂萃取及净化步骤的回收率。
2.2.1 ASE提取溶剂的确定本研究参考环境标准方法《土壤和沉积物 有机氯农药的测定 气相色谱-质谱法》(HJ835-2017)[25],采用正己烷∶丙酮(体积比1∶1)对添加4 μg·mL-1有机氯混标的硅藻土进行提取,计算其回收率。结果显示,23种有机氯农药的回收率为59.7%~114%,可满足分析要求。因此,实验选择正己烷∶丙酮(体积比1∶1)为ASE的提取溶剂。与宋晓娟[8]、陶鑫[26]、黄志[27]等的研究结果一致。
2.2.2 SPE洗脱溶剂的选择实验考察了20 mL二氯甲烷∶正己烷(体积比1∶9)、20 mL丙酮∶正己烷(体积比1∶9)、10 mL二氯甲烷∶正己烷(体积比1∶9)+10 mL丙酮∶正己烷(体积比1∶9)为洗脱剂时对回收率的影响。结果显示,20 mL二氯甲烷∶正己烷(体积比1∶9)对19种(占总检测有机氯农药的82.6%)有机氯农药的回收率较高(>80%),在该洗脱剂条件下,Kruskal-Wallis(K-W)非参数检验结果表明,17种有机氯农药的回收率显著高于其它两种洗脱剂的回收率(p<0.05),4种农药的回收率则显著低于其它2种洗脱剂,介于40.9%~63.2%之间,六氯苯和甲氧滴滴涕回收率差异则不显著。10 mL二氯甲烷∶正己烷(体积比1∶9)+10 mL丙酮∶正己烷(体积比1∶9)为洗脱剂的回收率介于其它两种洗脱剂之间,回收率为76.7%~121%。20 mL丙酮∶正己烷(体积比1∶9)洗脱时的回收率为62.1%~90.9%,显著低于前两种(p<0.05)。为保证大部分有机氯农药有较好的回收率,选择10 mL二氯甲烷∶正己烷(体积比1∶9)+10 mL丙酮∶正己烷(体积比1∶9)为净化的洗脱剂。
2.3 基质效应
基质效应(ME)的计算公式采用公式[28]:ME=(Am/As-1)×100%,式中Am为基质中农药标准溶液的峰面积,As为纯溶剂中农药标准溶液的峰面积。|ME|<20%为弱基质效应,无需采取补偿措施;20%≤|ME|≤50%为中等程度基质效应,|ME|>50%为强基质效应,须采取措施补偿基质效应[29]。本研究比较了同为4 μg·mL-1的溶剂标准溶液与土壤基质匹配标准溶液的响应值,研究发现,p,p′-DDD、o,p′-DDT、异狄氏剂醛、异狄氏剂酮呈现中等程度的基质效应,p,p′-DDT、异狄氏剂、甲氧滴滴涕则存在强基质效应,需采取补偿措施,因此分析了基质净化法和不同进样方式对基质效应的补偿作用。
2.3.1 不同洗脱溶剂对基质效应的补偿作用洗脱溶剂是净化条件中最主要的影响因素,不同洗脱溶剂对基质效应的补偿作用也不同。本研究分析了20 mL二氯甲烷∶正己烷(体积比1∶9)、20 mL丙酮∶正己烷(体积比1∶9)、10 mL二氯甲烷∶正己烷(体积比1∶9)+10 mL丙酮∶正己烷(体积比1∶9) 3种洗脱溶剂对基质效应的影响。结果表明,采用净化措施后,大部分有机氯农药的ME均有所降低,且以10 mL二氯甲烷∶正己烷(体积比1∶9)+10 mL丙酮∶正己烷(体积比1∶9)为洗脱剂时对中、强基质效应农药的基质补偿效果最好,18种有机氯农药(占比78.3%)的基质效应在20%以内。其中,p,p′-DDD、异狄氏剂酮由中等程度基质效应降为弱基质效应,p,p′-DDT、甲氧滴滴涕由强基质效应降为中等程度基质效应。
2.3.2 进样方式对基质效应的影响在气相色谱-质谱检测过程中,不同的进样模式对基质效应的影响有着巨大的差别[15]。非脉冲和脉冲不分流进样是GC-MS中最常用的进样技术,在脉冲不分流进样方式中,脉冲压力是最重要的参数[13]。按照仪器条件对净化后的土壤基质标准溶液进行测定,考察了非脉冲不分流进样和脉冲不分流进样对基质效应的影响。结果表明,脉冲进样的ME整体上较非脉冲进样低,所有农药的|ME|均在50%以内,不存在强基质效应。贺利民等[30]的研究也指出,脉冲不分流进样技术能够大大减少基质效应。
在脉冲进样方式中,脉冲压力为103.4、172.4、275.8 kPa时的|ME|值在20%以内的农药数量分别为18、19、23,由此可见,随着柱头压力的增大,其对应的基质效应整体呈减弱趋势,特别是对异狄氏剂和灭蚁灵的基质减弱作用较为明显。这是因为随着进样过程中流速的增加和进样口压力的增大,样品在进样口的停留时间减少[30],减少了目标物与衬管中活性位点的作用时间,从而降低了基质效应。
2.4 方法学考察
2.4.1 标准曲线及检出限在优化净化条件和进样方式下,23种有机氯农药均表现为弱基质效应,可采用溶剂配标法进行定量,用正己烷将23种有机氯农药及替代物混标分别稀释成0.4、1、2、3、4、6、8、10 μg·mL-1,均加入8 μL内标物(1 000 μg·mL-1),最终质量浓度为8 μg·mL-1。通过保留时间和NIST谱库检索对目标物进行定性分析,采用内标法定量。23种有机氯在0.4~10 μg·mL-1质量浓度范围内线性良好,相关系数(r2)不低于0.999 2,校准曲线中目标物相对响应因子(RRF)的RSDRRF为0.34%~9.8%。按照《环境监测 分析方法标准制修订技术导则》(HJ 168-2010)[31]中规定,方法检出限(LOD)=3.143δ(δ为7个空白加标平行测定的标准偏差),方法定量下限(LOQ)为4倍的LOD。本研究中23种有机氯农药的LOD为1.0~8.6 μg·kg-1,LOQ为4.0~34.4 μg·kg-1(表2)。
2.4.2 回收率及精密度在空白土壤中分别添加20、60、100 μg/kg的23种农药的混合标准溶液进行空白基质加标回收实验,每个浓度平行6个,在优化条件下测定,计算各待测物的回收率及相对标准偏差(RSD)。结果显示,23种农药在3个加标水平下的平均回收率为46.3%~127%,RSD为0.68%~15%(表2),回收率满足40%~150%的要求[25],具有良好的准确度及精密度。
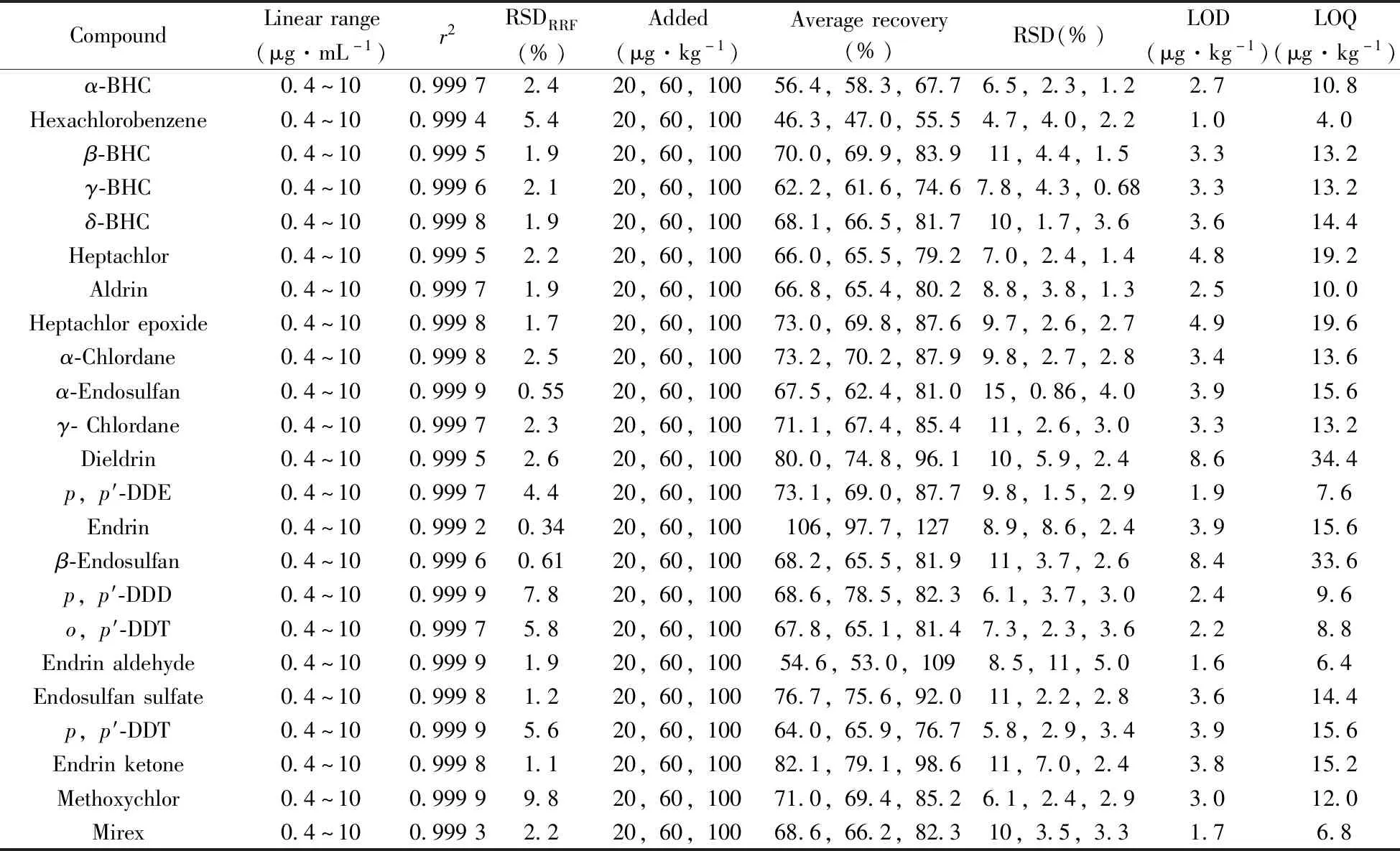
表2 23 种有机氯农药的线性相关系数(r2)、RRF的相对标准偏差(RSDRRF)、平均回收率、相对标准偏差、检出限及定量下限Table 2 Linear coefficients(r2),relative standard deviations of RRF(RSDRRF),average recoveries,RSDs,limits of detection(LODs) and limits of quantification(LOQs) of 23 organochlorine pesticides
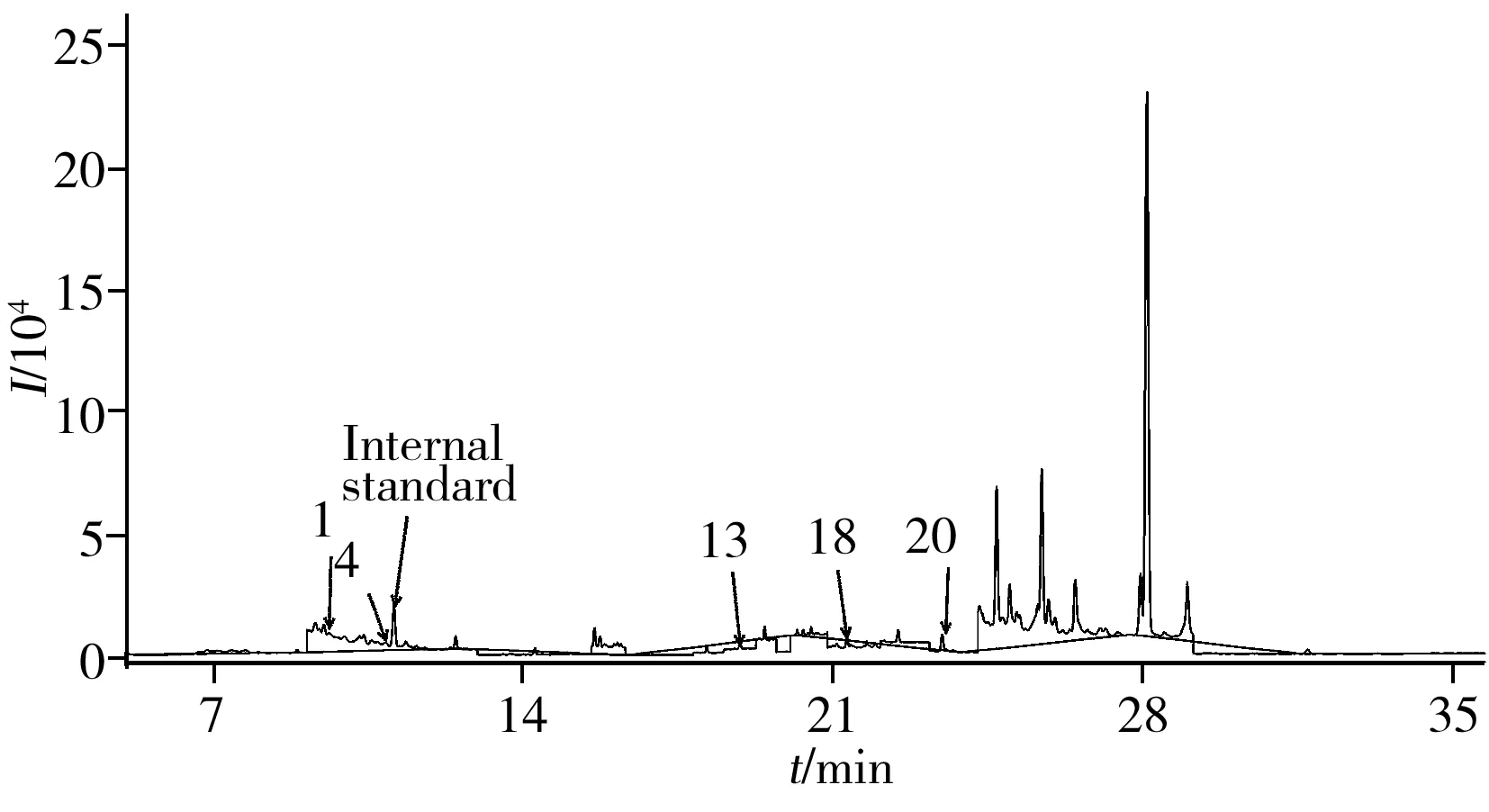
图2 实际土样的色谱图Fig.2 Chromatogram of soil sample the number 1-23 were the same as those in Table 1
2.5 实际样品检测
在优化条件下,采用本法对采集自济南市某基地(36°41′10″N,117°4′45″E)的土壤样品进行检测,结果检出5种农药(图2),分别为α-六六六、γ-六六六、p,p′-DDE、异狄氏剂醛、p,p′-DDT,含量为3.91~11.3 μg·kg-1。
3 结 论
本文建立了一种固相萃取/GC-MS同时测定土壤中23种有机氯农药的分析方法,并考察了净化方式及进样条件对基质效应的影响,该方法操作简单、高效,可用于复杂土壤样品的分析。
