直接稀释/超高效液相色谱-串联质谱法测定河豚鱼与织纹螺中2种河豚毒素
2020-06-01王兴龙桂文锋任一平
王兴龙,蔡 强,诸 寅,保 聪,桂文锋,任一平*
(1.浙江清华长三角研究院 分析测试中心,浙江 嘉兴 314000;2.瓦赫宁根大学 海洋动物生态组,海尔德兰 瓦赫宁根 6708 WD,荷兰;3.上海师范大学 环境与地理科学学院,上海 200233)
河豚毒素(Tetrodotoxins,TTXs)是一类毒性非常强的小分子海洋生物毒素,目前发现天然存在的种类超过40余种,其中TTX毒性较强,大约2 mg即可将50 kg体重的成年人致死[1-2],且一般的烹饪温度很难降低其毒性。TTX同时拥有胍基和邻位酸官能团,通常以内盐形式存在,故其在强酸强碱环境下性质均不稳定。它们作用于细胞膜上的钠离子通道,影响动作电位的传导,产生严重的神经系统、呼吸系统等急性中毒症状,从而导致死亡[3]。与某些微藻来源的海洋毒素不同,TTX通过食物链聚集或与其共生的微生物产生,涉及的微生物包括假单胞菌属、弧菌属、希瓦氏菌属、芽孢杆菌属等[4-5]。近年来,我国浙江[6]、福建[7-8]、广东[9]、四川[10]等地发生多起误食河豚鱼、织纹螺的中毒事件。河豚毒素中毒后无特效治疗药物[11]。我国暂未设定水产品中TTX的限量,而日本、韩国设定河豚鱼可食部分中TTX的限量为 2 mg/kg[4]。欧盟禁止河豚鱼流入市场,规定贝类组织中TTX的含量低于44 μg/kg[12]。伴随河豚市场的开放以及水产品中TTX风险评估的不断深入,我国水产品中TTX的限量标准将会不断完善,检测目标逐渐实现由单一向多种类同时检测转变,复杂耗时的前处理技术向简单、高效方向转变。
河豚毒素的检测方法主要有小鼠生物法[2,13]、酶联免疫吸附法[14]、免疫层析法[15-17]、液相色谱-荧光检测法[18-19]、气相色谱-串联质谱法[13]、液相色谱-串联质谱法[18,20]等。小鼠生物法操作相对简单,但易受个体差异的影响,费时费力。酶联免疫吸附法、免疫层析法特异性强,灵敏度高,定性检测方面优势明显,但标记物的稳定性较难控制。液相色谱-荧光检测法与气相色谱-串联质谱法具有分离度好、灵敏度高等优点,但均需衍生,且前处理过程繁琐。而液相色谱-质谱联用法无需衍生化处理,具有选择性好、灵敏度高、可实现多种TTX类似物同时检测的优点,逐渐成为河豚毒素的首选检测方法。目前,水产品中河豚毒素定量检测主要针对1种TTX,样品前处理多采用反向固相萃取柱、超滤离心柱、免疫亲和柱等。由于商业化的标准品仅有河豚毒素(TTX)与4,9-脱水河豚毒素(4,9-anhTTX)(化学结构如图1),且两种毒素可能会存在于同一样品中,为全面掌握河豚毒素的污染状况,需建立这两种河豚毒素同时定量检测的方法。
现有河豚毒素检测的前处理技术复杂、耗时,无法满足批量样品快速、准确的检测需求。针对这一现状,本研究优化了稀释溶剂、稀释倍数、液相色谱及质谱检测等条件,建立了测定河豚鱼与织纹螺中TTX与4,9-anhTTX的超高效液相色谱-串联质谱法。本方法简单、高效、成本低,适用于批量河豚鱼、织纹螺中河豚毒素的检测。
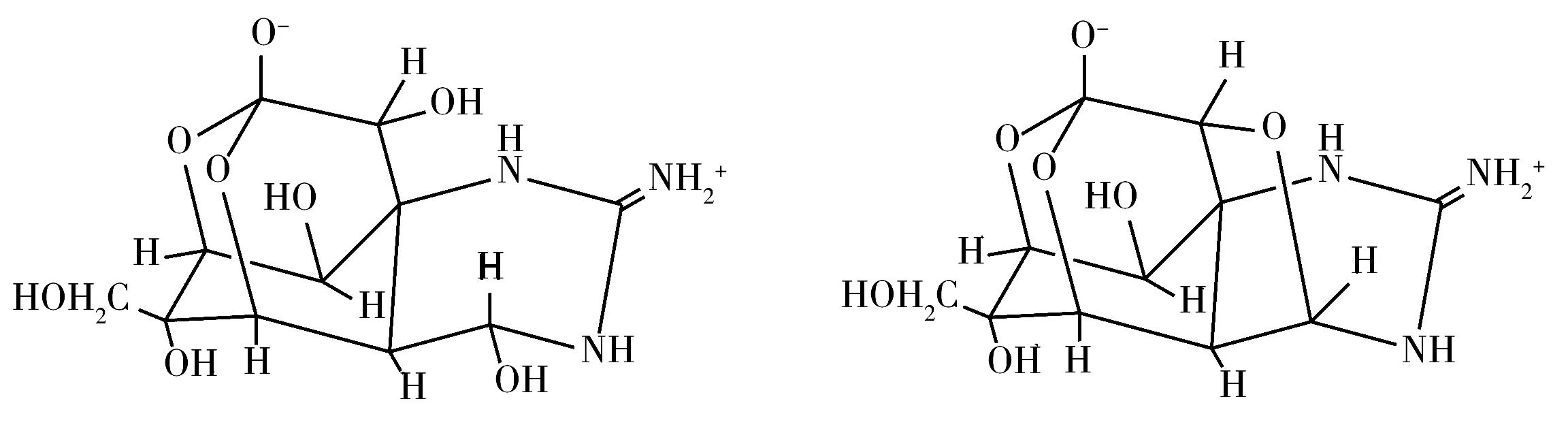
图1 河豚毒素与4,9-脱水河豚毒素的化学结构式Fig.1 Chemical structures of TTX and 4,9-anhTTX
1 实验部分
1.1 仪器、试剂与耗材
Acquity H超高效液相色谱仪、Waters TQD三重四极杆串联质谱仪(美国沃特世公司);Milli-Q超纯水仪(美国Millipore 公司);涡旋振荡器(德国海道夫公司);高速冷冻离心机(德国Sigma公司);免疫亲和净化柱(江苏美正生物科技有限公司)。
TTX和4,9-anhTTX混合标准物质(西班牙Laboratorio CIFGA S.A.);乙腈、甲醇(均为色谱纯,德国Merck公司);甲酸、乙酸、甲酸铵(均为色谱纯,上海安谱实验科技股份有限公司),0.22 μm尼龙针式滤膜(上海安谱实验科技股份有限公司);超纯水(由Milli-Q超纯水仪制备)。
1.2 标准溶液的配制
1.2.1 TTX标准储备液移取适量的TTX标准品溶液,用1 mmol/L乙酸稀释至10 mL,配制成质量浓度为1 000 μg/L的标准储备液,于-20 ℃保存。
1.2.2 4,9-anhTTX标准储备液移取适量的 4,9-anhTTX标准品溶液,用1 mmol/L乙酸稀释至5 mL,配制成质量浓度为200 μg/L的标准储备液,于-20 ℃保存。
1.2.3 标准工作溶液分别准确移取适量的TTX、4,9-anhTTX标准储备液,用1 mmol/L乙酸逐级稀释,配制成0.5、2、10、50、100 μg/L的TTX标准工作溶液与0.5、1、5、20、50 μg/L的4,9-anhTTX标准工作溶液。
1.3 仪器条件
1.3.1 液相色谱条件ACQUITY BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm);柱温为40 ℃;进样体积为10 μL;流速为0.4 mL/min;流动相:A为0.5 mmol/L甲酸铵的0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液。洗脱条件:0~1.0 min,20%A;1.0~5.0 min,20%~50%A;5.0~7.0 min,50%A;7.0~9.5 min,20%A。
1.3.2 质谱条件正离子扫描,电喷雾离子源(ESI),毛细管电压为3.0 kV,离子源温度为150 ℃,脱溶剂气温度为500 ℃,脱溶剂气流速为800 L/h,锥孔反吹气流速为30 L/h,多反应监测模式(MRM)采集。
1.4 样品前处理
1.4.1 直接稀释法称取2 g(精确至 0.01 g)试样于50 mL聚丙烯离心管中,加入20 mL乙酸-甲醇(1∶99)溶液,旋转振荡提取20 min后,以8 500 r/min离心10 min。准确转移0.1 mL上清液于5 mL离心管中,加入2.9 mL 80%甲醇水溶液,旋涡混匀后,在4 ℃下以11 000 r/min离心10 min,上清液过0.22 μm有机滤膜,待测。
1.4.2 免疫亲和柱净化法准确转移1 mL 前述上清液于15 mL聚丙烯离心管中,加入9 mL水混匀,用0.5 mol/L氢氧化钠溶液调节pH至7~8,待净化。将免疫亲和柱回温至室温,放出柱内保存液后,待净化液全部上样。净化液全部流出后,用10 mL水淋洗,4 mL乙酸-甲醇溶液(2∶98)洗脱,收集洗脱液于45 ℃氮气吹干,用80%甲醇水溶液溶解并定容至1 mL,过0.22 μm的有机相微孔滤膜,待上机。

图2 80%甲醇对溶剂效应的影响Fig.2 Influence of 80% methanol on solvent effect
2 结果与讨论
2.1 稀释溶剂的选择
实验发现,当进样体积一定时,进样溶液中甲醇比例越低,溶剂效应越明显。以10 μg/L标准品为例,通过改变稀释溶液中甲醇的比例(50%、60%、70%、80%),对2种河豚毒素的溶剂效应进行了考察。由图2可知,当甲醇比例达到80%时,可明显消除溶剂效应,因此确定稀释溶剂为80%甲醇。
2.2 流动相条件的优化
流动相pH值影响BEH Amide色谱柱对目标化合物的保留以及仪器的响应强度。当流动相中甲酸浓度为0.1%时,考察了水相中不同浓度甲酸铵(0、0.2、0.5、1、2 mmol/L)对标准溶液、样品溶液出峰时间和响应强度的影响。结果发现,随着甲酸铵浓度的增大,响应强度减小,出峰时间延长。当甲酸铵浓度为2 mmol/L时,响应强度约为未加甲酸铵的1/2;当甲酸铵浓度为0时,虽具有最强的响应强度,但样品溶液与标准溶液的色谱峰出峰时间不一致,偏差为0.15 min。当甲酸铵浓度为0.5 mmol/L时,样品溶液与标准溶液的出峰时间一致,响应强度未受明显影响,所以水相中甲酸铵的浓度选择为0.5 mmol/L。
2.3 稀释倍数的优化
河豚鱼、织纹螺基质中含大量的蛋白质、脂肪、其他杂质等成分,在ESI+模式下,目标物的离子化效率易受到干扰,从而影响定量检测。比较了不同稀释倍数(100、200、300倍)对基质效应的影响,将织纹螺、河豚鱼空白样品按照本方法处理后,获得空白基质溶液,配制基质匹配标准曲线。采用下式评估基质效应:ME/%=(B-A)/A×100%[21],式中A、B分别为标准溶液标准曲线的斜率和基质匹配标准曲线的斜率。当ME=0时,表明无基质效应;当ME<0 时,表明基质效应减弱;当ME>0 时,表明基质效应增强。结果表明,稀释倍数为100、200和300倍时的ME均小于0,说明基质效应使得响应信号降低,且伴随稀释倍数的增加,基质效应减弱。当稀释倍数为300时,基质效应为-14%~-2.5%,本实验采用基质匹配标准曲线消除基质效应。综合考虑方法灵敏度与减少仪器污染,将稀释倍数设为300倍,保证实验结果的可靠性。
2.4 质谱参数的优化
在ESI+模式下,对200 μg/L的TTX与4,9-anhTTX标准溶液分别进行一级质谱全扫描分析,得到每种目标物的母离子。然后选用选择离子监测(SIR)模式,比较不同锥孔电压下母离子的响应强度,确定最大响应值时为最佳锥孔电压。再选用子离子(Daughter)扫描模式,比较不同碰撞能量下子离子的响应强度,选择响应强度较高的两个离子作为定量离子和定性离子,对应的碰撞能量为最佳优化值。TTX与4,9-anhTTX的优化质谱参数见表1。

表1 TTX及4,9-anhTTX的质谱参数Table 1 Mass spectrometric parameters of TTX and 4,9-anhTTX
*quantitative ion
2.5 方法学验证
2.5.1 线性范围、检出限与定量下限按“1.4.1”方法得到织纹螺、河豚鱼的空白基质溶液,逐级稀释2种河豚毒素混合标准储备液,以目标物的质量浓度为横坐标(X,μg/L),对应峰面积为纵坐标(Y),绘制基质匹配标准曲线,分别以3倍信噪比(LOD,S/N≥3)和10倍信噪比(LOQ,S/N≥10)确定方法检出限与定量下限,结果见表2。结果表明,在河豚鱼和织纹螺基质中,TTX与4,9-anhTTX分别在0.5~100 μg/L、0.5~50 μg/L范围内线性关系良好,相关系数(r2)均大于0.99;LOD分别为100、150 μg/kg,LOQ分别为300、450 μg/kg,可以满足日常检测的需求。

表2 2种河豚毒素的线性范围、线性方程、相关系数、检出限和定量下限Table 2 Linear ranges,linear equations,correlation coefficients,LODs and LOQs of 2 TTXs
2.5.2 准确度与精密度以2种河豚毒素为目标物,对河豚鱼、织纹螺空白基质样品进行加标回收实验,加标浓度分别为300、500、1 000 μg/kg,每个加标浓度平行测定6次,考察方法的准确度。方法精密度则通过日内、日间(连续重复3 d)测定结果的相对标准偏差(RSD)表示,结果见表3。2种河豚毒素在河豚鱼、织纹螺基质中3个加标浓度的回收率为75.4%~96.8%,日内、日间RSD均小于10%,说明该方法准确度和精密度良好,可满足实际样品的检测要求。
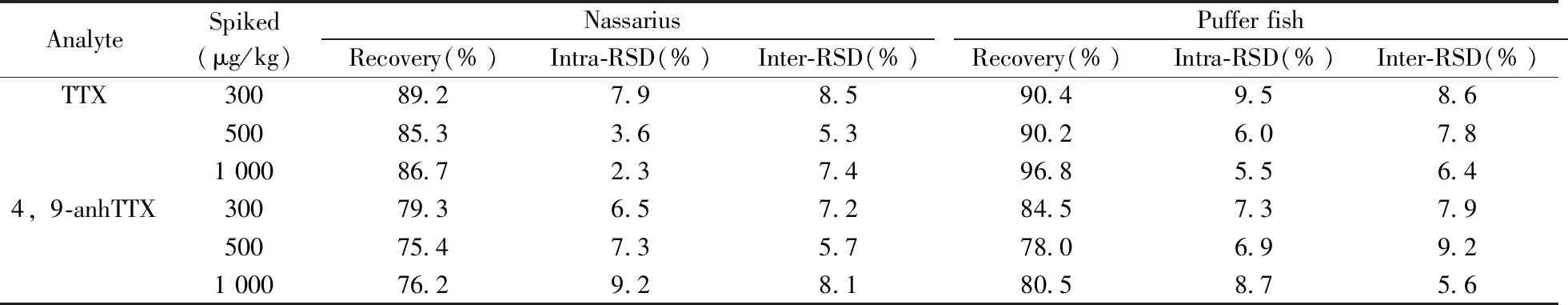
表3 2种河豚毒素的加标回收率及相对标准偏差Table 3 Recoveries and relative standard deviations of 2 TTXs
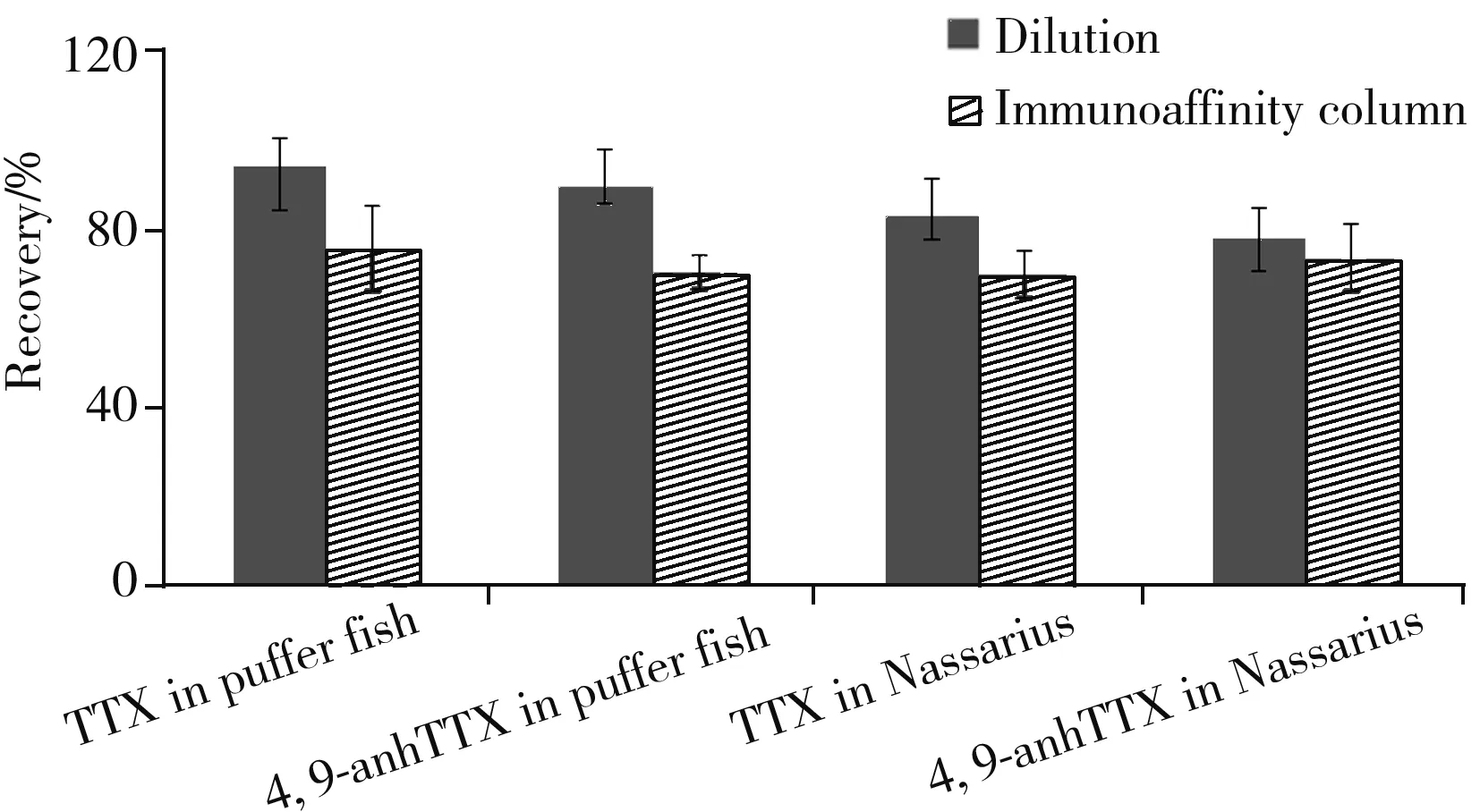
图3 两种前处理方式对河豚毒素的回收率(n=6)Fig.3 Recoveries of TTXs with different processing methods(n=6)
2.6 前处理方法的比较
GB 5009.206-2016[22]中采用免疫亲和柱净化的前处理方式,本研究利用简单、快速的直接提取、稀释、冷冻离心的方法进行前处理,通过空白基质加标实验,比较了两种前处理方法的回收率、基质效应和灵敏度。由图3可知,直接稀释法的回收率高于免疫亲和柱净化法,可能是其避免了过程损失,提高了方法准确度。但免疫亲和柱净化后,基本无基质效应,且具有富集目标物的作用,所以灵敏度比直接稀释法高。根据日本、韩国对河豚鱼可食部分中TTX的限量要求,本方法的检出限可满足要求。从实验数据看,河豚鱼样品的加标回收率高于织纹螺,可能由于织纹螺基质更加复杂,基质效应更强所致。
2.7 实际样品分析
利用优化后的方法对2017年3月于东海捕获的7种河豚鱼(34条)不同组织中的TTX、4,9-anhTTX进行检测,结果如图4。结果显示,不同种类的河豚鱼体内TTX、4,9-anhTTX的含量相差较大,月腹刺豚组织中含量最高,其中TTX总含量为60.6 mg/kg,4,9-anhTTX总含量为1.6 mg/kg,超出日本对河豚鱼的限量(2.2 mg/kg)。刺豚的毒素含量最低,各组织均未检出。同种鱼类,不同组织中所含毒素差异也较大。大部分毒素集中于鱼卵、鱼肝中,这与文献研究结果相一致[23],此研究结果可为有条件开放河豚市场提供参考。同时应用本方法对2017~2018年浙江省沿海地区采集的21份织纹螺样品进行检测,TTX的检出率为95.2%,含量为0.15~16.36 mg/kg;4,9-anhTTX的检出率为27.6%,含量为0.14~1.56 mg/kg。整体来看,织纹螺中河豚毒素含量也较高,存在很大的安全隐患。

图4 不同河豚鱼组织中河豚毒素的含量Fig.4 Amounts of TTXs in different kinds of puffer fish tissue
3 结 论
本研究采用沉淀、提取、离心、稀释的快速前处理方法,结合超高效液相色谱-串联质谱技术测定河豚鱼与织纹螺中2 种河豚毒素的含量。本方法前处理过程简单、高效,降低了检测成本,避免了目标物的损失,适合批量样品中河豚毒素的快速、准确定量检测。
