饲料中添加海洋红酵母对宝石鲈生长性能的影响
2020-06-01郭静文陈山多冯雨薇郭子华邢程顺侯丽萍
郭静文 陈山多 冯雨薇 郭子华 吴 丹 邢程顺 侯丽萍 舒 琥*
(1.广州大学生命科学学院,广东广州510006;2.广州大学环境科学与工程学院,广东广州510006)
当前我国的养殖业主要采取高密度养殖模式,由 于饵料只有部分被利用,养殖产生的残饵、粪便极大污染了环境[1]。随着环境污染的加剧以及养殖密度的增加,鱼类生长过程中的健康问题日益突出。目前普遍利用一些药物来治疗鱼类病害,但是细菌病毒对药物的耐药性日益增加,且这些药物在水产品及环境中的残留也威胁到人体的健康和安全,因此近年来许多学者通过益生菌对饲料中营养水平的调控来提高鱼类免疫力[2-4]。
益生菌能调节水产动物肠道微生物平衡,提高免疫力,减少疾病产生,在水产养殖中起着很大的作用[5-8]。Gatesoup[9]将益生菌的概念应用到水产养殖上,认为益生菌是能够进入动物肠道内,提高动物健康水平的一类微生物细胞。海洋红酵母(Rhodotorulamucilaginosa)是从海泥中分离出的单细胞真核生物,是一类抗逆性较强的腐生菌[10],海洋红酵母作为生态养殖中广泛应用的饲料添加剂,具有促进水生动物生长、显著提高抗氧化能力、提高成活率和增强机体的非特异性免疫能力的作用[11]。本实验通过在饲料中添加不同浓度的海洋红酵母对宝石鲈(Scorturmbarcoo)生长、免疫的影响,为在宝石鲈及其他经济鱼类的饲养中推广海洋红酵母提供依据和指导。
1 材料与方法
1.1 实验饲料
实验饲料包括基础饲料和海洋红酵母饲料,海洋红酵母饲料由基础饲料和不同量的海洋红酵母混匀制得。实验用基础饲料为“恒兴牌”淡水鱼膨化饲料,按照0.1%、0.3%和0.5%比例称取海洋红酵母菌粉制成海洋红酵母浓度不同的实验饲料(见表1)。海洋红酵母由中国水产科学研究院南海水产科学研究所海利欣生物科技有限公司提供,活菌总数1010CFU/g。实验饲料现配现用。

表1 实验饲料组成
1.2 宝石鲈养殖
实验所用宝石鲈幼鱼来自上海观星农业科技有限公司广州东涌水产养殖基地,在广州大学水产养殖实验室暂养2周,稳定之后开始实验。选用12个规格相同的鱼缸(长0.8 m×宽0.5 m×高0.45 m),挑选体质健康,规格整齐,体重差异小[平均体质量为(12.23±1.07) g,体长为9.52 cm]的宝石鲈作为实验对象。实验分4组,一组对照组(Control)只喂基础饲料,实验组分别添加0.1%(Diet1)、0.3%(Diet2)和0.5%(Diet3)浓度海洋红酵母的基础饲料喂食,每个组3 个重复,每个重复30 尾鱼。每天投喂2 次,投喂时间分别为8:30 和16:30,饱食投喂,日投喂量为鱼体质量的4%。每天观察宝石鲈摄食情况。水体体积约为100 L,配合供氧机24 h增氧,配置水循环系统装置,使水体条件保持在适宜温度(21~25 ℃)、pH值(7.0~8.5)和DO(>4.5 mg/l)。
1.3 解剖取样
计算特定生长率、增重率、肥满度、肝体指数和脏体指数。
特定生长率(SGR,%/d)=100×[In 终末体质量(g)-In初始体质量(g)]/时间(d)
增重率(WGR,%)=100×[终末体质量(g)-初始体质量(g)]/初始体质量(g)
肥满度(CF,%)=100×体质量(g)/[体长(cm)]3肝体指数(VSI,%)=100×肝脏质量(g)/体质量(g)脏体指数(HIS,%)=100×内脏质量(g)/体质量(g)
1.4 样品测试
1.4.1 血液免疫指标
将解剖取样中得到的血清置于冰上解冻,使用南京建成生物工程研究所生产的试剂盒测定血清总蛋白、白蛋白、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、谷丙转氨酶(AST)和谷草转氨酶(ALT)。
1.4.2 肝脏抗氧化性能测定
第2,短信提醒及微信推送。护理人员每周需通过短信形式为患者发送骨科的相关问题,并督促患者按照护理计划执行各项操作。此外,护理人员可组织患者建立微信群,以便患者随时咨询相关问题;同时护理人员还可通过微信向患者推送疾病的相关知识及护理注意事项等。
宝石鲈肝脏抗氧化性能测定使用南京建成生物工程研究所的试剂盒测定以下指标:总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)和过氧化氢酶(CAT)。
1.4.3 肠道消化酶活性
测定宝石鲈前肠、中肠和后肠消化酶活性,先将样品置于冰上解冻,0.86%生理盐水提前预冷至4 ℃,按照样品质量∶体积=1∶4加入样品并使用匀浆器搅碎至匀浆。离心机设置4 ℃、4 000 r/min离心30 min,将匀浆离心后,取上清液进行消化酶活性测定。肠道中淀粉酶活性用碘-比色法测定[12],脂肪酶活性用聚乙烯醇橄榄油乳化液水解法[13]。实验试剂均使用南京建成生物工程研究所生产试剂盒。
1.5 攻毒实验
饲喂8周后,每个处理取10尾鱼用维氏气单胞菌(Aeromonas veronii)活菌菌悬液(6.4×108CFU/ml)通过腹腔注射进行攻毒,每尾注射0.2 ml 然后置于干净的水族缸内继续饲养并观察10 d,饲养条件和注射前相同,每天多次观察和记录宝石鲈的发病和死亡情况。
1.6 数据统计与分析
实验数据使用Excel 整理并以“平均值±标准差”形式记录,显著性差异使用SPSS 23.0进行计算分析,P<0.05表示显著性差异,P<0.01表示极显著性差异。
2 结果
2.1 生长性能(见表2)
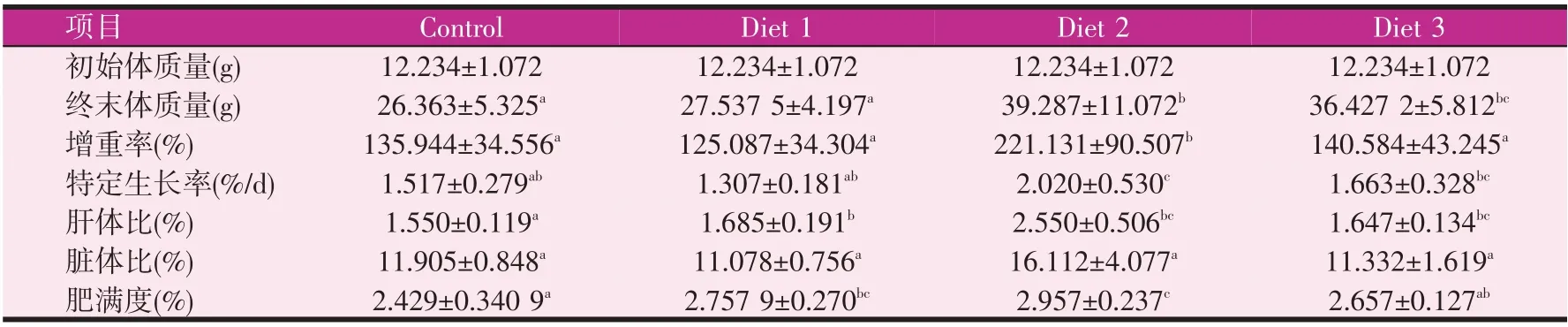
表2 添加不同浓度的海洋红酵母对宝石鲈生长性能的影响
由表2可知,饲料中添加不同浓度的海洋红酵母后对宝石鲈生长性能产生影响。0.3%组和0.5%组终末体质量较对照组有显著提高(P<0.05),0.1%组较对照组有增加但无显著性差异。0.3%组增重率和特定生长率较对照组显著提高(P<0.05),其他三组无显著性差异。实验组肝体比较对照组显著增加(P<0.05)。脏体比各实验组较对照组均无显著性差异(P>0.05)。0.1%组和0.3%组肥满度较对照组显著增加(P<0.05),0.5%组较对照组无显著性差异(P>0.05)。
2.2 攻毒结果(见图1)
由图1 可知,用维氏气单胞菌攻毒实验时,实验组和对照组平均死亡率均在44 h后保持稳定,对照组死亡率为93.3%,0.1%组、0.3%组和0.5%组死亡率分别为83.3%、70.0%和66.7%,0.3%组和0.5%组与对照组有显著性差异(P<0.05)。
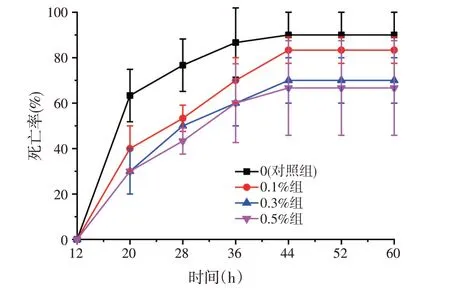
图1 维氏气单胞菌对宝石鲈攻毒实验死亡率的影响
2.3 血液免疫指标(见表3、表4)
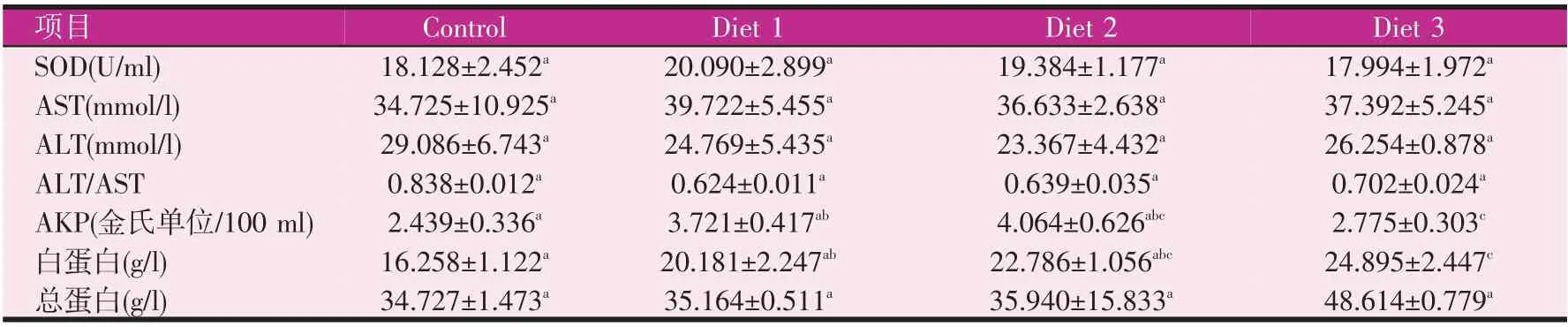
表3 实验4周时宝石鲈血液免疫指标
如表3、表4 所示,实验4 周后,各实验组AKP、白蛋白、总蛋白含量均有上升趋势,相较于对照组,0.5%组AKP、白蛋白浓度显著提高(P<0.05)。SOD、AST、ALT及ALT/AST各实验组和对照组无显著性差异。实验8周后,各实验组SOD、AKP、白蛋白和总蛋白均有上升趋势。相较于对照组,0.3%组和0.5%组SOD含量分别增加80.7%和134.5%。0.3%组AKP 较于对照组显著增加(P<0.05)。白蛋白含量0.3%组最高,但与对照组相比并无显著性差异,总蛋白含量0.3%组最高,相较于对照组,0.3%和0.5%组总蛋白浓度均显著提高。AST、ALT和ALT/AST均无显著性差异,无统计学意义。
2.4 肠道消化酶(见表5、表6)
由表5、表6 所示,实验4 周后,实验组前肠淀粉酶、中肠淀粉酶较对照组都有增加,其中前肠淀粉酶0.5%组显著增加(P<0.05),中肠淀粉酶0.3%组和0.5%组分别增加113.3%和70.2%(P<0.05)。后肠淀粉酶各实验组和对照组无显著性差异。实验8 周后,前肠淀粉酶和后肠淀粉酶0.3%组均值最高,但各组无显著性差异。中肠淀粉酶0.3%组最高,较对照组差异显著(P<0.05)。表7、表8 所示,实验4 周和实验8 周后,前肠0.3%组脂肪酶较于对照组均显著增加(P<0.05),中肠、后肠脂肪酶较对照组无显著性差异。
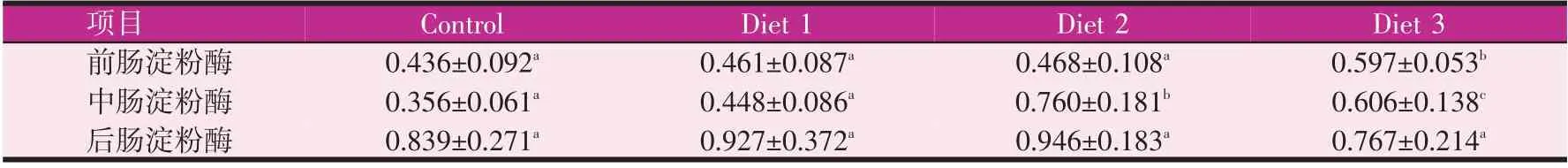
表5 实验4周时宝石鲈肠道淀粉酶活性(U/mg prot.)
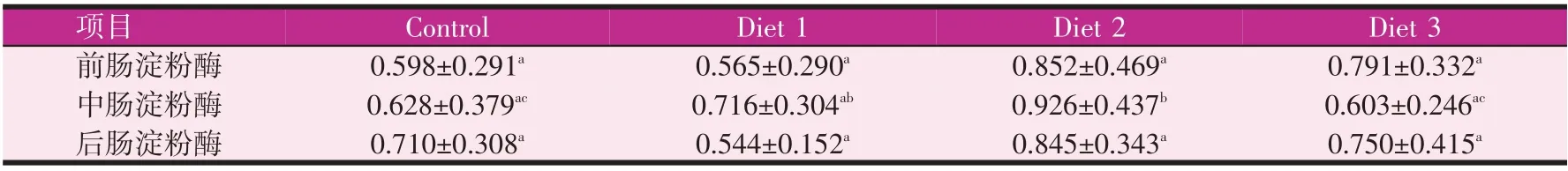
表6 实验8周时宝石鲈肠道淀粉酶活性(U/mg prot.)
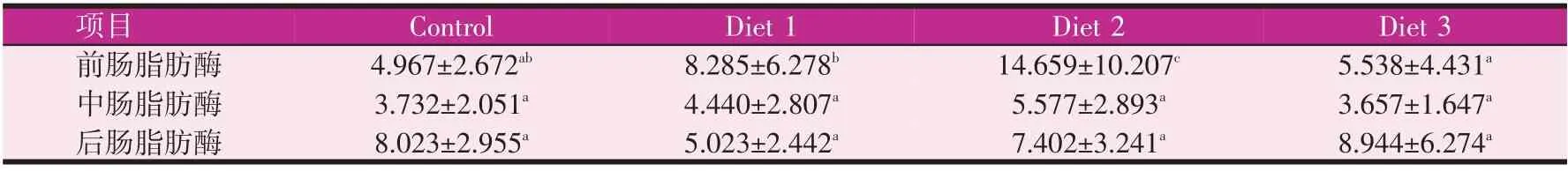
表7 实验4周时宝石鲈肠道脂肪酶活性(U/mg prot.)

表8 实验8周时宝石鲈肠道脂肪酶活性(U/mg prot.)
2.5 肝脏免疫
如表9、表10 可知,实验4 周后,实验组T-AOC、CAT、GSH 和SOD 值较对照组均有增加,0.3%组TAOC、GSH 和CAT 值较对照组显著增加(P<0.05),其他实验组均有增加,但无显著性差异。0.1%组和0.3%组SOD 值显著高于对照组(P<0.05),0.5%组较对照组无显著性差异。
实验8 周后,0.1%组和0.3%组较对照组T-AOC值分别增加了90.6%和159.4%,差异显著(P<0.05),0.5%组较对照组有增加但无显著性差异。0.3%组GSH、CAT、SOD 均显著高于对照组(P<0.05),其他组较对照组都有增加,但没有显著差异(P>0.05)。
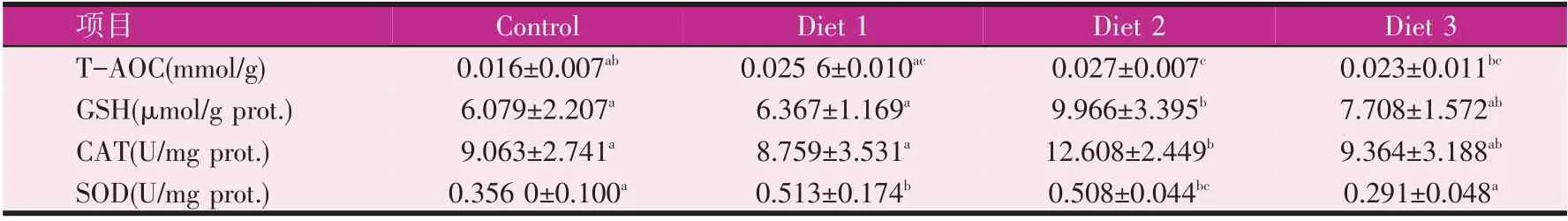
表9 实验4周时宝石鲈肝脏抗氧化性能
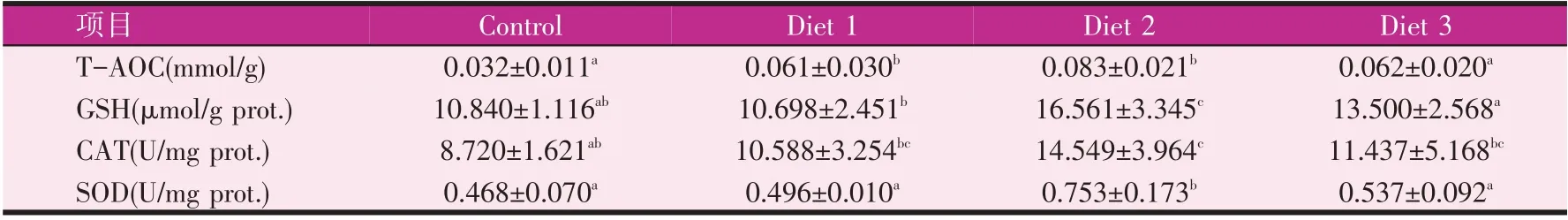
表10 实验8周时宝石鲈肝脏抗氧化性能
3 讨论
本实验中,基础饲料中加入海洋红酵母,对宝石鲈的生长性能有积极的影响,能提高增重率、特定生长率和肥满度。夏冬梅等[14]研究表明在饲料中添加海洋红酵母可以促进罗非鱼(Oreochromis niloticus)生长、降低饲料系数、提高消化酶活性和增强非特异性免疫。尹安伟等[15]在饲料中加入海洋红酵母,可以显著增加对虾的终末质量,并且可以提高日本对虾(Penaeus japonicus)幼体的成活率,促进其生长发育。Hien Van Doan 等[16]向罗非鱼饲料中添加不同水平乳酸菌和芽孢杆菌,探究分别对罗非鱼生长、免疫的影响;张瑞玲等[17-18]报道了在大菱鲆(Scophthalmus maximus L.)基础饲料中分别添加0、0.5、1.0 g/kg 和1.5 g/kg 的海洋红酵母,比较各实验组和空白组特定生长率、相对增重率、摄食率和饵料系数均未发现显著性差异,说明在基础饲料中添加该浓度的海洋红酵母对大菱鲆的生长性能和摄食无影响。以上对饲料中添加海洋红酵母研究结论不一致的原因可能跟鱼的种类、海洋红酵母的种类、鱼的养殖周期和养殖方式的不同有关系。
血清总蛋白、白蛋白和球蛋白是血液中的重要化合物,反映了蛋白质代谢水平的情况,血清蛋白是指鱼类是否健康的重要免疫参数[19]。实验组鱼在喂养4 周和8 周时血液蛋白含量相对对照组都有上升,说明海洋红酵母可以提高鱼体内蛋白质代谢能力。鱼类容易受到氧自由基的影响,超氧化物歧化酶(SOD)是机体抗氧化酶系统的主要作用成分之一,可对抗和阻断因氧自由基对细胞的损害,并及时修复受损细胞,恢复原自由基造成的对细胞伤害,反映机体的抑制氧自由基的能力[20]。碱性磷酸酶(AKP)是在所有生物体中参与许多重要功能的一种调控酶,可以破坏有害物质的表面分子组成,加快有害物质降解,防止病菌的繁殖[21]。本实验进行8周时,与对照组相比,0.3%组的SOD 和AKP 显著增加,AST 无显著性差异,说明0.3%组鱼体抗氧化能力和对有害物质的降解能力更强,这可能与血清蛋白的提高有关系。谷丙转氨酶(AST)和谷草转氨酶(ALT)是鱼类线粒体中广泛存在的转氨酶,是诊断肝脏功能和损伤的重要参数。本实验各组中转氨酶均无明显变化,说明在基础饲料中添加海洋红酵母不会对肝功能有损害作用。
海洋红酵母中含有丰富的维生素E 和类胡萝卜素[22]。类胡萝卜素有提高免疫力的作用,对消除自由基和维护细胞膜稳定性有作用[23]。类胡萝卜素可以提高鱼类的非特异性免疫因子血清溶菌酶的活力,从而通过提高鱼类的非特异性免疫来提高其生长性能[24]。这可能是在基础饲料中添加海洋红酵母血液和肝脏中抗氧化物质增多,自由基减少的原因。肝脏中总抗氧化能力(T-AOC)是鱼体、酶抗氧化系统和抗氧化酶系统的综合反映,用于完成抗氧化作用,其与健康状况相关联。还原型谷胱甘肽(GSH)是主要的抗氧化剂,参与生物体系中对抗脂质过氧化的防御机制。过氧化氢酶(CAT)通过催化过氧化氢分解为水和分子氧,达到清除自由基,降低脂质过氧化氢损害的作用。本次实验中实验组T-AOC、GSH 和CAT 的提高,说明海洋红酵母可以提高酶抗氧化能力,减少了自由基对鱼体的损害。
外界环境和饲料容易对鱼类肠道消化酶产生影响,饲料不仅可能影响肠道消化酶活性和分布,还可能对消化酶的分泌产生影响,饲料中营养物质的组成会对消化酶产生影响,消化酶的活性受蛋白质的含量影响,肠道淀粉酶和脂肪酶受脂肪含量的影响[25],宝石鲈肠道淀粉酶和脂肪酶活性可以反映其对营养物质的消化和吸收的能力。本实验中淀粉酶和脂肪酶活性在实验组有提高,这表明海洋红酵母对宝石鲈产生了积极作用,提高了宝石鲈对营养物质的消化和吸收。杨世平等[26]研究发现沼泽生海洋红酵母(Rhodosporidium paludigenum)对凡纳滨对虾(Litopenaeus vannamei)胰腺分泌的蛋白酶和淀粉酶有促进作用(P<0.05)。综上,海洋红酵母提高宝石鲈肠道淀粉酶和脂肪酶活性的作用机理可能是:①海洋红酵母可以改善肠道菌群生态平衡,促进有益菌的繁殖,抑制有害菌,促进新陈代谢从而增强相关消化酶的合成;②海洋红酵母在肠道内产生淀粉酶和脂肪酶等消化酶类物质。
4 结论
基础饲料中添加海洋红酵母可以促进宝石鲈的生长,提高鱼体的抗氧化能力减少自由基的损害、增强肝脏抗氧化能力、并对肝脏无损害作用,海洋红酵母还对肠道淀粉酶和脂肪酶活性有促进作用,其中添加0.3%的海洋红酵母组效果最佳,在宝石鲈的基础饲料中建议添加量为0.3%。
