参菊洗剂的抗过敏、止痒作用及急性毒性研究
2020-05-28张广求张美祥黄冈市中心医院长江大学黄冈临床医学院湖北黄冈438000
张广求,张美祥,谭 璐(黄冈市中心医院,长江大学黄冈临床医学院,湖北 黄冈 438000)
参菊洗剂是黄冈市中心医院根据临床验方研制的中药制剂,主要由苦参、野菊花、黄柏、蛇床子等中药组成,具有清热解毒,祛风除湿,杀虫止痒功效,用于湿毒所致的细菌性、真菌性、滴虫性阴道炎及皮肤瘙痒症的治疗,具有较好的临床疗效[1]。前文[2-4]对参菊洗剂的体外抑菌、抗阴道毛滴虫作用、皮肤安全性及阴道黏膜刺激性进行了实验研究。本文以功能与主治基本一致的洁尔阴洗液作对照,采用2,4-二硝基氯苯(DNCB)致小鼠迟发型超敏反应模型,评价参菊洗剂的抗过敏作用;通过建立右旋糖酐40诱导的小鼠瘙痒模型、磷酸组胺诱导的豚鼠瘙痒模型,对该药的止痒作用及其机制进行研究;采用小鼠进行经口急性毒性实验,评价该药的安全性,为临床安全使用和进一步研究开发提供理论依据。
1 实验材料
1.1 药物及试剂
参菊洗剂(含生药量为0.54 g·mL-1,黄冈市中心医院自制,批准文号:鄂药制字Z20180800,批号:180328,180415,180502);洁尔阴洗液(含生药量为1 g·mL-1,四川恩威制药有限公司,批号:1704003);0.9%氯化钠注射液(武汉滨湖双鹤药业有限责任公司,批号:170401-0504);DNCB(上海中泰化学试剂有限公司,批号:20170611),临用前用丙酮配制成5%的致敏浓度和1%的激发浓度;右旋糖酐40(广州市齐云生物技术有限公司,批号:CH0306B508Y);超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,批号:20180322);丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号:20180328);肿瘤坏死因子-α(TNF-α)试剂盒(武汉华美生物工程有限公司,批号:20180428);磷酸组胺(美国SIGMA公司,批号:BCBN6122V);硫化钠、乙醚均为分析纯。
1.2 实验动物
KM小鼠,SPF级,雌雄各半,体质量18~22 g,由三峡大学实验动物中心提供,实验动物生产许可证号:SCXK(鄂)2017-0012。豚鼠,Dunkin-Hartley系,普通级,雌雄各半,体质量260~290 g,由湖北省实验动物研究中心提供,实验动物生产许可证号:SCXK(鄂)2015-0018。使用许可证号:SYXK(鄂)2014-0083,实验室内温度(22±2)℃,相对湿度为(60±5)%。
1.3 仪器
ZH-YLS-Q4鼠耳打孔器(ø8 mm,原阳县振华教学仪器有限公司);AL104型电子天平[梅特勒托利多仪器(上海)有限公司];TGL-16G台式离心机(上海安亭科学仪器厂);Multiskan FC型酶标仪[赛默飞世尔(上海)仪器有限公司];电子秒表;小鼠灌胃针。
2 方法
2.1 抗DNCB致小鼠迟发型超敏反应实验
取小鼠50只,雌雄各半,随机分为5组,每组10只。各组分别为:参菊洗剂低、中、高剂量组(浓度分别为10%、20%、40%,对应含生药量分别为0.054、0.108、0.216 g·mL-1),10%洁尔阴洗液对照组(含生药量为0.1 g·mL-1),模型对照组。于每只小鼠背部皮下各注射5% DNCB丙酮溶液20 μL致敏,并将小鼠腹部去毛3 cm×2 cm,分别将受试药液或对照液均匀涂抹于脱毛区,模型对照组凃抹0.9%氯化钠注射液,每只剂量均为0.1 mL,使各液与小鼠皮肤充分接触,每日2次,每次间隔12 h,连续7 d。
末次给药1 h后,分别以1% DNCB丙酮溶液均匀涂布在小鼠右耳廓的正反两面激发过敏反应,每只20 μL,同时左耳涂等剂量丙酮溶液作为对照。涂耳24 h后,用乙醚浅表麻醉小鼠,进行颈椎脱臼处死,沿耳廓基线剪下双耳,用鼠耳打孔器于左、右耳相同部位取下圆形耳片,准确称重,以同一只小鼠两耳片质量差值为肿胀度,计算各组肿胀度与肿胀抑制率(%)。肿胀度=右耳片质量(mg)-左耳片质量(mg);肿胀抑制率(%)=[(模型对照组肿胀度均值-给药组肿胀度均值)/模型对照组肿胀度均值]×100%。
仔细分离,摘取胸腺及脾组织,准确称重,以10 g体重胸腺(脾)质量表示胸腺(脾)指数[胸腺(脾)指数=胸腺(脾)质量(mg)/体重(g)×10][5]。
2.2 抗右旋糖酐致小鼠全身瘙痒实验
取小鼠50只,雌雄各半,随机分为5组,每组10只。各组分别为:参菊洗剂低、中、高剂量组(含生药量分别为0.054、0.108、0.216 g·mL-1),10%洁尔阴洗液对照组,模型对照组。各组小鼠腹部同一部位脱毛2 cm×2 cm,24 h后,分别将低、中、高剂量组的参菊洗剂或10%洁尔阴洗液20 μL,均匀涂抹于脱毛区,每日2次,每次间隔12 h,连续3 d,模型对照组涂抹相同剂量的0.9%氯化钠注射液。末次给药1 h后,于小鼠尾静脉注射0.02%右旋糖酐40溶液0.1 mL,以小鼠出现前爪搔抓头部、后爪搔抓躯干、嘴咬全身各部位作为瘙痒指征,观察并记录每只小鼠30 min内小鼠搔痒次数及搔痒持续总时间[6]。然后,用乙醚麻醉小鼠,眼眶静脉取血,并颈椎脱臼处死。全血不加抗凝剂,静置30 min,于3 000 r·min-1(r=10 cm)离心10 min,取上层血清,置4 ℃冰箱中冷藏,备用。按照试剂盒说明书操作,分别测定血清SOD活性及MDA、TNF-α水平。
2.3 抗磷酸组胺致豚鼠局部瘙痒实验
取豚鼠50只,雌雄各半,随机分为5组,每组10只。实验前2 d,将各组豚鼠右后足背部剃毛2 cm×2 cm,分别将低、中、高剂量组的参菊洗剂(含生药量分别为0.054、0.108、0.216 g·mL-1)或10%洁尔阴洗液均匀涂抹于剃毛区,每日2次,每次间隔12 h,连续用药2 d,给药量为1 mL·kg-1,模型对照组同时涂抹相同剂量的0.9%氯化钠注射液。实验当日,用320目细砂纸分别轻轻均匀擦伤剃毛处,使之发红,以伤及表皮、不伤真皮、有轻度渗血但不出血为度,局部再涂受试药液或对照药液1次。涂药后10 min,分别于创面处滴0.01%磷酸组胺溶液,每只50 μL,此后,每隔3 min依次递增0.01%磷酸组胺的浓度:0.02%、0.03%、0.04%等,每次均为每只50 μL,直至出现豚鼠回头口舔右后足,记录所给予的磷酸组胺总量,作为致痒阈[6]。
2.4 小鼠口服给药急性毒性实验
根据文献[7],取小鼠40只,雌雄各半,随机分为4组,每组10只。各组分别为:参菊洗剂低、中、高剂量组(浓度分别为20%、60%、100%即原液,对应含生药量分别为0.108、0.324、0.540 g·mL-1),阴性对照组。实验前禁食12 h,不限饮水,参菊洗剂低、中、高剂量组分别依次灌胃,阴性对照组以纯化水灌胃,每只0.4 mL,共灌胃3次,每次间隔8 h。
灌胃给药后2 h内,每15 min观察1次;给药后2~4 h内,每30 min观察1次;给药后4~8 h内,每2 h观察1次;给药后8~24 h内,每4 h观察1次;以后每天早、晚各观察1次,连续观察14 d。记录各组小鼠的外观、行为活动、精神状态、食欲饮水、大小便及颜色、皮毛、肤色、呼吸、有无分泌物[8],有无眼睑肿胀、瞳孔改变、结膜充血,记录死亡时间、濒死前反应等,于2、4、6、8、10、12、14 d分别称重。实验结束时,用乙醚浅表麻醉小鼠,进行颈椎脱臼处死和大体解剖,观察并记录心、肺、肝、胃、脾、肾、小肠、大肠的形态、质地和颜色。如有死亡或解剖发现器官异常病变,则进行组织病理学检查。
2.5 统计学方法
实验数据采用SPSS19.0统计学软件进行分析,计量资料用均数±标准差表示,模型组与各剂量组间的比较采用单因素方差分析,组间两两比较采用t检验,以P<0.05为差异具有统计学意义。
3 结果
3.1 抗DNCB致小鼠迟发型超敏反应实验
参菊洗剂低、中、高剂量组和10%洁尔阴洗液对照组的小鼠耳肿胀程度均明显降低,与模型对照组比较,差异有统计学意义(P<0.05或P<0.01),且耳肿胀程度随参菊洗剂的剂量增加而降低,呈现明显的量效关系,表明参菊洗剂能抑制DNCB所致的小鼠迟发型超敏反应。参菊洗剂中、高剂量组还能增加胸腺和脾组织质量,升高胸腺指数和脾指数,且高剂量组更明显,与模型对照组比较,差异有统计学意义(P<0.05),见表1。
表1 参菊洗剂对DNCB致小鼠迟发型超敏反应的影响.±s,n=10Tab 1 Effect of Shenju lotion on delayed hypersensitivity in mice induced by DNCB.±s,n=10
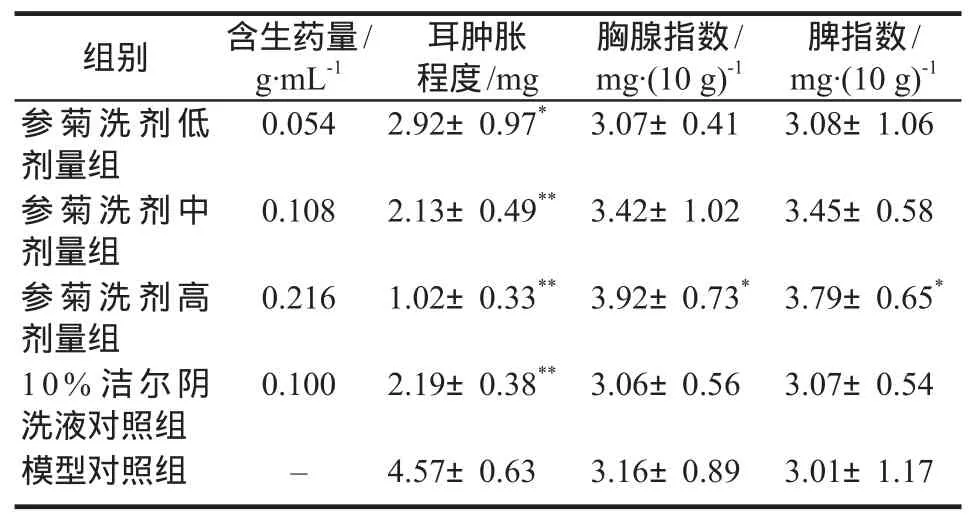
表1 参菊洗剂对DNCB致小鼠迟发型超敏反应的影响.±s,n=10Tab 1 Effect of Shenju lotion on delayed hypersensitivity in mice induced by DNCB.±s,n=10
注:与模型对照组比较,*P <0.05,**P <0.01Note: compared with the model control group,*P <0.05,**P <0.01
脾指数/mg·(10 g)-1参菊洗剂低剂量组组别 含生药量/g·mL-1耳肿胀程度/mg胸腺指数/mg·(10 g)-1 0.054 2.92±0.97* 3.07±0.41 3.08±1.06参菊洗剂中剂量组0.108 2.13±0.49** 3.42±1.02 3.45±0.58参菊洗剂高剂量组0.216 1.02±0.33** 3.92±0.73* 3.79±0.65*10%洁尔阴洗液对照组0.100 2.19±0.38** 3.06±0.56 3.07±0.54模型对照组 – 4.57±0.63 3.16±0.89 3.01±1.17
3.2 抗右旋糖酐致小鼠全身瘙痒实验
参菊洗剂各给药组和10%洁尔阴洗液对照组均可明显缩短右旋糖酐40所致的小鼠搔痒次数,搔痒持续总时间显著缩短,与模型对照组比较,差异均有统计学意义(P<0.05或P<0.01)。参菊洗剂中、高剂量组和10%洁尔阴洗液对照组的SOD活性,与模型对照组相比,差异有统计学意义(P<0.05)。参菊洗剂中、高剂量组和10%洁尔阴洗液对照组的MDA、TNF-α水平显著降低,与模型对照组相比,差异有显著统计学意义(P<0.01);参菊洗剂低剂量组的MDA、TNF-α水平,与模型对照组相比,差异有统计学意义(P<0.05),见表2。
3.3 抗磷酸组胺致豚鼠局部瘙痒实验
参菊洗剂低剂量组能提高磷酸组胺致豚鼠瘙痒的致痒阈,有抑制组胺引起的皮肤瘙痒作用,与模型对照组比较,差异有统计学意义(P<0.05)。参菊洗剂中、高剂量组和10%洁尔阴洗液对照组的致痒阈,与模型对照组比较,差异有显著统计学意义(P<0.01),见表3。
表2 参菊洗剂对右旋糖酐致小鼠全身瘙痒反应的影响.±s,n=10Tab 2 Effect of Shenju lotion on systemic pruritus in mice induced by dextran.±s,n=10
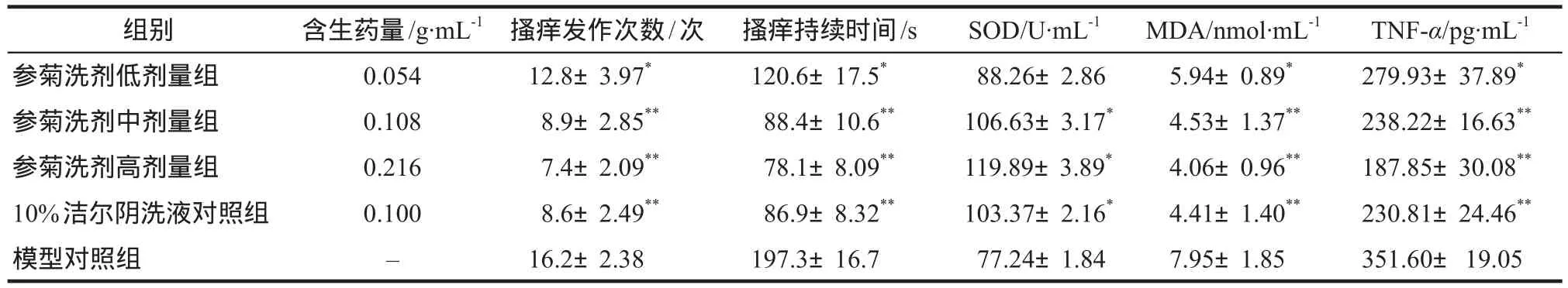
表2 参菊洗剂对右旋糖酐致小鼠全身瘙痒反应的影响.±s,n=10Tab 2 Effect of Shenju lotion on systemic pruritus in mice induced by dextran.±s,n=10
注:与模型对照组比较,*P <0.05,**P <0.01Note: compared with the model control group,*P <0.05,**P <0.01
组别 含生药量/g·mL-1 搔痒发作次数/次 搔痒持续时间/s SOD/U·mL-1 MDA/nmol·mL-1 TNF-α/pg·mL-1参菊洗剂低剂量组 0.054 12.8±3.97* 120.6±17.5* 088.26±2.86 5.94±0.89* 279.93±37.89*参菊洗剂中剂量组 0.108 08.9±2.85** 088.4±10.6** 106.63±3.17* 4.53±1.37** 238.22±16.63**参菊洗剂高剂量组 0.216 07.4±2.09** 078.1±8.09** 119.89±3.89* 4.06±0.96** 187.85±30.08**10%洁尔阴洗液对照组 0.100 08.6±2.49** 086.9±8.32** 103.37±2.16* 4.41±1.40** 230.81±24.46**模型对照组 – 16.2±2.38 197.3±16.7 077.24±1.84 7.95±1.85 351.60±19.05
表3 参菊洗剂对磷酸组胺致豚鼠局部瘙痒反应的影响.±s,n=10Tab 3 Effect of Shenju lotion on local itching reaction in guinea pigs induced by histamine phosphate.±s,n=10
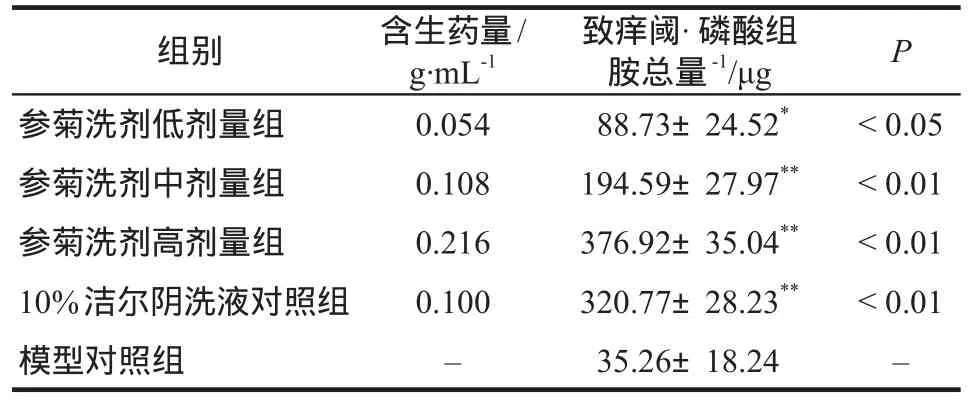
表3 参菊洗剂对磷酸组胺致豚鼠局部瘙痒反应的影响.±s,n=10Tab 3 Effect of Shenju lotion on local itching reaction in guinea pigs induced by histamine phosphate.±s,n=10
注:与模型对照组比较,*P <0.05,**P <0.01Note: compared with the model control group,*P <0.05,**P <0.01
组别 含生药量/g·mL-1致痒阈·磷酸组胺总量-1/μg P参菊洗剂低剂量组 0.054 088.73±24.52* <0.05参菊洗剂中剂量组 0.108 194.59±27.97** <0.01参菊洗剂高剂量组 0.216 376.92±35.04** <0.01 10%洁尔阴洗液对照组 0.100 320.77±28.23** <0.01模型对照组 – 035.26±18.24 –
3.4 小鼠口服给药急性毒性实验
连续观察14 d,参菊洗剂各剂量组小鼠的精神、行为活动、肌肉运动、呼吸、对刺激的反应、皮肤毛发光泽、摄食、饮水、分泌物和排泄物等均无异常,无眼睑肿胀、瞳孔改变、结膜充血,也无其他中毒反应和引起小鼠死亡,与阴性对照组比较无差异。参菊洗剂各剂量组小鼠的体重均有增长,与阴性对照组比较,差异无统计学意义(P>0.05)。参菊洗剂低、中、高剂量组和阴性对照组小鼠的增长率分别为70.66%、71.65%、72.09%、71.52%,未出现体重明显增加和减少,显示体重变化趋势正常,符合基本生长规律,未影响小鼠的生长。结果表明,参菊洗剂小鼠口服给药基本无毒,见表4。
解剖检查小鼠的上述各脏器形态、质地和色泽均正常,未见异常改变,且无性别差异。分别摘取心、肝、脾、肾进行称重,同“2.1”项计算脏器指数。参菊洗剂各剂量组小鼠的心、肝、脾、肾指数,与阴性对照组比较,差异均无统计学意义(P>0.05);参菊洗剂各剂量组的组间比较,差异也无统计学意义(P>0.05),见表5。
4 讨论
4.1 参菊洗剂的作用与毒性
研究结果表明,0.054、0.108、0.216 g·mL-1参菊洗剂可不同程度地抑制DNCB所致的小鼠迟发型超敏反应,0.216 g·mL-1剂量组能明显升高胸腺指数及脾指数,提示参菊洗剂可能具有免疫调节作用。明显减少右旋糖酐40所致的小鼠瘙痒发作次数和持续总时间,提高小鼠血清SOD活性(P<0.05),降低MDA、TNF-α等炎症因子的水平(P<0.01或P<0.05),表明参菊洗剂各给药组具有较好的抗氧化、清除自由基及降低炎症因子水平的能力。明显抑制磷酸组胺致豚鼠局部瘙痒,提高致痒阈,量效关系明显。参菊洗剂不含毒性中药材,小鼠口服给药急性毒性实验证实,0.108、0.324、0.540 g·mL-1参菊洗剂在给药后均未出现中毒反应和死亡。通过上述动物模型及多指标的评价方法,证实参菊洗剂外用具有抗过敏、止痒作用,小鼠口服给药基本无毒。
4.2 参菊洗剂抗过敏作用机制
迟发型超敏反应是由T淋巴细胞介导的一种超敏反应,在机体接触致敏源约24 h后才出现病变,属Ⅳ型变态反应[5]。计算小鼠的胸腺指数和脾指数,可反映对机体免疫功能的影响。参菊洗剂的抗过敏作用可能与抑制T淋巴细胞,从而增强对超敏反应的耐受能力有关。
表4 参菊洗剂小鼠口服给药急性毒性实验对小鼠体重的影响.±s,n=10Tab 4 Effect of acute toxicity test of Shenju lotion on oral administration of mice on body weight of mice.±s,n=10
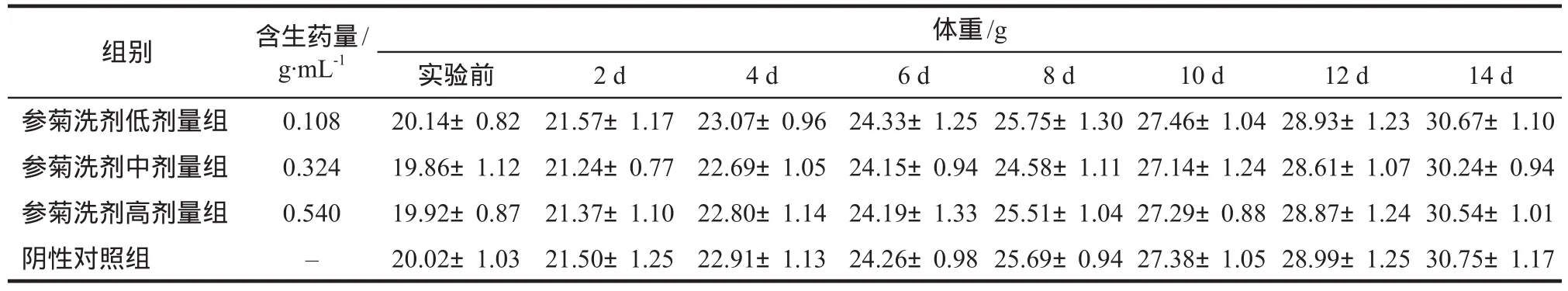
表4 参菊洗剂小鼠口服给药急性毒性实验对小鼠体重的影响.±s,n=10Tab 4 Effect of acute toxicity test of Shenju lotion on oral administration of mice on body weight of mice.±s,n=10
体重/g实验前 2 d 4 d 6 d 8 d 10 d 12 d 14 d参菊洗剂低剂量组 0.108 20.14±0.82 21.57±1.17 23.07±0.96 24.33±1.25 25.75±1.30 27.46±1.04 28.93±1.23 30.67±1.10参菊洗剂中剂量组 0.324 19.86±1.12 21.24±0.77 22.69±1.05 24.15±0.94 24.58±1.11 27.14±1.24 28.61±1.07 30.24±0.94参菊洗剂高剂量组 0.540 19.92±0.87 21.37±1.10 22.80±1.14 24.19±1.33 25.51±1.04 27.29±0.88 28.87±1.24 30.54±1.01阴性对照组 – 20.02±1.03 21.50±1.25 22.91±1.13 24.26±0.98 25.69±0.94 27.38±1.05 28.99±1.25 30.75±1.17组别 含生药量/g·mL-1
表5 参菊洗剂口服给药急性毒性实验对小鼠主要器官脏器指数的影响.±s,n=10Tab 5 Effect of acute oral toxicity test of Shenju lotion on organ index of mice.±s,n=10
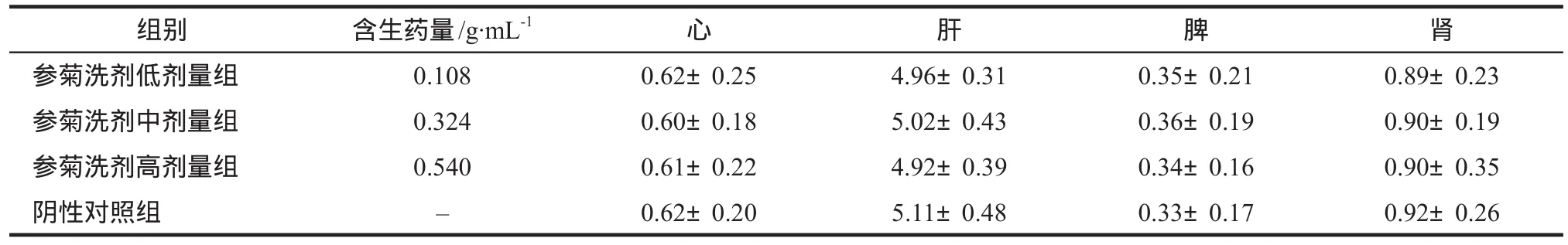
表5 参菊洗剂口服给药急性毒性实验对小鼠主要器官脏器指数的影响.±s,n=10Tab 5 Effect of acute oral toxicity test of Shenju lotion on organ index of mice.±s,n=10
组别 含生药量/g·mL-1 心 肝 脾 肾参菊洗剂低剂量组 0.108 0.62±0.25 4.96±0.31 0.35±0.21 0.89±0.23参菊洗剂中剂量组 0.324 0.60±0.18 5.02±0.43 0.36±0.19 0.90±0.19参菊洗剂高剂量组 0.540 0.61±0.22 4.92±0.39 0.34±0.16 0.90±0.35阴性对照组 – 0.62±0.20 5.11±0.48 0.33±0.17 0.92±0.26
4.3 参菊洗剂止痒作用机制
右旋糖酐是高分子葡萄糖聚合物,是多糖化合物中促组胺释放作用最强的物质,注射后引起肥大细胞释放组胺从而诱发炎性反应,使小鼠产生皮肤瘙痒[9]。引起瘙痒的物质基础已经阐明,前列腺素E2,组胺,5-羟色胺,白细胞介素(IL)2、1、31等,都是瘙痒直接或间接的诱导因素,可诱发瘙痒的发生和发展[10]。
SOD是机体内重要的内源性抗氧化酶,能高效催化超氧化物自由基分解,抑制脂质过氧化,清除氧自由基,从而对抗氧化应激反应[11],有效抵抗氧自由基对机体的伤害。SOD活力的高低,可间接反映出机体清除氧自由基的能力[12]。SOD不仅具有显著的止痒作用,而且对抗组胺药产生耐药性的瘙痒也有显著的治疗作用[13]。大量的自由基引起脂质过氧化,MDA为多不饱和脂肪酸过氧化物的降解产物,测定MDA水平可反映机体内脂质过氧化及细胞受自由基攻击的程度。TNF-α是由单核-巨噬细胞及T淋巴细胞产生的重要炎症因子,TNF-α不仅介导炎症反应,同时还可以诱导IL-1β、IL-6等炎症因子的产生,参与全身或局部炎症反应。SOD可下调TNF-α、IL-1、IL-2、IL-22、IL-31等炎症因子的水平[14-15],抑制炎症因子的合成与释放,对各种原因引起的瘙痒有直接或间接的作用。本研究通过测定右旋糖酐致炎小鼠血清的SOD、MDA、TNF-α等炎症因子水平,探讨了参菊洗剂的止痒作用机制,可能与抑制脂质过氧化及清除自由基、抑制炎症因子的合成与释放有关。
