苯甲酰芍药苷增强ABCA1表达促进胆固醇流出
2020-05-25陈晓佳唐菀泽马卫列丁航张志珍
陈晓佳 唐菀泽 马卫列 丁航 张志珍

[摘要] 目的 探讨白芍醇提物苯甲酰芍药苷(BP)对THP-1细胞胆固醇流出的影响。 方法 实验分ac-LDL组、apoA-1组和apoA-1+BP组。THP-1细胞加入160 nmol/L佛波酯(PMA)24 h,再加入50 μg/mL乙酰化低密度脂蛋白(ac-LDL)建立泡沫细胞模型。液体闪烁计数法测定泡沫细胞胆固醇流出率;酶化学反应检测细胞总胆固醇浓度;定量PCR(qPCR)检测三磷酸腺苷结合盒转运体 A1(ABCA1)表达;Western blot分析ABCA1、固醇调节元件结合蛋白(SREBPs)、肝X受体α(LXRα)蛋白表达变化。 结果 成功建立THP-1泡沫细胞模型。apoA-1+BP組泡沫细胞胆固醇流出率高于apoA-1组,差异有高度统计学意义(P < 0.01)。apoA-1+BP组泡沫细胞内总胆固醇含量低于apoA-1组,差异有高度统计学意义(P < 0.01)。apoA-1+BP组泡沫细胞ABCA1 mRNA和蛋白表达量均高于apoA-1组,差异有统计学意义(P < 0.05或P < 0.01)。apoA-1+BP组泡沫细胞LXRα蛋白表达水平高于apoA-1组,差异有高度统计学意义(P < 0.01)。apoA-1+BP组 SREBP1、SREBP2蛋白表达量低于apoA-1 组,差异有高度统计学意义(P < 0.01)。 结论 BP可通过LXRα-ABCA1通路促进胆固醇流出。
[关键词] 苯甲酰芍药苷;胆固醇流出;泡沫细胞
[中图分类号] R282;Q54 [文献标识码] A [文章编号] 1673-7210(2020)04(a)-0008-05
Benzoylpaeoniflorin promote cholesterol efflux by enhancing ABCA1 expression
CHEN Xiaojia1 TANG Wanze2 MA Weilie1 DING Hang1 ZHANG Zhizhen1
1.School of Basic Medicine, Guangdong Medical University, Guangdong Province, Dongguan 523808, China; 2.Department of Spine Surgery, Shenzhen People′s Hospital Shenzhen Institute for Orthopaedic Research, Guangdong Province, Shenzhen 518020, China
[Abstract] Objective To investigate the effect of Benzoylpaeoniflorin (BP) on cholesterol efflux from THP-1 cells. Methods The experiment was divided into ac-LDL group, apoA-1 group and apoA-1+BP group. The model of foam cells was established by adding 160 nmol/L phorbol-1-myristate-13-acetate (PMA) for 24 h in THP-1 cells, followed by 50 μg/mL acetylated low-density lipoprotein (ac-LDL). The foam cells cholesterol efflux rate was determined using liquid scintillation counting, the contents of total cholesterol of foam cells were observed by enzymatic reaction method. adenosine triphosphate binding cassette transporter A1(ABCA1) mRNA expression was detected by quantitative polymerase chain reaction (qPCR). The expression of ABCA1, sterol regulated original binding proteins(SREBPs)and Liver X receptor alpha (LXRα) were analyzed by Western blot. Results THP-1 cell model was successfully established. Cholesterol efflux of foam cells in apoA-1+BP group was higher than that in apoA-1 group, and the difference was highly statistically significant (P < 0.01). The total cholesterol content of foam cells in apoA-1+BP group were lower than those in apoA-1 group, and difference was highly statistically significant (P < 0.01). The mRNA and protein levels of ABCA1 in apoA-1+BP group were higher than those in apoA-1 group, and the difference was statistically significant (P < 0.05 or P < 0.01). The expression levels of LXRα in apoA-1+BP group were higher than those in apoA-1 group, and the difference was highly statistically significant (P < 0.01). The SREBP1 and SREBP2 expression levels in apoA-1+BP group were lower than those in apoA-1 group, and the difference was highly statistically significant (P < 0.01). Conclusion BP can promote cholesterol efflux through the LXRα-ABCA1 pathway.
[Key words] Benzoylpaeoniflorin; Cholesterol efflux; Foam cells
心血管病(cardiovascular disease,CVD)在我国呈逐年上升趋势,中国CVD现患病人数约2.9亿[1]。动脉粥样硬化(atherosclerosis,AS)是CVD的主要致病原因[2]。AS主要是巨噬细胞和动脉壁平滑肌细胞过多的胆固醇累积导致细胞泡沫化,促进细胞内过量胆固醇流出是预防和治疗AS的有效策略[3-4]。目前临床上使用的促胆固醇流出药物存在一定的毒副作用,如肝毒性、横纹肌溶解等[5-6]。我国中医中药博大精深,近年来越来越多促胆固醇流出的中药活性成分被分离和鉴定[7]。细胞胆固醇流出主要与血浆中高密度脂蛋白胆固醇(HDL-C)有关,载脂蛋白A-1(apoA-1)是HDL-C的主要成分和功能执行者,胞内胆固醇通过ABCA1运载到细胞膜,与apoA-1相互作用,促进胆固醇的流出[8-9]。固醇调节元件结合蛋白(SREBPs)是核转录因子,可调节胆固醇及三酰甘油代谢,对维持胞内胆固醇平衡起关键作用[10]。肝X受体α(LXRα)是一种核受体,可影响下游基因三磷酸腺苷结合盒转运体A1(ABCA1)、SREBPs等的表达,调节细胞内胆固醇的平衡[11]。课题组前期研究发现,白芍提取物可增强泡沫细胞胆固醇的流出能力。故选用白芍醇提物苯甲酰芍药苷(BP)研究其影响THP-1泡沫细胞胆固醇流出的机制,为BP治疗AS提供理论依据。
1 对象与方法
1.1 试验材料
THP-1细胞由中南大学细胞中心提供。
1.2 药物与试剂
BP(北京欣荣科技有限公司,批号:B20170912);血清(Corning,批号:F160809-27);佛波酯(PMA)(Promega,批号:P20181029);乙酰化低密度脂蛋白(ac-LDL)(Biochemical Techologies,批号:L20180312);apoA-1(Sigma,批号:A180516J);兔抗ABCA1抗体(Sigma,批号:A160523T);[3H]-胆固醇(PerkinElmer,批号:H0182796)、兔一抗肝X受体α(LXRα)、SREBP1、SREBP2(Abcam公司);兔一抗GAPDH抗体(Thermo Scientific,批号:TJ168764B);辣根过氧化物酶(HRP)标记山羊抗兔二抗(安徽经科生物科技有限公司,批号:J20170810);Trizol试剂(Invitrogen,批号:17A0515J);逆转录及qPCR试剂(大连宝生物工程有限公司,批号:R20170613);总胆固醇试剂盒(普利莱基因有限公司,批号:TC20160924);BCA测定试剂盒(碧云天生物科技有限公司,批号:20180213)。
1.3 细胞模型建立与分组
THP-1细胞在10%血清RPMI 1640培养基中培养(37℃、5%CO2)。将细胞传代至6孔板,密度为2×106个/孔,加入PMA,使每孔终浓度为160 nmol/L,培养24 h,待THP-1细胞贴壁,移去含PMA培养基,加入并使其终浓度为0.2% BSA和50 μg/mL ac-LDL,培养48 h后,贴壁的THP-1细胞即可分化为泡沫细胞。本实验分为ac-LDL组、apoA-1组和BP+apoA-1组。
1.4 观察指标
1.4.1 胆固醇流出率比较测定 THP-1细胞接种到24孔板,密度为4×105个/孔,PMA诱导贴壁24 h;加入[3H]-胆固醇(终浓度为0.2 μCi/mL)和ac-LDL(终浓度为50 μg/mL),培养48 h,构建泡沫细胞模型,即ac-LDL组。apoA-1组,每孔加入500 μL含apoA-1的1640培养基(终浓度为 10 μg/mL),继续培养24 h;apoA-1+BP组,加入apoA-1的同时,加入200 μg/mL BP作用24 h。收集每孔培养基,-20℃保存。每孔加入0.1 mol/L NaOH溶液500 μL,室温静置5 min,收集细胞裂解液,-20℃保存。[3H]-胆固醇放射强度用液体闪烁计数法测定,放射强度以cpm值计算(cpm值为[3H]-胆固醇放射强度即每分钟闪烁的次数)。胆固醇流出率(%)=培养基cpm/(細胞裂解液cpm+培养基cpm)×100%。所有实验均重复3次。
1.4.2 泡沫细胞总胆固醇浓度测定 PBS清洗各组细胞3次,收取细胞。总胆固醇试剂盒裂解液冰上裂解10 min,5000 r/min离心5 min,离心半径16 cm,取上清,分别进行总胆固醇含量测定,操作见试剂盒说明书。BCA法测定蛋白含量,以每克蛋白浓度对总胆固醇含量进行校正[μmol/(g·pro)]。
1.4.3 荧光定量PCR(qPCR)分析 收取各组细胞,按Trizol试剂说明书提取总RNA,以RNA为模板逆转录合成cDNA,qPCR试剂盒进行定量PCR分析,按试剂盒说明书操作。ABCA1-F:5′-TGCCAGAGTTATTAG-TGCCAAGT-3′,ABCA1-R:5′-GGGAATCAAAGCAG-GATGTTAG-3′;GADPH-F:5′-GTCCTGACTCACAG-CG-3′,GADPH-R:5′-ACACTGTGCTAGCAA-3′。
1.4.4 Western blot分析 THP-1细胞接种6孔板(2×106个/孔),按照说明书冰上裂解细胞并收取蛋白。在12%的分离胶进行SDS-PAGE电泳后,蛋白转移至PVDF膜上,分别加入兔抗ABCA1抗体(1∶500)、LXRα抗体(1∶500)、SREBP1抗体(1∶1000)、SREBP2抗体(1∶1000),放于4℃冰箱中12 h,PBST清洗3次后用HRP标记的二抗结合2 h,显影剂显影。
1.5统计学方法
采用Grphad Prime 6.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 三组泡沫细胞胆固醇流出率比较
三组胆固醇流出率比较,差异有高度统计学意义(P < 0.01)。apoA-1+BP组泡沫细胞胆固醇流出率高于apoA-1组,apoA-1组泡沫细胞胆固醇流出率高于ac-LDL组,差异均有高度统计学意义(均P < 0.01)。见图1。
与ac-LDL组比较,###P < 0.001;与apoA-1组比较,**P < 0.01。ac-LDL:乙酰化低密度脂蛋白;BP:苯甲酰芍药苷
图1 三组泡沫细胞胆固醇流出率比较(n = 3)
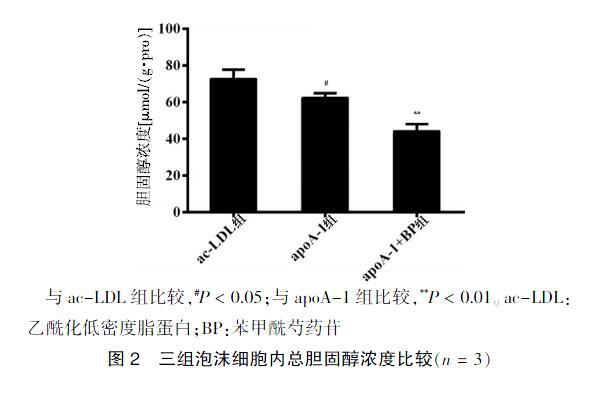
2.2 三组泡沫细胞内总胆固醇浓度比较
ac-LDL组泡沫细胞内总胆固醇含量为(72.772±4.938)μmol/(g·pro),apoA-1组泡沫细胞内总胆固醇含量为(62.421±2.444)μmol/(g·pro),apoA-1+BP组总胆固醇含量为(44.205±3.867)μmol/(g·pro)。
apoA-1组泡沫细胞内总胆固醇含量低于ac-LDL组,差异有统计学意义(P < 0.05)。apoA-1+BP组总胆固醇含量低于apoA-1组,差异有高度统计学意义(P < 0.01)。见图2。
与ac-LDL组比较,#P < 0.05;与apoA-1组比较,**P < 0.01。ac-LDL:乙酰化低密度脂蛋白;BP:苯甲酰芍药苷
图2 三组泡沫细胞内总胆固醇浓度比较(n = 3)
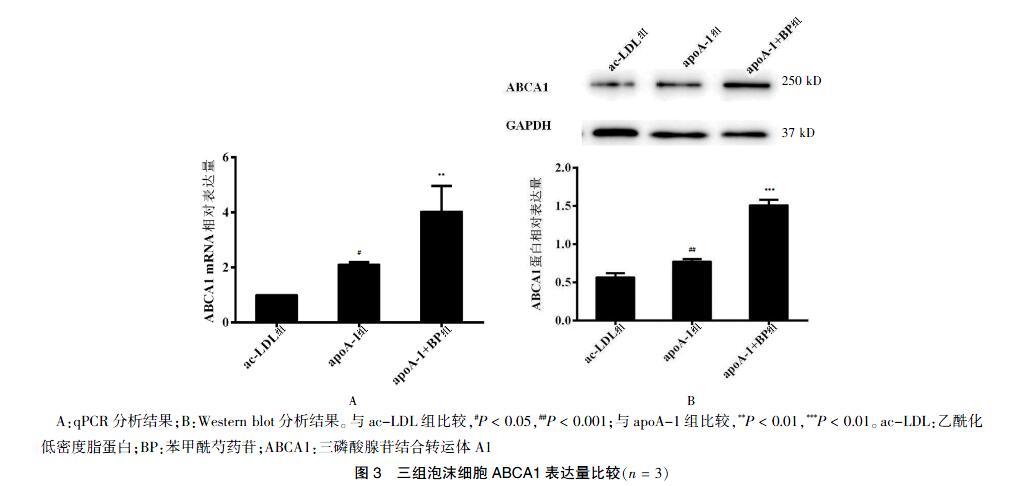
2.3 三组泡沫细胞ABCA1表达量比较
apoA-1+BP组泡沫细胞ABCA1 mRNA表达量比apoA-1组升高91.3%,apoA-1+BP组ABCA1蛋白表达量比apoA-1 组升高73.8%。
apoA-1+BP组ABCA1 mRNA、蛋白相对表达量高于apoA-1组,apoA-1组ABCA1 mRNA、蛋白表达量高于ac-LDL组,差异均有统计学意义(P < 0.05或P < 0.01)。见图3。
2.4 三组泡沫细胞LXRα蛋白表达水平比较
apoA-1+BP组LXRα蛋白表达水平高于apoA-1组,apoA-1组LXRα蛋白表达水平高于ac-LDL组,差异均有高度统计学意义(均P < 0.01)。见图4。
2.5 三组泡沫细胞SREBPs蛋白表达水平比较
apoA-1+BP组SREBP1蛋白的表达水平比apoA-1组降低了27.7%,SREBP2蛋白表达水平比apoA-1组降低了56.2%。
apoA-1+BP组SREBP1、SREBP2蛋白的表达水平低于apoA-1组,apoA-1组SREBP1、SREBP2蛋白的表达水平低于ac-LDL组,差异均有高度统计学意义(均P < 0.01)。见图5。
3 讨论
AS是CVD发生发展的重要病理基础,CVD防治的关键在于防治AS。提高HDL-C转运胆固醇的能力,可促进胆固醇流出、抑制胆固醇合成,已成为目前防治AS的主要靶点[12],中药提取物防治AS活性成分已成为近年的研究热点。中医认为白芍有活血化瘀功效,有抗AS作用。白芍的主要成分有氧化芍药苷、苯甲酰芍药苷、芍药内酯苷及芍药苷等[13]。以芍药为材料研发的白芍总苷胶囊和芍药总苷胶囊已经在临床上广泛使用[14]。刘月丽等[15]研究发现白芍总苷可以降低脂肪肝模型鼠肝脏脂肪累积,保护肝功能。但目前尚未有针对白芍总苷单一单体抗AS分子机制的研究,本课题组前期实验已经证实,氧化芍药苷可升高过氧化物酶体增殖物激活受体α(PPARα)表达,PPARα上调下游基因ABCA1,进而促进泡沫细胞胆固醇流出[16]。
ABCA1是LXRα的下游基因,激活LXRα,增加ABCA1的表达[17]。ABCA1与apoA-1相互作用,将细胞内过多的胆固醇运到细胞外,调控细胞内总胆固醇的平衡[18]。本研究结果显示,apoA-1+BP组胆固醇流出率高于apoA-1组,总胆固醇含量低于apoA-1组。
本研究结果显示apoA-1+BP组ABCA1 mRNA和蛋白表达量均高于apoA-1组,提示BP通过上调ABCA1的表达促进胆固醇流出。ABCA1是细胞内胆固醇流出的“调速器”[19],转录、翻译和加工等受到上游转录因子LXRα的调节。本研究结果显示,apoA-1+BP组LXRα蛋白的表达水平高于apoA-1组,提示BP通过LXRα-ABCA1通路促进胆固醇流出。
有研究[20-21]报道,中药活性物可下调SREBPs的表达,降低细胞内胆固醇浓度。前期实验结果显示[22],中药穿龙薯蓣提取物甲基薯蓣皂苷元可抑制SREBPs表达,减少细胞内miRNA33a/b含量,提高ABCA1的转录和翻译,增强胆固醇流出能力。
综上所述,apoA-1+BP组SREBP1、SREBP2蛋白相对表达量分别比apoA-1组有明显下降趋势,提示BP能够抑制泡沫细胞SREBPs的表达,而BP抑制SREBPs表達的机制需在后续试验中研究。
[参考文献]
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2017》概要[J].中国循环杂志,2018,33(11):1-8.
[2] Varghese C,Onuma O,Johnson W,et al. Organizational update:World Health Organization [J]. Stroke,2017,48(12):e341-e342.
[3] Kingwell BA,Chapman MJ,Kontush A,et al. HDL-targeted therapies:progress,failures and future [J]. Nat Rev Drug Discov,2014,13(6):445-464.
[4] Siddiqi HK,Kiss D,Rader D. HDL-cholesterol and cardiovascular disease:rethinking our approach [J]. Curr Opin Cardiol,2015,30(5):536-542.
[5] Shimizu T,Miura SI,Tanigawa H,et al. Rosuvastatin activates ATP-binding cassette transporter A1-dependent efflux ex vivo and promotes reverse cholesterol transport in macrophage cells in mice fed a high-fat diet [J]. Arterioscl Throm Vas Biol,2014,34(10):2246-2253.
[6] Morgan JM,Llera-Moya MDL,Capuzzi DM. Effects of niacin and Niaspan on HDL lipoprotein cellular SR-BI-mediated cholesterol efflux [J]. J Clin Lipidol,2007,1(6):614-619.
[7] Qiao L,Chen W. Atheroprotective effects and molecular targets of bioactive compounds from traditional Chinese medicine [J]. Pharmacol Res,2018,135:212-229.
[8] Hutchins PM,Heinecke JW. Cholesterol efflux capacity,macrophage reverse cholesterol transport and cardioprotective HDL [J]. Curr Opin Lipidol,2015,26(5):388-393.
[9] Mei X,Atkinson D. Lipid-free apolipoprotein A-I structure:insights into HDL formation and atherosclerosis development [J]. Arch Med Res,2015,46(5):351-360.
[10] Shimano H,Sato R. SREBP-regulated lipid metabolism:convergent physiology-divergent pathophysiology [J]. Nat Rev Endocrinol,2017,13(12):710-730.
[11] Guo S,Li Y,Yi H. Cholesterol homeostasis and Liver X receptor(LXR)in atherosclerosis [J]. Cardiovasc Hematol Disord Drug Targets,2018,18(1):27-33.
[12] Talbot CPJ,Plat J,Ritsch A,et al. Determinants of cholesterol efflux capacity in humans [J]. Prog Lipid Res,2018, 69:21-32.
[13] 吴金雄.白芍、赤芍化学成分与活血功效的比较研究[D].广州:广州中医药大学,2012.
[14] 王巧,刘荣霞,毕开顺,等.HPLC法测定白芍总苷胶囊中芍药内酯苷、芍药苷和苯甲酰芍药苷[J].中草药,2005(11):1630-1632.
[15] 刘月丽,吕俊华.白芍总苷的降血脂、抗氧化作用及其对脂肪肝的防治研究[J].海南医学院学报,2012,18(2):158-161.
[16] 唐菀泽,马卫列,丁航,等.氧化芍药苷对泡沫细胞胆固醇流出的影响[J].中国现代医学杂志,2017,27(16):6-11.
[17] Wan YJ,An D,Cai Y,et al. Hepatocyte-Specific Mutation Establishes Retinoid X Receptor alpha as a Heterodimeric Integrator of Multiple Physiological Processes in the Liver [J]. Mol Cell Biol,2000,20(12):4436-4444.
[18] Kellner-Weibel G,Luke SJ,Rothblat GH. Cytotoxic cellular cholesterol is selectively removed by apoA-I via ABCA1 [J]. Atherosclerosis,2003,171(2):235-243.
[19] Van Eck M. ATP-binding cassette transporter A1:key player in cardiovascular and metabolic disease at local and systemic level [J]. Curr Opin Lipidol,2014,25(4):297-303.
[20] Hoang MH,Jia Y,Mok B,et al. Kaempferol ameliorates symptoms of metabolic syndrome by regulating activities of liver X receptor-β [J]. J Nutr Biochem,2015,26(8):868-875.
[21] Tang JJ,Li JG,Qi W,et al. Inhibition of SREBP by a small molecule,betulin,improves hyperlipidemia and insulin resistance and reduces atherosclerotic plaques [J]. Cell Metab,2011,13(1):44-56.
[22] Ma W,Ding H,Gong X,et al. Methyl protodioscin increases ABCA1 expression and cholesterol efflux while inhibiting gene expressions for synthesis of cholesterol and triglycerides by suppressing SREBP transcription and microRNA 33a/b levels [J]. Atherosclerosis,2015, 239(2):566-570.
(收稿日期:2019-11-21 本文編辑:刘明玉)
