杂交链式反应技术结合纳米材料用于核酸检测的研究进展
2020-05-23刘永新
刘永新,袁 旦,陈 沁,钮 冰
(上海大学生命科学学院,上海 200444)
1 前 言
2004年Dirks和Pierce首次提出了一种体外恒温扩增技术,即杂交链式反应(HCR)[1]。HCR的反应过程不需任何核酸工具酶的参与,且在室温下便可进行,此外,这种信号扩增技术与各类检测技术如荧光法、比色法和电化学法等都具有较高的兼容性,因而在生物传感领域的DNA、miRNA、蛋白质以及金属离子的检测[2-7]中得到了广泛关注。
纳米尺寸的材料会表现出一些独特的性质,例如表面效应、体积效应、量子尺寸效应、介电限域效应等。因此,将HCR与纳米材料结合,极大程度地提高了靶标DNA、miRNA、蛋白质以及金属离子的检测灵敏度,使之甚至可以达到单分子检测水平。尤其是在核酸检测方面,与传统核酸检测方法(如:PCR、荧光RT-PCR)相比,这种将HCR与纳米材料结合的方法不仅可以在常温下进行,反应过程不需要酶的参与,而且能够实现可视化检测,检测限低至飞摩尔水平,并能有效缩短检测时间,适合于在现场和实验条件较简单的实验室进行快捷检测。本文将具体讨论HCR与几种常见的纳米材料(银纳米颗粒、金纳米颗粒、氧化石墨烯及其他几种金属纳米材料)结合在核酸检测方面的研究进展。
2 杂交链式反应(HCR)的原理
HCR反应系统包括两个可杂交互补并带有粘性末端的DNA发夹探针(H1和H2),以及单链DNA(ssDNA)引发剂。在ssDNA(引发剂)诱发下,这两个发夹探针会自组装形成长的双链DNA(dsDNA)产物。具体过程如图1所示:亚稳态的H1和H2在水溶液中共存时并不发生任何反应,但当引入引发剂时,引发剂会激活并打开第一个发夹探针H1的茎环结构,随后,这个打开的H1会立即与第二个发夹探针H2杂交并打开H2的茎环结构,从而形成带有ssDNA粘性末端的dsDNA,这又导致了另一个H1发夹探针的打开并且诱发HCR整个过程的延续,最终产生长的dsDNA产物。这个过程会持续进行直到这两个发夹探针消耗殆尽或者形成的dsDNA产物的浓度达到阈值。

图1 杂交链式反应的原理示意图Fig.1 Schematic diagram of hybrid chain reaction
3 HCR与纳米材料结合的应用
3.1 与银纳米颗粒(AgNPs)的结合
银纳米材料具有优良的导电导热性能和稳定的化学性质,特别是银纳米颗粒(AgNPs)具有表面等离子体共振效应,可以增强表面拉曼散射、表面荧光和催化活性。同时,由于AgNPs具有良好的生物活性和生物相容性,因而被广泛应用于生物医药领域,如用作某些生物蛋白分子和药物载体。由于介入的AgNPs还可以增强蛋白酶的催化能力,且其性质接近天然生物组织,不会对人体产生毒副作用,所以细胞可以在其表面生长,从而修复病变组织。AgNPs还具有良好的抑菌效果,Bryaskova等的研究表明,当使用AgNPs对金黄色葡萄球菌、大肠杆菌以及铜绿假单胞菌进行抑菌检测时,AgNPs的浓度显著影响抑菌效果,而且浓度越高,抑菌效果越好,在0.4%时达到最好的抑菌效果[8]。
3.1.1 HCR与AgNPs结合的比色检测法
近年来,基于金属纳米颗粒的比色测定方法由于其便于观察以及制备过程简单的优点而备受关注[9]。在金属纳米粒子中,AgNPs常被用于比色检测,相较于AuNPs,AgNPs表现出一定程度的优势:具有更高的摩尔吸光系数、具有优异的光学性质、易于观察其分散状态和聚集状态之间的颜色转换[10, 11]。近年来,不同的AgNPs合成和修饰方法被发展起来用于核酸的微量检测。例如,Guo等[12]设计了等离子体比色法,在酶的诱导下,AgNPs会在等离子体金纳米星(AuNS)上生长,导致AuNS的颜色从蓝色变为深蓝色,再变为紫色,最终达到橙色。当以DNA为靶分子进行HCR后,可得DNA的检测范围从1×10-14到5×10-11mol/L,检测限为2.6×10-15mol/L。
这种比色方法不仅可以用于检测DNA,也可以实现对miRNA的检测。Miao等[13]提出了一种基于HCR介导从而引起AgNPs局部表面等离子体共振(LSPR)发生改变的方法,用来检测流感病毒H1N1的生物标志物miRNA-29a-3p,并将这种新型比色分析方法用于临床诊断,如图2所示。在这项研究中,阻滞剂DNA被固定在金固体表面,并与另一个HP0探针部分杂交,之后将金固体表面浸入到含有两个DNA探针HP1和HP2以及AgNPs的胶体系统中,该系统中的HP1和HP2可稳定AgNPs的状态,使其不受二价阳离子的诱导聚集。当引入靶标miRNA-29a-3p时,该miRNA引发链置换反应,释放HP0到溶液中,进而触发HCR。此时,由于缺乏HP1和HP2,AgNPs发生聚集,并随着miRNA浓度的增加,AgNPs胶体系统颜色由金黄色逐渐变淡。这种简单设计的用于miRNA检测的方法达到了1×10-12mol/L的检测限。
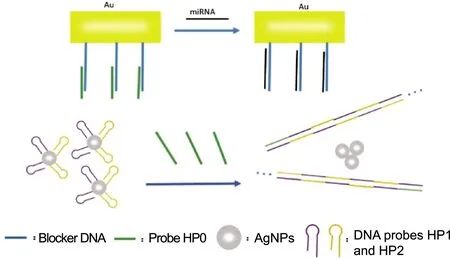
图2 基于HCR与AgNPs的用于miRNA分析的比色策略Fig.2 Colorimetric strategy for miRNA analysis based on HCR and AgNPs
3.1.2 HCR与AgNPs结合的电化学检测法
为了制造便携且价格合理的诊断装置,全世界在开发和改进金属生物检测方面做出了大量努力。基于新型纳米材料构建的电化学生物传感器,由于其制备方法简单、灵敏度高、响应速度快和成本低等优点被广泛应用于食品、制药、环境监测、生物医药等方面。AgNPs具有较强的电化学性质,如低氧化还原电位、清晰的伏安峰和优异的电子传递速率[14, 15]。因此,基于AgNPs的生物分析被认为是检测低浓度分析物的一种有效方法。Zhuang等[16]设计了一种新型无标记金属生物电化学法,并将其用于超敏感检测人类免疫缺陷病毒(HIV)相关基因片段。这种方法是基于靶触发的远程自组装DNA纳米结构和DNA杂交链式反应,首先在传感器上固定捕获探针,然后加入目标DNA以及含有引发链的检测探针,由于碱基互补配对作用,捕获探针、目标DNA以及检测探针之间形成三明治式结构,检测探针中的引发链在两个不同的DNA发夹之间触发串级杂交事件,产生类似交变共聚物的刻痕双螺旋。带负电荷的DNA聚合物可以远距离吸附DNA结构上带正电荷的金属银纳米标签,通过监测电流的变化,从而间接得到该传感器可检测到的DNA的浓度范围为1×10-15到1×10-14mol/L,检测限为5×10-16mol/L。
电化学生物传感器同样适用于miRNA的快速、灵敏、选择性检测。Miao等[17]设计了具有识别发夹的四面体DNA,并将其固定在金电极上。四面体结构可以增加可接近性和反应性,并避免引入间隔分子。靶miRNA可以打开四面体DNA上的发夹,然后发夹上释放的茎序列与AuNPs表面上的HCR-H0杂交并在电极上募集纳米颗粒,游离的HCR-H0进一步与已被AgNPs标记的HCR-H1和HCR-H2发生HCR。这样,大量的AgNPs被连接到电极上,通过检测和分析来自AgNPs的剥离电流峰值,大大提高miRNA的检测灵敏度,线性范围从1×10-16到1×10-10mol/L,且检测限为2×10-18mol/L。另外,该研究还检测了人脐静脉内皮细胞(HUVEC)、人宫颈癌细胞(HeLa)、人肾小管上皮细胞(HK-2)和人乳腺癌细胞(MCF-7)这几种细胞的裂解物中的miRNA-21,进一步证明了该方法的准确性与实用性。
3.2 与金纳米颗粒(AuNPs)的结合
AuNPs是直径为0.8~250 nm的缔合胶体,胶体金颗粒一共分为3层,最外层离子使金溶液由于静电作用而处于悬浮稳定的胶体状态,形成带负电的水溶胶。AuNPs具有毒性低、生物相容性强、独特的光学性质以及易于表面修饰等优点,而且能够精确控制其粒径、形状和表面性能[18]。基于AuNPs制备而成的多功能新型材料已被广泛应用于食品安全检测、环境安全监测和医学检测分析等领域。此外,使用AuNPs进行敏感性检测的器件,可以开发出不同的生物传感器,实现对金属离子[19]、分子[20]、蛋白质[21]、核酸[22, 23]等生物靶标的高效检测。
在纳米材料中,AuNPs在20世纪70年代就已作为信号标记分子应用于生物学领域,其主要标记对象是蛋白质和核酸。Faulk等[24]于1971年建立了一种电镜免疫技术,首次实现了AuNPs标记技术与免疫技术的融合,该技术将蛋白质与AuNPs结合,并通过免疫学反应对细菌进行检测。之后,Mirkin等[25]于1996年首次将AuNPs应用于核酸检测,将AuNPs与巯基修饰的寡核苷酸片段结合用于制备一种核酸比色探针,通过比色分析AuNPs溶液颜色的变化实现对特定核苷酸序列的检测。
3.2.1 基于比色策略的核酸检测
在比色生物传感器中,AuNPs以其独特的性质,如光学、化学以及尺寸依赖的物理性质而引起了极大的关注。由于溶液中AuNPs的聚集过程,使溶液颜色从酒红色变为蓝色,而AuNPs的解聚过程又会使溶液从蓝色变回酒红色。基于这种可逆的颜色变化[26],将AuNPs与HCR进行耦合,大量的比色生物传感器被设计出来用于检测不同的生物分子,如核酸[27]、蛋白质[28]、细胞表面的N-聚糖[29]等。Liu等[30]提出了一种将AuNPs的比色检测法与DNA杂交链式反应扩增相结合的检测系统。如图3所示,该检测系统包括发夹探针H1和H2、带负电的AuNPs、盐溶液。当引入靶标ssDNA时,靶DNA与发夹探针杂交并诱发HCR,形成带切口的双链DNA聚合物。这个长dsDNA暴露出其带负电的磷酸骨架,由于静电排斥作用,不能与带负电的AuNPs结合。此时,在检测体系中盐离子的诱导下,游离的AuNPs发生聚集,使得反应液颜色从浅酒红色变成蓝色,且肉眼检测的检测限是1×10-10mol/L。该检测系统具有一些突出的优点,如避免了酶的引入、在完全匹配的靶寡核苷酸和具有单碱基对错配的靶标之间表现出高度区分等,重点是通过目视检查或可见光吸收光谱法便可实现快速、半定量检测。
基于AuNPs的比色生物传感器也可用于miRNA的敏感性检测。Miao等[31]首次开发了一种基于正电荷AuNPs((+)AuNPs)析出的多功能、灵敏、无标签的miRNA-21检测传感器。利用miRNA-21作为引发剂诱发HCR,形成长的dsDNA聚合物,(+)AuNPs可以通过静电吸附作用结合到dsDNA表面,导致自身吸收光谱的下降并逐渐开始析出,然后可以直接利用UV-vis光谱法检测上清液中(+)AuNPs的浓度。该方法对miRNA的检测范围为2×10-11到1×10-8mol/L,检测限为6.8×10-12mol/L。此外,该实验还证明,在包含有盐、DNA、蛋白质和金属离子的混合系统中,(+)AuNPs比(-)AuNPs更稳定。这一证明不仅完善了该团队提出的上述检测方法,而且扩大了基于miRNA的传感检测范围,开发了(+)AuNPs的新应用。以miRNA作为靶标引起检测系统颜色变化的方法也可用于miRNA的定量检测,该团队将这一检测策略用于MCF-7、Hela和MCF-10A等细胞中miRNA-21浓度的检测。Li等[32]将用羧基修饰的磁珠(MNP)与两个彼此互补的DNA(DNA1和DNA2)连接,在加入miRNA-203后,DNA2释放并作为引发剂诱发已与AuNPs相连接的发夹探针H1和H2,并发生HCR,从而使得AuNPs彼此靠近并发生颜色的改变。随着miRNA-203浓度的增加,该系统由浅酒红色变为紫色,最后变为浅蓝色。该方法对靶miRNA的检测限为1×10-13mol/L,有效提高了miRNA的检测灵敏度。该团队还利用MCF-7作为实际样品进行了检测,发现这种策略对MCF-7表现出较高的有效性与实用性。Cao等[33]首次开发了一种基于自组装HCR的光声(PA)纳米探针,用于在乳腺肿瘤发生和化疗期间高度灵敏地原位检测miRNA-155,PA纳米探针实现了对miR-155的体外高灵敏度和选择性定量检测,检测限为2.5×10-10mol/L。
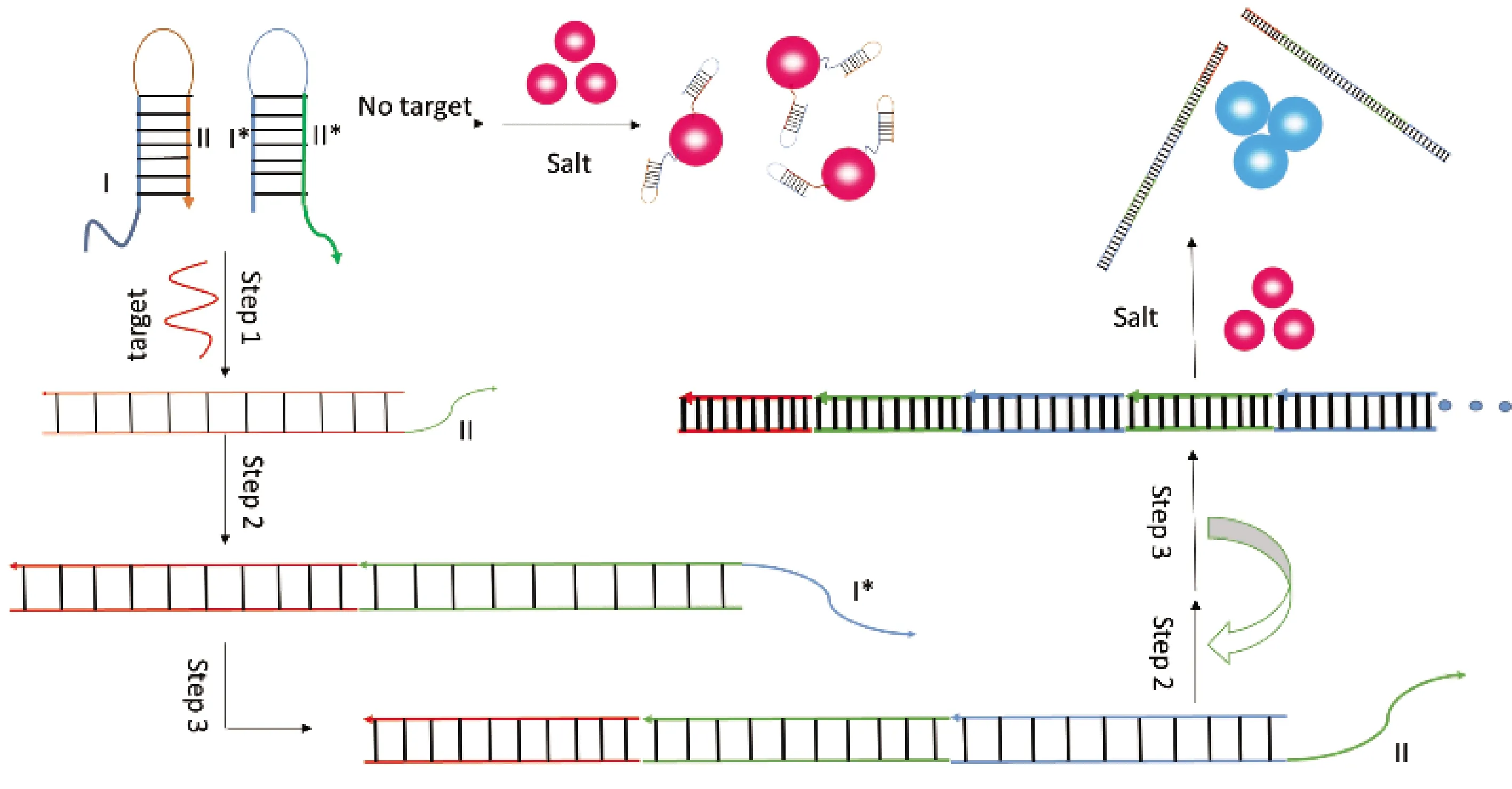
图3 基于HCR与AuNPs的比色核酸检测法示意图Fig.3 Schematic of colorimetric nucleic acid detection based on HCR and gold nanoparticles
3.2.2 基于荧光策略的核酸检测
AuNPs具有大的比表面积、易于表面功能化、在近红外到红外区域具有强的表面等离子吸收等特性,因而被作为荧光猝灭剂的一种[34],其在长波长范围内具有高的荧光猝灭效率并且可以同时猝灭多个荧光基团。利用AuNPs的荧光猝灭特性检测核酸的方法主要有两种:一种是纳米火焰法,即在AuNPs表面修饰一种能与靶标分子特异性识别的寡核苷酸(识别链),并与修饰有荧光基团的短链DNA(报告链)进行杂交,由于该短链DNA靠近AuNPs表面,荧光发生猝灭。在引入靶标核酸分子后,该核酸分子与识别链互补配对形成长而稳定的双链DNA,释放报告链并远离AuNPs,荧光恢复。通过荧光强度的变化能够检测靶标分子。另一种方法是将能特异性识别靶标分子且两端分别连接巯基与荧光基团的分子信标组装到AuNPs表面,此时,由于靠近AuNPs,荧光猝灭。当靶标分子存在时,它与分子信标杂交并打开其茎环结构,荧光基团远离AuNPs,出现荧光。
2015年,Zhan等[35]根据AuNPs的荧光猝灭特性,构建了一种基于HCR的荧光生物传感器用来灵敏性检测活体细胞mRNA。首先开发了一种新的静电组装的核酸纳米结构,该结构包括AuNPs核心、阳离子肽中间层以及分别被荧光受体基团和荧光供体基团标记的发夹DNA探针H1和H2组装的静电外层。由于AuNPs的有效猝灭,这两种荧光团产生非常弱的荧光信号。当该组装结构进入到细胞后,细胞中的mRNA作为引发剂诱发HCR,产生长的双链DNA,并从构建的纳米组件结构上解离下来。同时,在dsDNA形成过程中,荧光受体与荧光供体之间的距离拉近,发生荧光共振能量转移,产生荧光。该实验对mRNA的检测限达到5×10-13mol/L。这种基于纳米组件的HCR方法比标准HCR更快,有效提高了检测速度。且这种纳米组件具有优异的生物相容性,比三甲基化肽对AuNPs修饰的策略更加简单和低毒。
3.2.3 基于电化学策略的核酸检测
Wang等[36]提出了一种基于HCR和AuNPs扩增用于DNA检测的新型高灵敏度电化学发光生物传感器。该传感器灵敏度高、选择性与重复性好,而且能够达到5×10-15mol/L的检出限。2019年,Bao等[37]通过金纳米粒子/聚吡咯还原氧化石墨烯(Au/PPy-rGO),成功开发了一种灵敏、有效的电化学miRNA传感平台。该方法将催化发夹组装(CHA)和HCR组合起来,实现了靶向再循环以及信号的双重放大。同样对于检测miRNA,Zhang等[38]则将具有优异催化性能的ZnO纳米棒用做 Luminol-O2共反应促进剂,构建了一种用于超灵敏检测癌细胞中miRNA-21的生物传感器,该方法为以Luminol为中心的电化学发光(ECL)生物分析提供了一种有前景的策略。该传感器1×10-16至1×10-10mol/L表现出良好的线性,且检测限低至1.86×10-17mol/L。
3.2.4 基于成像策略的核酸检测
2015年,Jiang团队[36]开发了一种新型静电纳米组装结构,通过HCR进行活细胞中的信号放大。该团队使用暗场共振光散射成像对Hela细胞中的mRNA进行超灵敏荧光激活成像,实现了接近每个细胞的单个分子的检测限。2018年,Li等[39]设计了一种将AuNPs与HCR扩增相结合的检测体系,通过使用暗视野显微镜来实现超灵敏核酸比色测定。由于HCR扩增后形成的长而稳定的dsDNA无法吸附到AuNPs上,因此在盐离子的诱导下,游离的AuNPs发生聚集。通过测量暗场图像上黄色和红色点的强度变化,可以准确量化靶DNA的浓度,检测限为6.6×10-14mol/L。这种比色方法所得的检测限和线性范围要优于现有方法,而且不需要耗时对AuNPs进行修饰。
3.3 与氧化石墨烯(GO)的结合
氧化石墨烯(graphene oxide,GO)是1859年Brodie用强酸处理石墨后得到的一种石墨烯衍生物[40],它含有羧基、羟基、环氧基等含氧基团,具有电学性能优良、导热性好、力学强度高、比表面积大等特点[41-43]。近年来,GO由于制备成本低、易合成、以及良好的水溶性和生物相容性而被广泛用于DNA检测、重金属离子检测等方面,以及食品分析、生物成像、生物医学等领域[43, 44]。其中,生物活性分子的检测引起了研究者的极大兴趣,特别是利用GO-DNA的荧光传感器进行的各种分子检测。
在大多数荧光生物传感中,荧光共振能量转移起着重要的作用。荧光共振能量转移(FRET)是指当一个荧光基团(供体)的发射光谱与另一个荧光基团(受体)的吸收光谱具有一定的重叠,且距离比较近时,就会产生荧光能量从供体向受体转移的现象。GO在FRET过程中表现出优异的猝灭能力,所以当标记有荧光基团的单链DNA、dsDNA或发夹型DNA等吸附到GO基底时,由于荧光基团与GO距离较近,荧光被猝灭。当存在有靶标分子时,它能特异性识别探针,使得荧光基团远离GO表面,荧光恢复。
基于GO的荧光核酸检测法不仅操作简单,而且选择合适的荧光分子还能有效降低背景信号[45],这些荧光分子主要包括有机荧光染料和荧光纳米粒子两种。Zhang等[46]开发了一种基于银纳米团簇(AgNCs)与GO结合的通过HCR进行DNA检测的荧光生物传感器。如图4所示,首先在能够部分互补的发夹探针H1和H2的末端分别标记上AgNCs,在没有靶标分子(TDNA)时,由于H1与H2的稳定性,不能触发HCR。此时,由于发夹探针的另一游离端能够通过π-π堆积紧密吸附到GO表面,使得AgNCs靠近GO表面,荧光猝灭。但是在引入TDNA后,TDNA会与H1与H2发生HCR,产生多条长的dsDNA。这种dsDNA与GO的结合力比较弱,很容易从GO表面分离下来,进而能够产生较强的荧光信号。Zhang等在该实验方案中以人类免疫缺陷病病毒DNA(HIV-DNA)作为靶标分子,而且对HIV-DNA的检测限达到1.18×10-9mol/L,可用于临床样品。Yuan等[47]也利用GO的荧光猝灭特性设计了一种在同一个GO纸芯片上检测两种DNA(花生和大豆)并能有效区分其他DNA的方法,达到了1×10-9mol/L的检测限。这一检测方法不需要酶的参与,且纸芯片廉价、容易制备,有效缩短了检测时间,降低了检测成本。最近,Tang等[48]对HCR与GO结合的检测方案进行改进,提出了金黄色葡萄球菌的无酶荧光检测方法。该团队提出,协同使用FAM荧光基团和荧光染料SYBR Green I从而大幅增强扩增荧光信号,且在最佳条件下,对16SrRNA有更低的检测限,达5×10-11mol/L。该方法成功应用于牛奶中的金黄色葡萄球菌的检测,检出限为4×102CFU/mL。
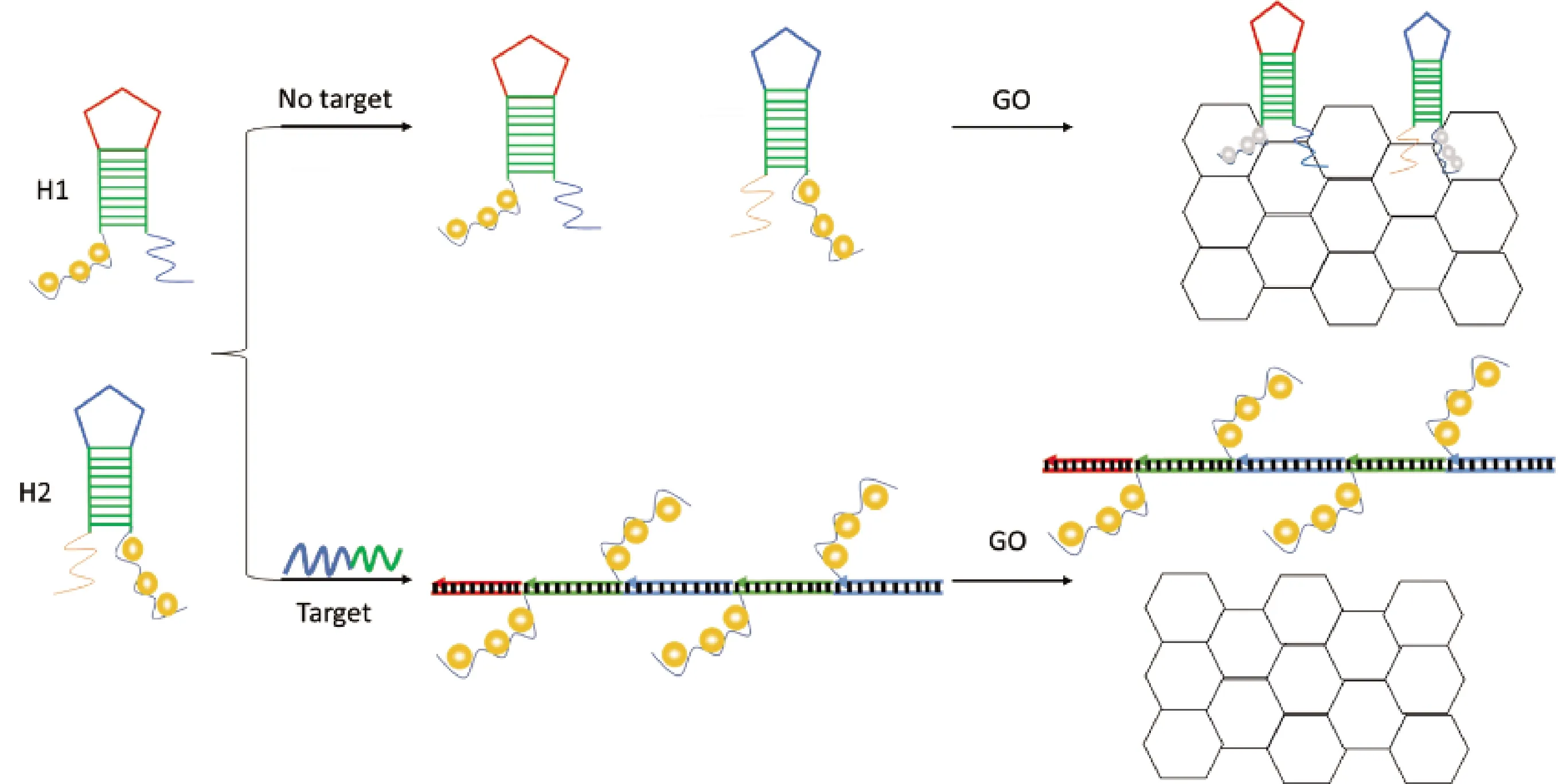
图4 基于HCR与GO的用于核酸的荧光检测示意图Fig.4 Schematic of fluorescence detection of nucleic acids based on HCR and GO
GO与HCR结合的传感平台也可用于miRNA的检测。例如,Fan等[49]提出了一种基于GO的荧光生物传感器,将其用于miRNA的检测。在该实验中,利用let-7a这一miRNA作为靶标分子,发夹探针H1和H2的粘性末端带有荧光基团,而且H1和H2通过π-π堆积连接到GO表面,荧光被GO有效猝灭。在加入let-7a、解旋酶RecQE和腺嘌呤核苷三磷酸(ATP)后,RecQE在ATP的驱动下与发夹探针结合并解开发夹探针的双链部分,使得let-7a可以快速触发HCR从而形成双链DNA产物,并使荧光显著增强。这一检测策略对miRNA的检测限达到4.2×10-15mol/L,同时,这种解旋酶辅助的HCR/GO传感平台的灵敏度比没有酶的普通HCR/GO传感平台高2个数量级,并有效缩短了检测时间。
3.4 与其它金属纳米材料的结合
除了以上论述的几种应用比较广泛的纳米材料,还有一些其他的纳米材料与HCR结合用来检测核酸,本文主要论述铜纳米材料、铂纳米材料以及磁性纳米珠。近年来,铜纳米材料受到研究人员的广泛关注,特别是具有出色的光稳定性和生物相容性的低毒素或无毒素的铜纳米团簇(CuNCs)[50]。Liao等[51]通过将原位生成的铜纳米团簇作为电化学发光体和二氧化钛(TiO2)作为核心加速器,成功构建了用于检测乳腺癌潜在生物标志物miRNA-21的超灵敏生物传感器。实验表明,这一生物传感器在1×10-16到1×10-10mol/L浓度范围内具有明显的线性关系,检测限为1.905×10-17mol/L,而且已成功应用于人宫颈癌与人乳腺癌细胞裂解液的检测。
2019年,Guo等[52]提出了基于HCR和酶诱导金属化的双信号放大策略,构建了用于miRNA-21的超灵敏电化学传感器,这种双重扩增策略将电化学信号增强了约120倍,并将其检测限有效降低至1.2×10-16mol/L。该方法灵敏度高、特异性强、线性动态范围宽,在疾病的早期诊断中具有很大的潜力。
Chen等[53]则首次提出使用DNA与铂纳米颗粒(PtNPs)之间的纳米组装进行比色法核酸检测。在室温下简单地将含有Pt前体(K2PtCl4)和DNA的溶液与NaBH4溶液混合来制备DNA-Pt杂化纳米颗粒,这种杂化纳米颗粒几乎没有过氧化物酶样活性。将TMB/H2O2比色底物溶液以及DNA-Pt杂化纳米颗粒溶液加到纸基上,该杂化溶液几乎无催化效率,因而会在纸的表面产生可见的蓝色沉淀。将靶标DNA与生物素修饰的捕获探针(S1)进行杂交以形成带有生物素粘性末端的探针(P1),然后P1通过生物素-链霉亲和素相互作用与磁珠进行结合。磁选后收集上清液并用于合成DNA-Pt杂化纳米颗粒。当存在靶DNA时,发夹探针H1和H2组装在一起并且在磁分离后可以有效地去除,合成的DNA-Pt杂化纳米颗粒通过上述纸基法表现出一定的颜色变化。Chen等提出的这种DNA与PtNPs的非共价自组装过程不仅快速方便,而且能够有效测出靶DNA的浓度值。
4 结 语
从以上论述可以看出,AuNPs、AgNPs、GO以及文中涉及的其它金属纳米材料等都具有一些优良的生物性质。基于HCR的生物传感器是一种无需酶的参与、在常温下就可进行反应的简单、快速、高灵敏、低成本的生物传感器。将这种基于HCR的生物传感器与以上几种纳米材料结合,已经成功用于核酸、蛋白质等生物分子以及金属离子的高灵敏甚至超灵敏检测。然而,对于一些非核酸类的物质如蛋白质、细胞等,有时需要设计合适的适配体才能进行检测,因此未来可以开发一些能够与HCR结合的新材料、筛选一些更有亲和力的核酸适配体,用于蛋白质、细胞等物质的现场、快速、高灵敏性检测。
