同型半胱氨酸降低衔接蛋白P66Shc DNA甲基化状态引起血管内皮损伤
2020-05-22张毛帅贵英英李慧丹梁万前李建华王学惠新乡医学院第一附属医院河南卫辉453100
张毛帅,贵英英,李慧丹,梁万前,李建华,林 飞,王学惠 (新乡医学院第一附属医院,河南 卫辉 453100)
流行病学和临床研究表明,高同型半胱氨酸血症(Hyperhomocysteine,HHcy)是致心血管疾病的一个独立危险因素[1-2]。在HHcy致心血管疾病的机制中, Hcy导致血管内皮细胞损伤是其中一个重要的因素[3]。研究表明P66Shc甲基化状态的改变,可引起血管内皮细胞损伤[4]。Hcy能否改变P66Shc甲基化状态,引起血管内皮细胞损伤,研究报道较少。本研究以体外培养人脐静脉内皮细胞(HUVECs)为研究对象,观察Hcy对细胞P66Shc DNA甲基化状态的影响及DNA甲基化状态改变后对血管内皮细胞凋亡的影响,为DNA甲基化介导Hcy致血管内皮损伤提供新的理论依据。
1 材料与方法
1.1材料:人脐静脉内皮细胞(Sciencell,美国Catalog Number 8000 Lot Number 15482 CA Number 0002748)、内皮细胞培养基(Sciencell,美国);同型半胱氨酸(Sigma,美国);P66Shc antibody(武汉三鹰,中国);Caspases-3抗体、兔二抗(Abcam,美国);DNA提取试剂盒、DNA甲基化试剂盒(康为世纪,中国);5-氮杂胞嘧啶核苷5-Azacytidine(Sigma,美国),TUNEL试剂盒(碧云天,中国)。
1.2方法
1.2.1MTT法检测细胞活性: 培养HUVECs融合约至80%,传代至96孔板,4 000细胞/孔,第2天加入不同浓度的Hcy。应用MTT法检测不同浓度Hcy孵育24 h后HUVECs的活性。
1.2.2TUNEL染色检测细胞凋亡:根据TUNEL试剂盒说明书[4%多聚甲醛固定、细胞通透、制备TUNEL反应混合液、标记反应、终止反应、封闭POD、酶标反应、DAB显色(避光)、苏木素复染]观察Hcy和5-Azacytidine处理后脐静脉血管内皮细胞凋亡情况。
1.2.3检测Hcy处理HUVECs中蛋白表达:培养HUVECs融合约至80%,传代至6孔板,分别加入终浓度为 0 μmol/L,50 μmol/L,100 μmol/L,200 μmol/L的Hcy,孵育24 h后,提取蛋白。应用WesternBlot技术检测P66Shc、active-Caspase-3蛋白表达水平。
1.2.4DNA的提取及DNA甲基化特异性PCR:采用DNA提取试剂盒,提取诱导后HUVECs中的DNA。应用DNA甲基化修饰试剂盒进行甲基化修饰。依次把12.5 μl Taq mix、1.25 μl甲基化及1.25 μl未甲基化上下游引物、1 μl处理后DNA、9 μl超纯水加入250 μl PCR管中。PCR仪按照95 ℃ 10 mins、95 ℃ 30 s、62 ℃ 30 s、72 ℃ 30 s、Tm=2 ℃(A+T)+4 ℃(G+C)循环35次,72 ℃ 7 mins退火。并制备1%琼脂糖凝胶,在254nm波长的透射紫外灯下观察。P66Shc甲基化引物:上游引物:5′-TTTTCGTTTTTTGGGTTC-3′下游引物: 5′-TACGTATTCCTACCGAACG-3′;P66Shc未甲基化引物:上游引物:5′-TAATTTTTGTTTTTTGGGTTT-3′下游引物: 5′-TACATATTCCTACCAAACACAA-3′。
1.2.5检测5-Azacytidine处理HUVECs中蛋白表达:培养HUVECs融合约至80%,传代至6孔板,分别加入终浓度200 μmol/L的Hcy同时加入终浓度为0 μmol/L、10 μmol/L、50 μmol/L、100 μmol/L的5-Azacytidine后,应用WesternBlot技术检测P66Shc、active-Caspase-3蛋白表达水平。
1.3统计学方法数据:采用Graph-Pad Prism 6.0统计软件对实验数据进行处理:两组间比较采用t检验,多组间比较采用单因素方差分析,两组计量资料之间的相关性采用双变量相关分析。P<0.05为差异有统计学意义。
2 结果
2.1Hcy对HUVECs活性的影响:Hcy对细胞活力影响如图1所示,随着Hcy浓度的增加,细胞活力逐渐降低。
2.2Hcy和5-Azacytidine处理后细胞凋亡检测:如图2所示: 与对照组相比,Hcy处理后细胞凋亡增加,而加入5-Azacytidine处理后,可以明显减轻细胞的凋亡。TUNEL染色阳性表现为细胞核呈深棕黄色如箭头所示。
2.3Hcy处理HUVECs后P66Shc、active-Caspase-3蛋白表达水平:如图3所示,与对照组相比,不同浓度Hcy(50 μmol/L、100 μmol/L、200 μmol/L)处理HUVEC均可以促进P66Shc与active-Caspase-3的表达增加, 且Hcy致HUVECs损伤具有剂量依赖性。
2.4P66Shc特异性甲基化PCR:如图4所示,P66Shc在对照组中甲基化状态较强,在Hcy诱导组中未甲基化状态较强。说明Hcy降低P66Shc DNA甲基化状态。

*为P<0.05,**为P<0.01
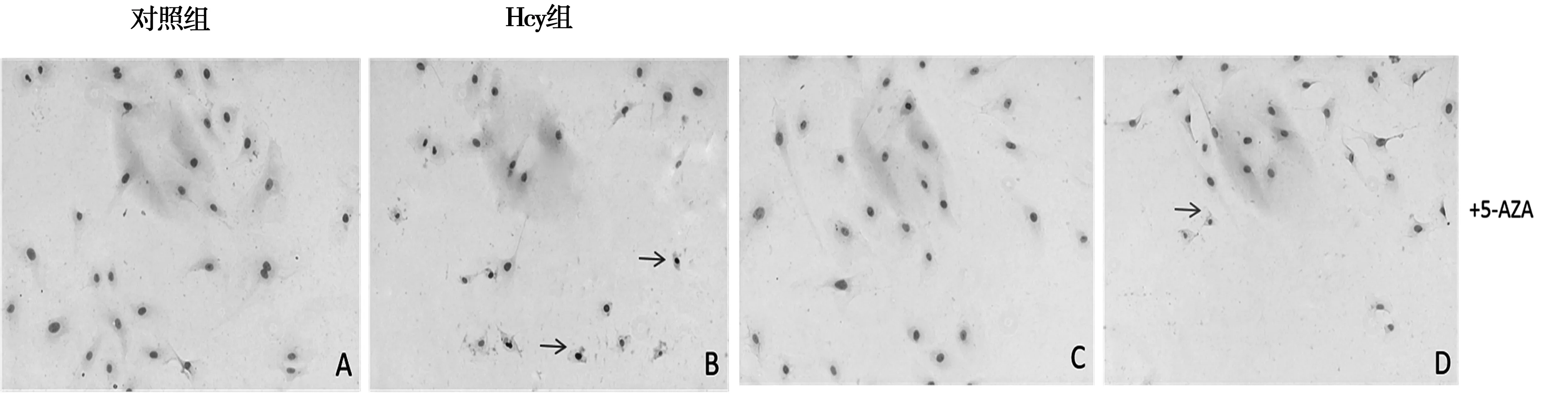
注:A组:对照组 B组:Hcy组 C组:5-AZA组 D组:Hcy+5-AZA组

*为P<0.05,**为P<0.01

图4 各组处理细胞中P66Shc甲基化检测电泳图
2.55-Azacytidine处理HUVECs后P66Shc、active-Caspase-3蛋白表达水平:如图5所示,与单加200 μmol/L Hcy处理组相比,加入不同浓度5-AZA(10 μmol/L、50 μmol/L、100 μmol/L)处理细胞后,均能降低P66Shc、active-Caspase-3蛋白表达水平,并且随着5-AZA浓度的增加而逐渐减少。
3 讨论
冠状动脉粥样硬化是冠心病的病理基础,其发生发展常常造成严重心血管事件的发生。研究结果显示,HHcy是致冠状动脉粥样硬化的独立危险因素[5]。HHcy导致冠状动脉粥样硬化发生的机制包括细胞氧化应激、内质网应激、线粒体应激反应与凋亡、血管炎性反应、细胞凋亡及血管内皮细胞损伤等[6-7]。其中HHcy致血管内皮损伤是导致心血管疾病的独立预测因子。在HHcy致心血管疾病进展的机制中,Hcy导致血管内皮细胞损伤是较为重要的因素[8]。

*为P<0.05,**为P<0.01
近年来研究发现表观遗传学修饰影响各类疾病的发生、发展,其机制为在基因序列不发生改变情况下,导致基因表型变化。L.Duan等报道[9]表观遗传学修饰与冠状动脉粥样硬化关系密切。在表观遗传学修饰引起血管内皮细胞损伤机制中,DNA甲基化能够抑制转录因子转录,进而引起血管内皮细胞损伤[10]。在人组织样本和小鼠模型中已经证实DNA低甲基化能够促进动脉粥样硬化的发生与发展[11-12]。Hcy参与蛋氨酸循环的转甲基代谢,可以改变蛋白组及DNA的甲基化状态[13]。这样在表观遗传学修饰层面上,解释了Hcy致冠状动脉粥样硬化的机制。
衔接蛋白P66Shc能够调节细胞凋亡,是影响哺乳动物应激凋亡反应调控通路的一部分。衔接蛋白P66Shc通过其氧化还原酶活性刺激线粒体活性氧 (ROS)的产生以及一氧化氮(NO)损耗,加重血管内皮损伤,在动脉粥样硬化的病理生理过程中起着重要作用[14-15]。冠状动脉粥样硬化性心脏病患者的外周血单核细胞(PBM)中,P66ShcmRNA表达与血清低密度脂蛋白胆固醇和Hcy水平呈显著正相关[16]。另外P66Shc能够介导Hcy诱导ROS功能失调及内皮细胞凋亡[17]。甲基化转移酶抑制剂5-AZA能够抑制血管内皮炎性损伤及动脉粥样硬化的发展[18]。
笔者探讨DNMT3b抑制剂的5-AZA是否能够抑制P66Shc的表达并减少血管内皮细胞凋亡。本实验结果表明Hcy诱导HUVECs凋亡,促进P66Shc的表达,引起血管内皮细胞损伤。验证了P66Shc调节血管内皮细胞损伤的作用。另active-Caspase3是反映细胞凋亡的关键指标,能够反映血管内皮损伤程度,在Hcy致血管内皮损伤中起到监测作用[7]。检测active-Caspase3表达程度能够间接反应P66Shc对血管内皮损伤的作用[19]。本实验采用特异性甲基化检测Hcy诱导P66Shc甲基化状态变化及细胞凋亡程度的改变,判断血管内皮细胞损伤程度。结果显示:Hcy诱导P66Shc低DNA甲基化状态及active-Caspase3蛋白表达增加,而5-Azacytidine抑制P66Shc及active-Caspase3蛋白表达。说明Hcy致 P66Shc的DNA低甲基化,使血管内皮细胞凋亡产生血管内皮损伤。但考虑5-AZA为DNA甲基化转移酶抑制剂,理论上会降低P66Shc启动子区甲基化而升高其表达,但结合文献报道及本实验结果考虑可能存在其他结合位点及转录相关蛋白介导引起5-AZA起到血管内皮保护性机制[20-21]。
综上所述,Hcy能够降低P66Shc的DNA甲基化,致血管内皮细胞凋亡,产生血管内皮细胞损伤。本实验明确了Hcy调节DNA甲基化状态致血管内皮损伤的新机制,为研究Hcy致表观遗传学改变提供新的思路。结合DNMTs酶抑制剂-HDACIs已经被作为治疗癌症及血液系统疾病的靶点,笔者相信DNA甲基化等表观遗传机制是治疗心血管疾病的潜在靶点[22]。结合Hcy通过活化DNMT3b诱导P66Shc的表达,并促进细胞氧化应激的发生进而造成血管内皮损伤。SiRNA技术敲低DNMT3b,进一步验证P66Shc甲基化程度及改变后血管内皮损伤的程度[23]。另外通过诱导DNMTs表达及P66Shc靶点作用,能为治疗Hcy代谢异常及胱硫醚β-合成酶(CBS)、亚甲基四氢叶酸还原酶(MTHFR-C667T )基因突变所致心血管疾病及其他所致疾病提供新的诊断、治疗策略。是否存在Hcy改变P66Shc甲基化状态,进而影响下游靶基因的表达改变使细胞凋亡程度增加,而最终造成血管内皮损伤的形成仍待研究。由于基因内甲基化的提出、DNA甲基化的复杂性、全组DNA甲基化动态变化仍不十分明确,DNA甲基化相关数据及Hcy诱导心血管疾病相关未知机制仍需要继续探索[24-26]。
