超高压处理对β-伴大豆球蛋白抗原性及结构的影响
2020-05-22李堂昊布冠好赵益菲陈复生
李堂昊,布冠好,赵益菲,陈复生
河南工业大学 粮油食品学院,河南 郑州 450001
大豆富含优质的蛋白质与油脂[1],但大豆也是公认的八大食物过敏原之一。有研究表明,对大豆过敏的儿童比例高达13%[2]。β-伴大豆球蛋白被认为是引发机体食物过敏的主要成分[3],其3个亚基均具有致敏性,其中α亚基的致敏性最强,25%的大豆敏感病人的血清能够识别它,是最早被公认的主要过敏原蛋白[4-5]。国内外对于大豆过敏尚无根本解决办法,只能依靠避免摄入来防止食物过敏反应的发生。大豆提供氨基酸平衡的高品质蛋白质,常作为原辅料出现在许多食品中,这无疑给大豆过敏人群带来了潜在威胁[6]。
对于食物过敏,寻找一种有效的加工技术来控制过敏原显得尤为重要[7]。热加工可以一定程度地减少过敏原的抗原性,但不能完全清除[8]。近年来,非热加工技术,特别是超高压(HHP)技术在食品加工领域广泛应用。超高压处理能够有效延长食品货架期,且对食品风味与营养价值几乎没有影响[9]。目前,国内外学者已将超高压作为一种有效的非热加工技术应用于食品中过敏原的消减[10-11]。Li等[12]比较了4种物理方法(微波、高强度超声、高压均质化和超高压)对婴儿配方奶粉中大豆分离蛋白致敏性的影响,发现4种方式均能在一定程度上消减大豆分离蛋白与过敏患者血清的结合能力,超高压的消减效果最佳,达到46.6%。Meinlschmidt等[9]提出在风味蛋白酶水解前施加500 MPa的超高压处理,使大分子的蛋白质水解成小分子的肽,破坏了原有的抗原表位,使处理后的样品几乎检测不出β-伴大豆球蛋白的免疫反应性。Xi等[13]研究表明,经过400 MPa超高压处理15 min,β-伴大豆球蛋白的抗原性降低了40%。因此,超高压处理可能是降低大豆蛋白免疫特性的一种有效方法。
不同超高压处理条件对β-伴大豆球蛋白的抗原性与结构的影响研究较少,且两者间的构效关系尚不明确。作者通过等电点冷沉法提取β-伴大豆球蛋白,设置不同的超高压条件对其进行处理,利用Western-Blot与ELISA法定性和定量分析β-伴大豆球蛋白的免疫活性,通过SDS-PAGE、红外光谱与荧光光谱表征处理前后β-伴大豆球蛋白结构的变化,探究超高压处理前后β-伴大豆球蛋白免疫活性与结构的相关性,为超高压进一步应用于消除食源性过敏原提供理论依据。
1 材料与方法
1.1 试验材料
脱脂大豆粉:河南省鲲华生物技术有限公司;β-伴大豆球蛋白标准品(C5868)、HRP-羊抗兔IgG(A6154):Sigma公司;兔抗β-伴大豆球蛋白血清:实验室自制;牛血清蛋白(BSA):北京索莱宝科技有限公司;凝胶电泳试剂盒:武汉博士德生物工程有限公司;其他试剂均为市售分析纯。
1.2 主要仪器与设备
荧光分光光度计:美国Varian公司;恒温生化培养箱:上海一恒科技有限公司;超高静压装置:包头科发有限公司;傅里叶红外光谱仪、酶标仪:美国赛默飞世尔仪器有限公司;电泳装置:北京市六一仪器厂;高速冷冻离心机:上海安亭科学仪器厂。
1.3 试验方法
1.3.1 蛋白的制备
β-伴大豆球蛋白的提取采用一种优化过的方法[14-16]。料液比(g/mL)为1∶15,脱脂大豆粉与0.03 mol/L的Tris-HCl缓冲液(pH 8.5)在45 ℃下浸提1 h,离心(4 ℃,10 000 r/min,20 min)取上清液。加入0.01 mol/L NaHSO3和5 mmol/L CaCl2,调节pH值至6.4,4 ℃过夜,离心后取上清液。调节pH值至5.5,搅拌1 h,离心取上清液。加入等体积冰水,调节pH至4.8,离心后的沉淀为β-伴大豆球蛋白。0.03 mol/L的Tris-HCl复溶,4 ℃透析2 d,冻干后备用。
1.3.2 超高压处理
用磷酸盐缓冲液(pH 7.0)溶解β-伴大豆球蛋白,真空密封后进行超高压处理。试验因素设置为超高压压强、加压时间以及蛋白质量浓度。超高压处理条件:当蛋白质量浓度与加压时间分别为5 mg/mL和20 min时,压强范围为100~600 MPa;蛋白质量浓度与压强分别为5 mg/mL和500 MPa,时间范围为5~30 min;压强与加压时间分别为500 MPa和20 min,蛋白质量浓度范围为5~30 mg/mL。
1.3.3 SDS-PAGE分析
参照赵益菲等[8]的方法对样品进行SDS-PAGE分析。
1.3.4 ELISA法
采用间接竞争ELISA法测定超高压处理后抗原性的变化[17-18]。标准抗原用50 mmol/L的碳酸盐缓冲溶液(pH 9.6)稀释至0.4 μg/mL(由前期试验确定),100 μL/孔包被于96孔酶标板中,样品与兔抗血清(1∶6 400稀释)混合,4 ℃过夜。接下来的试验流程与赵益菲等[8]的一致。吸光度(OD)用酶标仪测定,OD=OD450-OD620,其中OD450和OD620表示在450 nm和620 nm波长下测得的吸光度。样品抗原性的大小用抗原抑制率表示,抗原抑制率越大表示样品具有的抗原性越高。
抗原抑制率/%=(1-OD/OD0)×100,
式中:OD为样品吸光度;OD0为无竞争体系的吸光度。
1.3.5 Western-Blot法
通过Western-Blot法分析β-伴大豆球蛋白的免疫原性[19]。
1.3.6 FTIR分析
试验参考赵益菲等[8]的方法。样品红外光谱用Peak fit 4.12软件分析,得到蛋白质二级结构的含量[20]。
1.3.7 荧光光谱分析
β-伴大豆球蛋白表面疏水性指数用8-苯氨基-1-萘磺酸铵盐(ANS)探针测定[21]。样品蛋白用10 mmol/L PBS(pH 7.0)稀释至5 mg/mL,不同处理条件下的样品用同一PBS缓冲液梯度稀释成6种稀释度。4 mL样品溶液中加入20 μL的ANS溶液(80 mmol/L),摇匀后测定样品在390 nm激发波长与470 nm发射波长下的荧光强度。用测得的荧光强度对蛋白质量浓度拟合所作曲线的初始斜率表示表面疏水性指数。
超高压处理后对β-伴大豆球蛋白进行荧光光谱分析,扫描参数:激发波长设置为390 nm,波长范围400~600 nm。
1.3.8 数据统计与分析
所有试验数据均平行测定3次,用平均值±标准差表示。利用SPSS 16.0软件对试验数据进行Duncan显著性分析,P<0.05表示差异显著,并用OriginPro 8.5软件绘图。
2 结果与分析
2.1 β-伴大豆球蛋白的提取
通过凯氏定氮测得提取的β-伴大豆球蛋白的蛋白含量为92.70%,图1是提取样品的SDS-PAGE图谱。提取出的β-伴大豆球蛋白α′、α、β3个亚基条带清晰,且与SPI中β-伴大豆球蛋的3个亚基位置相符,经Gel-pro analyzer软件分析,其蛋白纯度达到72.68%,提取纯度较高,可用于下一步试验。
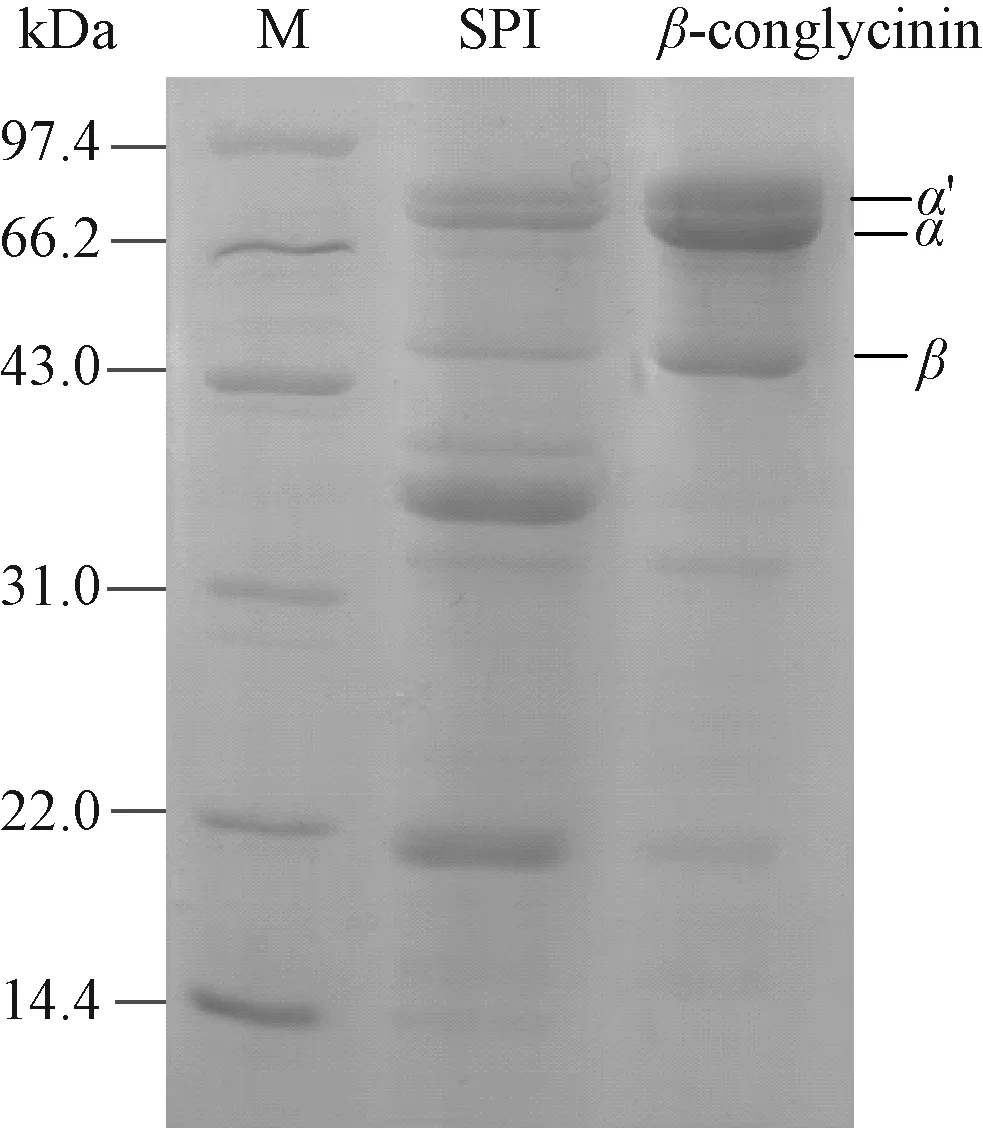
M:Marker;SPI:大豆分离蛋白;β-conglycinin:制备的蛋白
2.2 超高压处理对β-伴大豆球蛋白抗原性的影响
图2—图4表示不同超高压处理条件对β-伴大豆球蛋白抗原性的影响。由图2可知,随着处理压强的增加,β-伴大豆球蛋白在压强为400 MPa时显示出最低的抗原性,与未超高压处理相比,降低了45.30%。图3表明,β-伴大豆球蛋白的抗原性随加压时间的延长呈先降低后升高趋势。这与Xi等[13]的研究结果相似。抗原性降低的原因可能是超高压处理使蛋白变性,导致IgG无法识别蛋白质表面的抗原表位,无法诱发超敏反应[22-23]。继续加大压强与延长加压时间反而会增加β-伴大豆球蛋白抗原性,这可能是压强的增大与加压时间的延长使蛋白质结构发生改变,原本被掩盖的抗原表位暴露,抗原性上升[24]。图4表明,随着蛋白质量浓度提高,β-伴大豆球蛋白的抗原性持续上升,这可能是由于蛋白质量浓度提升,使作用在蛋白上的压强减小。由以上结果可知,不同条件的超高压处理能够显著影响β-伴大豆球蛋白的抗原性。

注:图中不同字母代表的数值之间具有显著性差异(P<0.05),图3、图4同。
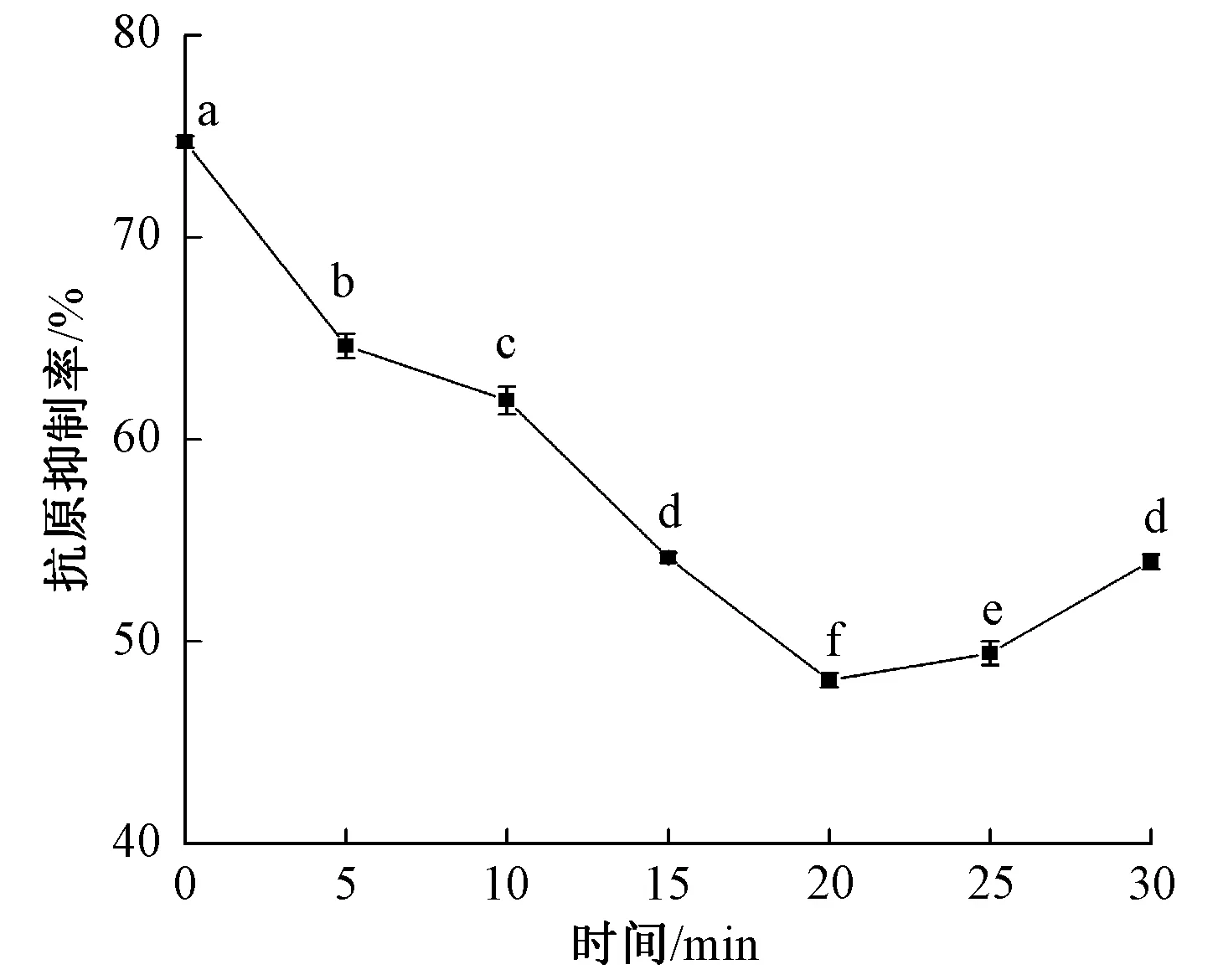
图3 不同加压时间对β-伴大豆球蛋白抗原性的影响
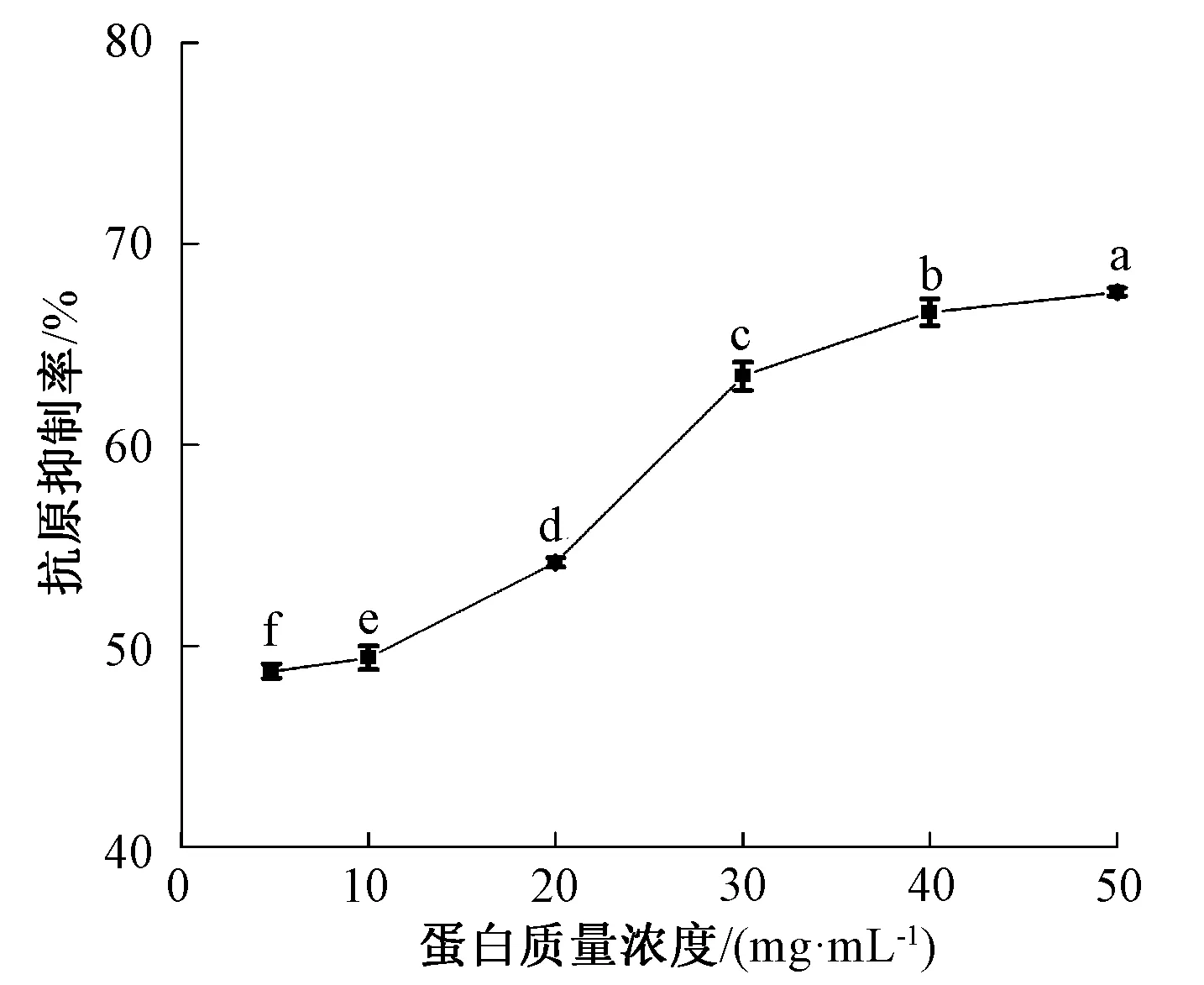
图4 不同质量浓度对β-伴大豆球蛋白抗原性的影响
2.3 超高压处理对β-伴大豆球蛋白亚基及免疫原性的影响
采用SDS-PAGE与免疫印迹法对超高压处理后的β-伴大豆球蛋白的亚基组成和免疫原性进行分析。图5为不同超高压处理后蛋白的SDS-PAGE图谱,从图5可以看出,随着压强的增加,β-伴大豆球蛋白的各亚基条带没有显著变化,表明β-伴大豆球蛋白经超高压处理后亚基的组成并未发生改变。图6为免疫印迹结果,超高压处理的β-伴大豆球蛋白(条带2—7)均出现免疫反应条带。随着压强的增加,出现明显的颜色变浅现象,但条带并未完全消失,这说明超高压处理可以降低β-伴大豆球蛋白的免疫原性。结合前面ELISA的结果可知,随着压强的提高,β-伴大豆球蛋白的抗原性和免疫原性会出现一定程度的降低,这可能是由于蛋白质结构的变化使其与抗体结合的能力下降。
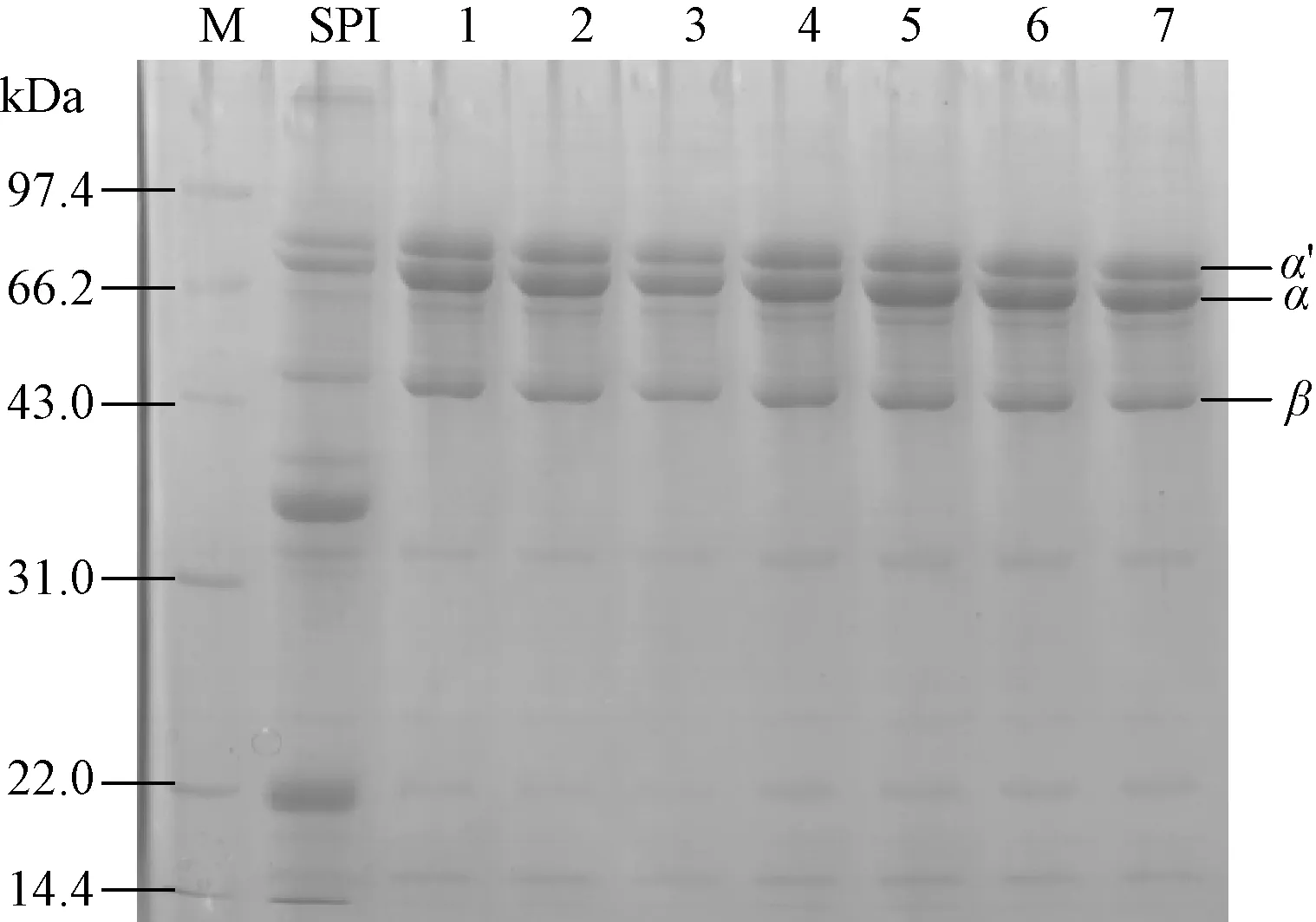
M:标准蛋白;SPI:大豆分离蛋白;1:未超高压的β-伴大豆球蛋白;2:100 MPa; 3:200 MPa; 4:300 MPa;5:400 MPa; 6:500 MPa; 7:600 MPa
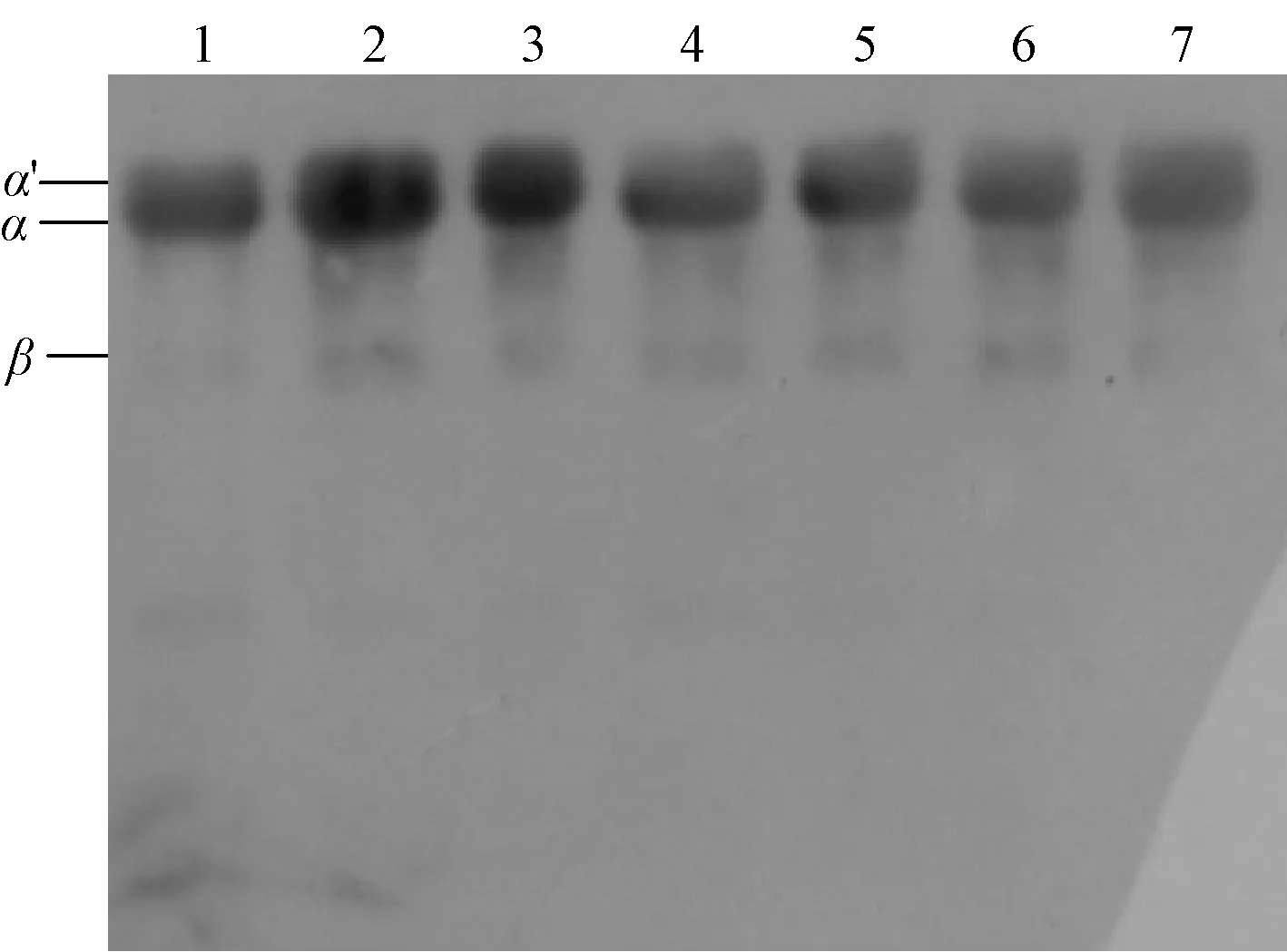
1:0 MPa;2:100 MPa;3:200 MPa;4:300 MPa;5:400 MPa;6:500 MPa;7:600 MPa
2.4 β-伴大豆球蛋白二级结构的变化
图7为β-伴大豆球蛋白在不同超高压处理条件下的红外光谱图。红外光谱的酰胺Ⅰ(1 600~1 700 cm-1)、酰胺Ⅱ(1 530~1 550 cm-1)和酰胺Ⅲ(1 260~1 330 cm-1)是蛋白质的特征吸收区域[25]。由图7可知,与未处理的β-伴大豆球蛋白相比,超高压处理后,3条蛋白质特征吸收区域并未发生明显的红移或蓝移,但是特征区域的透过率明显上升,表明经超高压处理后β-伴大豆球蛋白的结构发生了变化。
与未处理样品相比,400 MPa超高压处理时,蛋白二级结构中α-螺旋与β-转角的含量显著下降,而无规则卷曲和β-折叠的含量显著上升。 ELISA结果显示,400 MPa时β-伴大豆球蛋白的抗原性最低,这表明β-伴大豆球蛋白抗原性的变化可能与二级结构中α-螺旋与β-转角的含量下降有关。有研究指出,过敏原的抗原表位多位于β-转角与无规则卷曲结构上[28],与本研究的结果不同。原因可能是β-伴大豆球蛋白的抗原表位分布不同,文中优势的抗原表位出现在α-螺旋与β-转角的结构上。综上可知,β-伴大豆球蛋白的抗原性与二级结构之间存在着相关性,但是这种关系还有待进一步的研究。
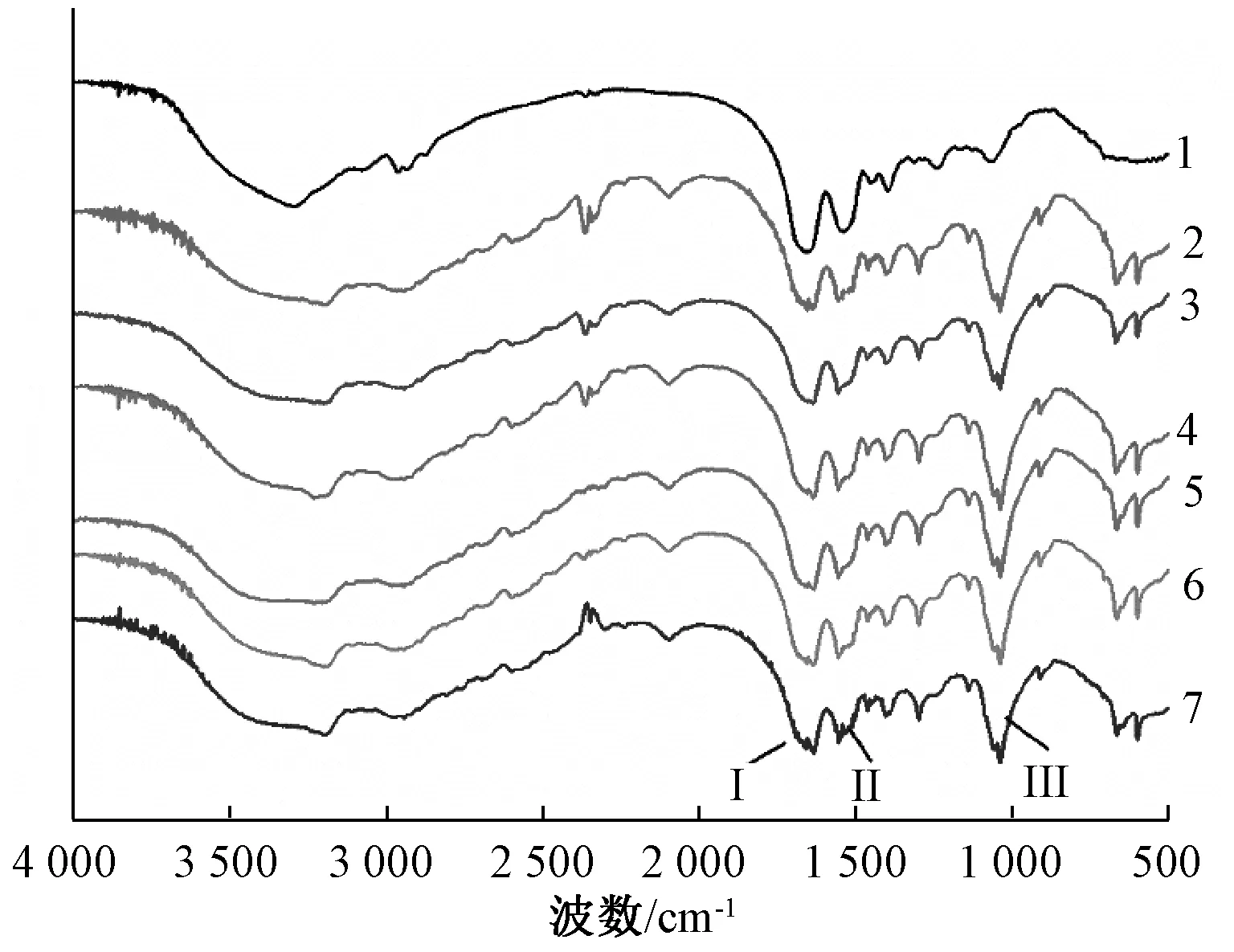
1:0 MPa;2:100 MPa;3:200 MPa;4:300 MPa;5:400 MPa;6:500 MPa;7:600 MPa
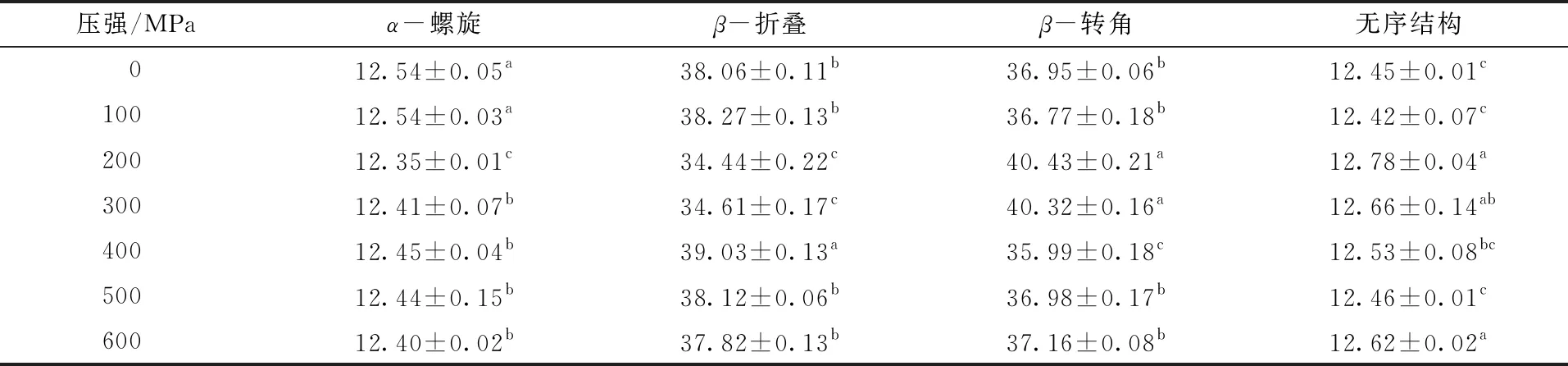
表1 超高压处理后β-伴大豆球蛋白的二级结构含量
注:同一列的不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著。
2.5 蛋白质表面疏水性及空间结构分析
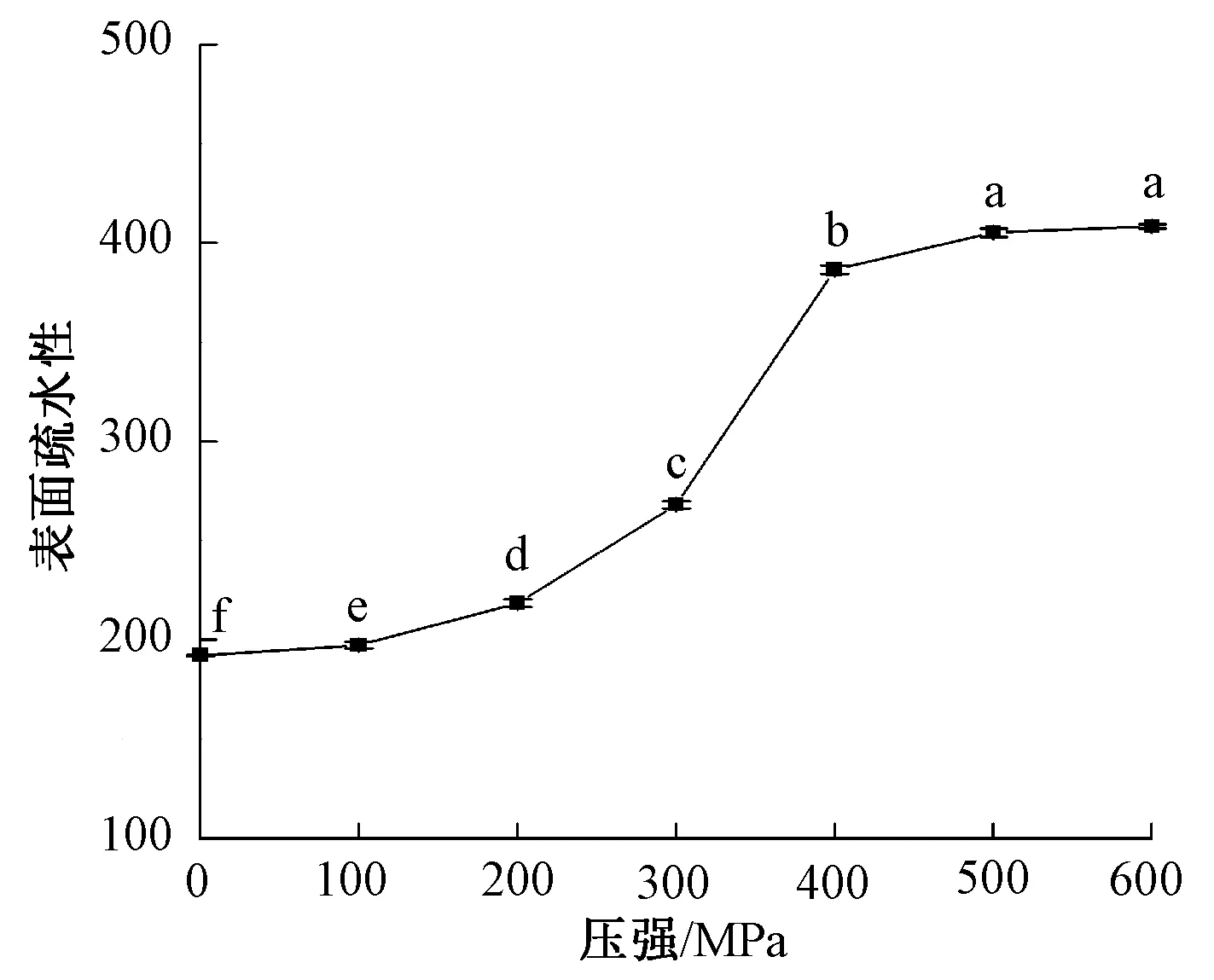
图8 超高压处理β-伴大豆球蛋白的表面疏水性
图8为β-伴大豆球蛋白的表面疏水性。由图8可知,表面疏水性随超高压处理压强的增加而上升。表面疏水性在400 MPa时急剧上升,继续加大压强,表面疏水性并未有显著变化。这可能是由于超高压破坏了蛋白质原有的空间结构,使原本在内部的疏水基团暴露出来,蛋白质的疏水性增加[29];继续增大压强并不能进一步扩大疏水区域,说明此时蛋白结构趋于稳定。图9为超高压处理后β-伴大豆球蛋白的荧光光谱图。荧光光谱显示最大吸收峰并未发生明显的蓝移或红移,表明超高压处理并未显著改变β-伴大豆球蛋白所处环境的极性。但随着压强的增加,荧光强度显著变化,这表明超高压处理改变了β-伴大豆球蛋白的三级结构,使得疏水性氨基酸更多地暴露在蛋白质表面。压强为400 MPa时,大量的疏水性氨基酸暴露,此时处理后的β-伴大豆球蛋白也表现出最低的抗原性,这可能是由于超高压处理改变了蛋白质空间结构,使蛋白质的构象表位被破坏,从而减少被IgG抗体的识别。也有可能是抗原表位大多存在于亲水区域,超高压处理使大量的疏水区域暴露,从而亲水区域减少,抗原表位被掩盖[28]。综上可知,超高压处理后大量疏水性基团暴露,蛋白质空间结构改变,抗原表位被破坏或掩盖,从而使β-伴大豆球蛋白的抗原性降低。
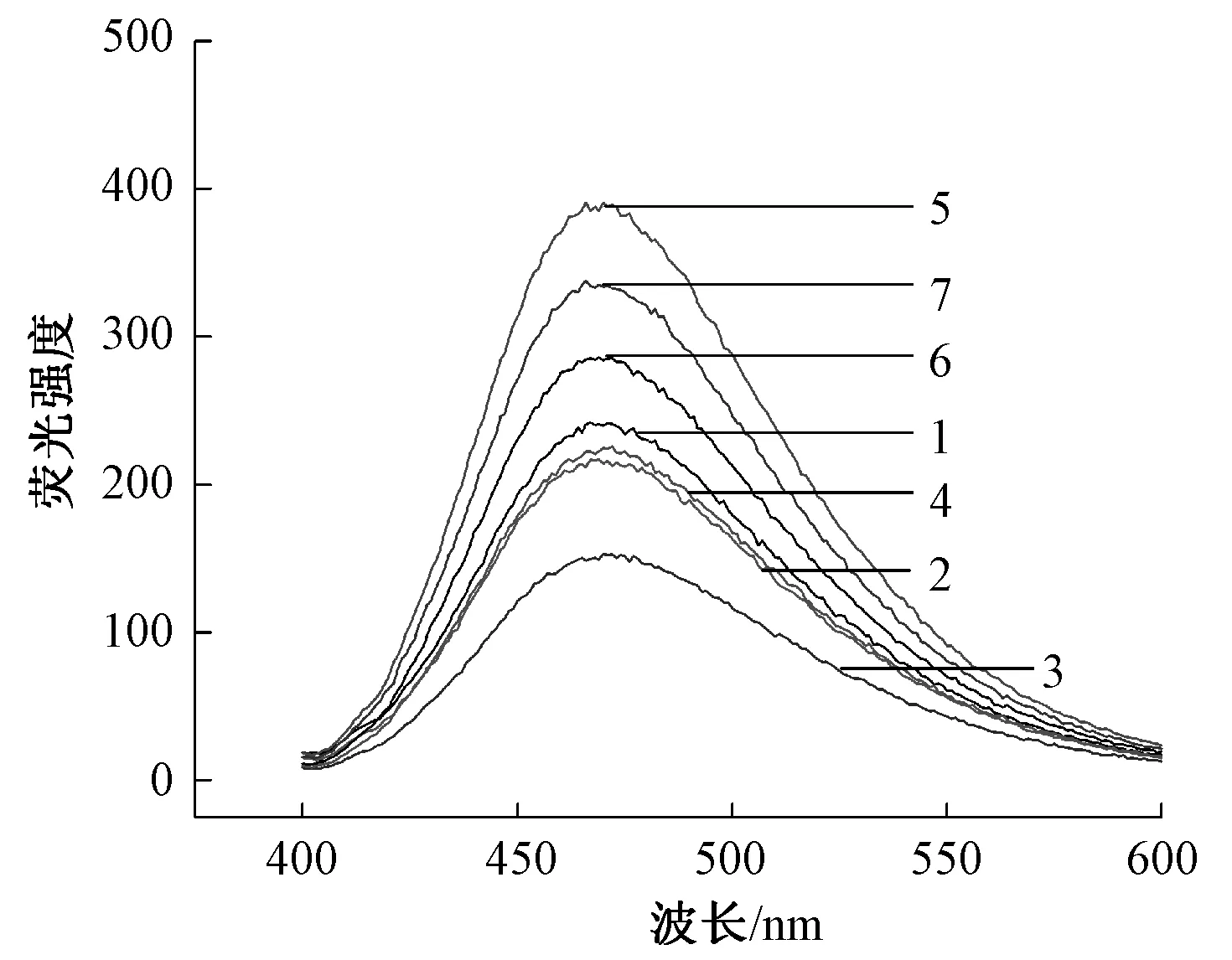
1:0 MPa;2:100 MPa;3:200 MPa;4:300 MPa;5:400 MPa;6:500 MPa;7:600 MPa
3 结论
超高压处理能够显著改变β-伴大豆球蛋白的抗原性及空间结构。超高压处理后β-伴大豆球蛋白抗原性发生变化,在400 MPa时抗原性降低最显著,降低了45.30%。红外光谱结果表明,超高压处理使β-伴大豆球蛋白的二级结构发生改变,与未处理样品相比,400 MPa时α-螺旋与β-转角的含量显著下降,而无规则卷曲和β-折叠的含量显著上升。荧光光谱分析结果显示,超高压处理改变了β-伴大豆球蛋白的三级结构,大量疏水区域暴露,可能掩盖或破坏其抗原表位。本研究分析了不同条件的超高压处理对β-伴大豆球蛋白抗原性及结构的影响,发现超高压处理可以改变蛋白质空间结构,可能影响其抗原表位,从而达到调控蛋白过敏原抗原性的目的。该研究为大豆蛋白过敏原的脱敏提供加工方法,为开发低敏性或无致敏性大豆产品提供理论依据。
