基于高通量测序技术的酿酒葡萄产区土壤微生物多样性
2020-05-21布丽根加冷别克胡晓东夏俊芳张志东顾美英
王 伟 ,布丽根·加冷别克,胡晓东,夏俊芳,张志东,顾美英 ,武 运
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052; 2.新疆农业科学院微生物应用研究所,乌鲁木齐 830091)
0 引 言
【研究意义】葡萄种植业是重要的果园生态系统之一,其土壤中蕴含着丰富的微生物,近年来,有学者开展了葡萄园土壤微生物的研究[1]。在自然发酵过程中,葡萄酒中的微生物主要来源于酿酒葡萄、葡萄园土壤、酿造设备等,这些微生物会随着葡萄果粒和酿造工序进入发酵罐参与发酵过程,对葡萄酒的品质产生一定影响[2]。【前人研究进展】目前,国外科研人员对其葡萄酒产地的土壤微生物菌群多样性进行了广泛的研究,例如Renouf等[3]研究发现,土壤中的优势真菌菌属为Saccharomyces、Sordaria、Tetracladium和Geomyces;Hirano等[4]、Park等[5]研究发现,土壤中的优势细菌菌属为Kaistobacter、Arthrobacter、Skermanella和Sphingomonas。中国酿酒葡萄栽培区域广阔,酿酒葡萄适栽区的生态地理条件复杂多样,蕴藏着丰富的酿酒微生物资源[6-7]。【本研究切入点】鲜有关于酿酒葡萄园土壤微生物群落多样性与土壤环境关系的研究。自然环境中仅有1%左右甚至更少的微生物具有可培养性[8],利用传统技术对土壤微生物进行研究已不能满足微生物资源的开发和利用[9]。Illumina Miseq高通量测序是目前应用最广泛的高通量测序技术,具有准确度高和通量大的特点,已被大量应用于微生物群落多样性研究[10-11]。【拟解决的关键问题】采用Illumina MiSeq高通量测序技术结合生物信息学分析,研究中国新疆吐哈盆地、伊犁河谷、焉耆盆地、天山北麓4大酿酒葡萄产区土壤微生物群落结构及多样性,为新疆酿酒葡萄主产区微生物菌库的构建提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 土壤样品
土壤样品分别采自酿酒葡萄产区中8年树龄赤霞珠葡萄园土壤,每种样品采集3份。新疆吐哈盆地为1号样(E89.194908°,N42.950894°)、伊犁河谷为2号样(E82.217131°,N43.490168°)、焉耆盆地为3号样(E87.107208°,N42.271358°)、天山北麓为4号样(E86.057281°,N44.056999°)
V3基因测序试剂盒,美国Illumina公司;TopTaqDNA Polymerase试剂盒,北京全式金生物技术有限公司;AgencourtAMPureXP核酸纯化磁珠,美国Beckman Coulter公司。
1.1.2 仪器与设备
Illumina Misq测序平台,美国Illumina公司;5810R离心机,德国Eppendorf公司;ABI 2720 PCR仪、Nanodrop 2000微量紫外分光光度计及Qubit3.0荧光定量仪,美国Thermo Fisher Scientific公司;Agilent 2100生物分析仪,美国Agilent Technologies公司;Optima 2100 ICP-AES分析仪,美国PE公司。
1.3 方 法
1.3.1 样品制备
采用五点取样法采集土样,去除葡萄园地表的植物等残体,用灭菌土铲垂直切开土壤,在10~20 cm深度处取样,每个取样点取样约0.5 kg,保存于灭菌的密封袋,置于冰袋中冷藏迅速带回实验室,土样在-80℃下保存备用。
1.3.2 土壤理化性质的测定
不同葡萄园土壤样品进行以下理化性质分析:pH值、有机质(SOM)含量、全氮(N)含量、速效氮(N)含量、全磷(P)含量、速效磷(P)含量、Fe含量及Mn含量。土壤pH值采用pH计法测定;土壤有机质测定采用重铬酸钾外加热法[12];土壤全氮测定采用凯氏定氮法[13];土壤速效氮测定采用碱解扩散法[14];土壤全磷测定采用钼蓝比色法[15];土壤速效磷测定采用碳酸氢钠浸提-钼锑抗比色法[14];土壤Fe及Mn元素含量测定采用ICP-AES法[16]。
1.3.3 土壤样品总DNA的提取及PCR扩增[17-18]
土壤中微生物原基因组总DNA的提取采用TopTaqDNA Polymerase试剂盒(Transgen)进行。
采用细菌16S rDNA V3-V4扩增通用引物和真菌ITS1区进行PCR扩增,细菌引物为341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5’-GACTACHVGGTATCTAATCC-3');真菌引物为ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3');ITS2(5'-GCTGCGTTCTTCATCGATG-3')。PCR反应扩增体系(20 μL):5×PCR BufferⅡ 4 μL,2.5 mmol/L dNTPs 2 μL,0.4 μmol/L正、反向引物各0.8 μL,TransStart FastPfu DNA Polymerase 0.4 μL,DNA模板2 μL,ddH2O补充至20 μL。PCR扩增程序:94℃预变性2 min;94℃变性20 s,55℃退火30 s,72℃延伸60 s,反应25个循环;72℃延伸10 min。琼脂糖凝胶电泳检测扩增产物是否单一和特异,将同一个样本的3个平行扩增产物混合,每个样本加入等体积的AgencourtAMpureXP核酸纯化磁珠对产物进行纯化。
1.3.4 高通量测序
混样后的文库通过Agilent 2100 Bioanalyzer检测测序文库插入片段的大小,确认在120~200 bp无非特异性扩增,并准确定量测序文库浓度。采用Illumina MiSeq高通量测序平台,2×250 bp的双端测序策略对文库进行测序。为了得到高质量的测序数据,需要对原始下机数据进行质控和过滤,主要步骤如下:
(1)使用TrimGalore软件去除序列末端质量低于20的碱基并去除可能包含的嵌合体序列,之后去除长度小于100 bp的短序列;(2)使用FLASH2软件[19]将双末端测序得到的成对序列进行拼接,得到拼接序列,进一步去除拼接后低质量序列(超过90%的碱基质量低于20);(3)使用mothur软件[20]查找并去除序列中的引物;(4)使用usearch去除总碱基错误率大于2的序列以及长度小于100 bp的序列,得到质量和可信度较高的优化序列,该数据将用于后续生物信息分析。
OTU(Operational taxonomic unit)聚类分析通过在QIIME中调用Uclust[21]方法对优质序列按相似度0.97进行聚类,选取每个类最长的序列为代表序列。OTU注释通过在QIIME中采用BLAST[22]的方法对序列数据库进行比对,获得每个OTU分类学信息。OTU维恩图利用R软件生成样本间(或组间)OTU的维恩图。根据OTU列表中的各样品物种丰度情况,应用Mothur软件计算常用的生物多样性指数。将优势菌门与土壤理化因子结合制成RDA图。
2 结果与分析
2.1 土壤理化性质
植物、土壤和微生物三者相互影响,共同组成一个复杂的土壤生态系统[23]。微生物是土壤中最具活力的部分,其群落结构与功能特征与植物的定居、营养和生长等关系极为密切[24]。焉耆盆地的土壤样品pH值最大(P< 0.05),pH值为8.36,而且该样品的有机质、Fe、Mn的含量也是最高的(P< 0.05),分别为0.96%、4.50 mg/kg及4.81 mg/kg;伊犁河谷的全N含量、速效N含量、全P含量及速效P含量最高(P< 0.05),分别为0.068%、82.18 mg/kg、0.094%及24.81 mg/kg。表1
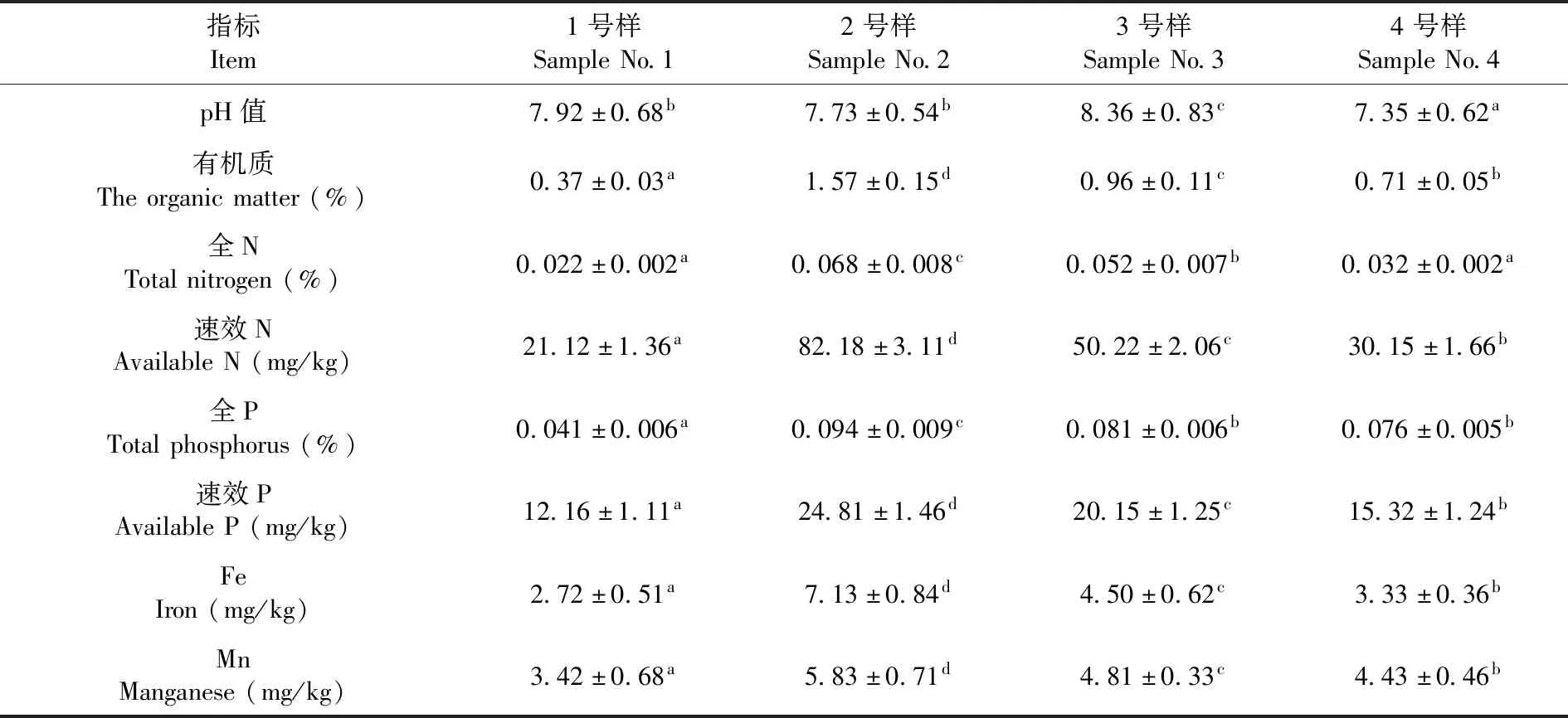
表1 土壤样品的基本理化性质Table 1 Main physical and chemical properties of soil samples
注:同行中的不同小写字母代表差异显著(Duncan test,P< 0.05),下同
Note:Mean values in the same line with different letters were significantly different (Duncan test,P< 0.05),the same as below
2.2 微生物多样性
Shannon与Simpson多样性指数为常用的反映微生物alpha多样性的指数之一。Shannon值越大,群落多样性越高;Simpson指数值越大,群落多样性越低;Coverage指各样本文库的覆盖率,其数值越高,则样本中序列被测出的概率越高,而没有被测出的概率越低[25]。伊犁河谷土壤中细菌的Shannon指数最大(P< 0.05),Simpson指数最小(P< 0.05);天山北麓土壤中细菌的Shannon指数最小(P< 0.05),Simpson指数最大(P< 0.05),且各样品的覆盖率都大于96%。焉耆盆地土壤中真菌的Shannon指数最大(P< 0.05),Simpson指数最小(P< 0.05);吐哈盆地土壤中真菌的Shannon指数最小(P< 0.05),Simpson指数最大(P< 0.05),且各样品的覆盖率都大于99%。伊犁河谷土壤中细菌的群落多样性最高,天山北麓土壤中细菌群落多样性最低;吐哈盆地中真菌群落多样性最低,焉耆盆地中真菌的群落多样性最高,且各样品的微生物物种信息得到了充分的体现。表2
2.3 样品中所含OTU数目
研究表明,Group1组中细菌共得到3 096个OTU,Group2组中细菌共得到3 214个OTU,Group3组中细菌共得到2 995个OTU,Group4组中细菌共得到2 283个OTU。分别将这4组两两比较发现:Group1与Group2共有细菌的OTU为2 173个,Group1与Group3共有细菌的OTU为2 182个,Group1与Group4共有细菌的OTU为1 723个,Group2与Group3共有细菌的OTU为2 228个,Group2与Group4共有细菌的OTU为1 674个,Group3与Group4共有细菌的OTU为1 813个。Group1中特有细菌的OTU为413个,Group2中特有细菌的OTU为498个,Group3中特有细菌的OTU为227个,Group4中特有细菌的OTU为154个。图1
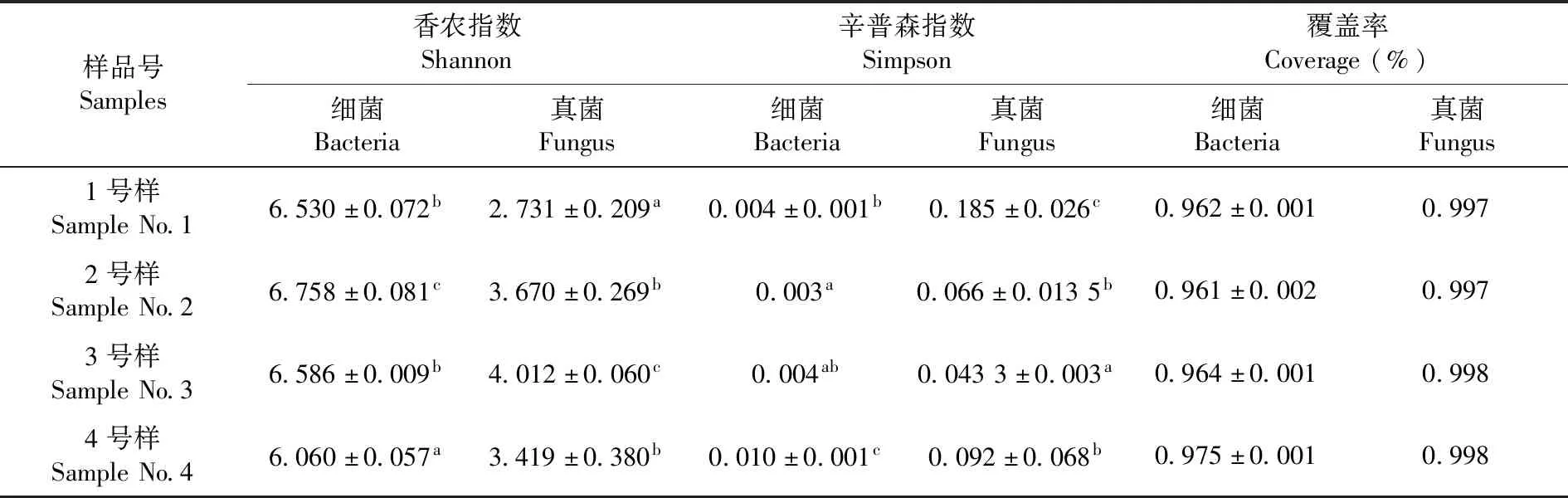
表2 样品中微生物多样性指数Table 2 Analysis of microbial diversity index in the samples
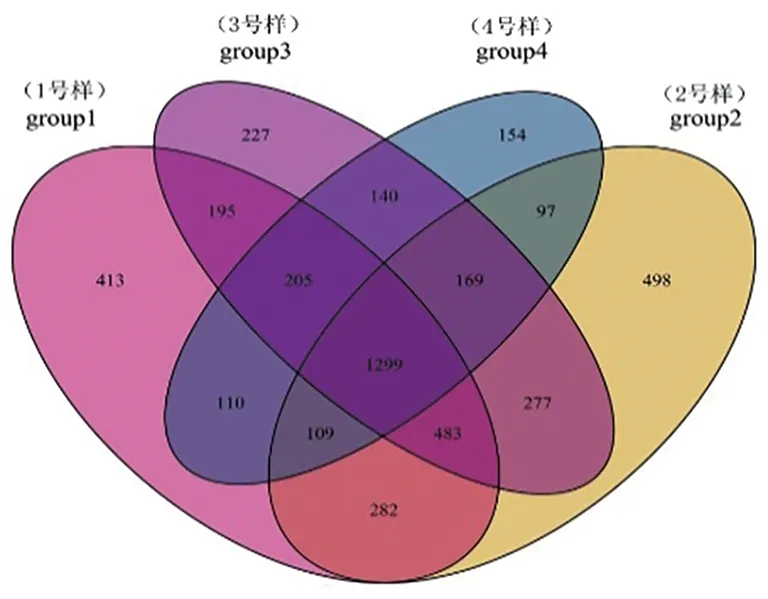
图1 细菌群落维恩图
Fig.1 Venn diagram of bacterial communities
研究表明,不同土壤样品所含细菌类群的OTU数Group2 > Group1 > Group3 > Group4,伊犁河谷土壤中细菌的类群最丰富,天山北麓土壤中的细菌类群最少。Group2伊犁河谷土壤与Group3焉耆盆地土壤中细菌类群的一致性最高,差异最小;Group2伊犁河谷土壤与Group4天山北麓土壤中细菌类群的一致性较低,差异明显。这4种土壤类型有部分一致的细菌类群,但从整体来看差异还是比较明显。图1
Group1组中真菌共得到665个OTU,Group2组中真菌共得到799个OTU,Group3组中真菌共得到831个OTU,Group4组中真菌共得到649个OTU。分别将这4组两两比较发现,Group1与Group2共有真菌的OTU为244个,Group1与Group3共有真菌的OTU为255个,Group1与Group4共有真菌的OTU为234个,Group2与Group3共有真菌的OTU为297个,Group2与Group4共有真菌的OTU为312个,Group3与Group4共有真菌的OTU为266个。Group1中特有真菌的OTU为285个,Group2中特有真菌的OTU为318个,Group3中特有真菌的OTU为380个,Group4中特有真菌的OTU为211个。图2
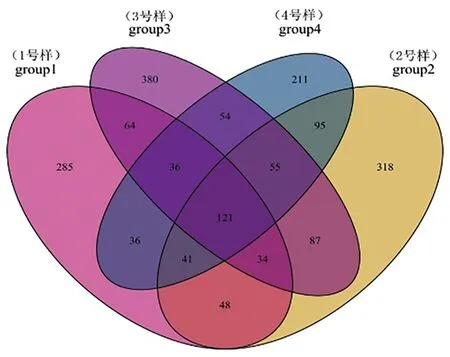
图2 真菌群落维恩图
Fig.2 Venn diagram of fungi communities
研究表明,不同土壤样品所含真菌类群的OTU数Group3 > Group2 > Group1 > Group4,表明焉耆盆地土壤中真菌的类群最丰富,天山北麓土壤中的真菌类群最少。Group2伊犁河谷土壤与Group4天山北麓土壤中真菌类群的一致性最高,差异最小;Group1吐哈盆地土壤与Group4天山北麓土壤中真菌类群的一致性较低,差异明显。这4种土壤类型有部分一致的真菌类群,但从整体来看差异还是比较明显。图2
2.4 微生物群落组成
研究表明,在12份土壤样品中未确定类群的细菌所占比例较大,其余按丰度大小排序为:节杆菌属(Arthrobacter)、芽单胞菌属(Gemmatimonas)、粪肠球菌属(Ohtaekwangia)、盐水微菌属(Salinimicrobium)、芽孢杆菌属(Bacillus)、Saccharibacteria_genera_incertae_sedis属、链霉菌属(Streptomyces)、鞘氨醇单胞菌属(Sphingomonas)、胸腺杆菌属(Steroidobacter)、类诺卡氏属(Nocardioides)、抗锑斯科曼氏球菌属(Skermanella)、Chryseolinea属、Subdivision3_genera_incertae_sedis属、Litorilinea属、硝化螺菌属(Nitrospira)、Aridibacter属、WPS-1_genera_incertae_sedis属、考克氏菌属(Kocuria)、大理石雕菌属(Marmoricola)、小梨形菌属(Pirellula)、Adhaeribacter属、地杆菌属(Pedobacter)及黄杆菌属(Flavobacterium);其中,吐哈盆地、焉耆盆地及天山北麓葡萄园土壤中节杆菌属细菌为优势菌属,而伊犁河谷葡萄园土壤中芽单胞菌属细菌为优势菌属。该研究结果不同于Hirano等[4]、Park等[5]的发现,在新疆酿酒葡萄产区土样中未检测到Kaistobacter。李翠霞等[26]发现,Oenococcus是葡萄酒苹果酸-乳酸发酵阶段(malate fermentation,MLF)的优势菌属,并大量存在于葡萄酒中,研究表明葡萄酒中的Oenococcus并非来自于葡萄园土壤,而由其他途径进入发酵罐参与发酵过程。此外,样品中检测到的Bacillus,在葡萄酒发生MLF后可以有效的降低其酸度,避免葡萄酒在装瓶、贮存期间发生2次发酵,增加葡萄酒的微生物学稳定性[27]。图3
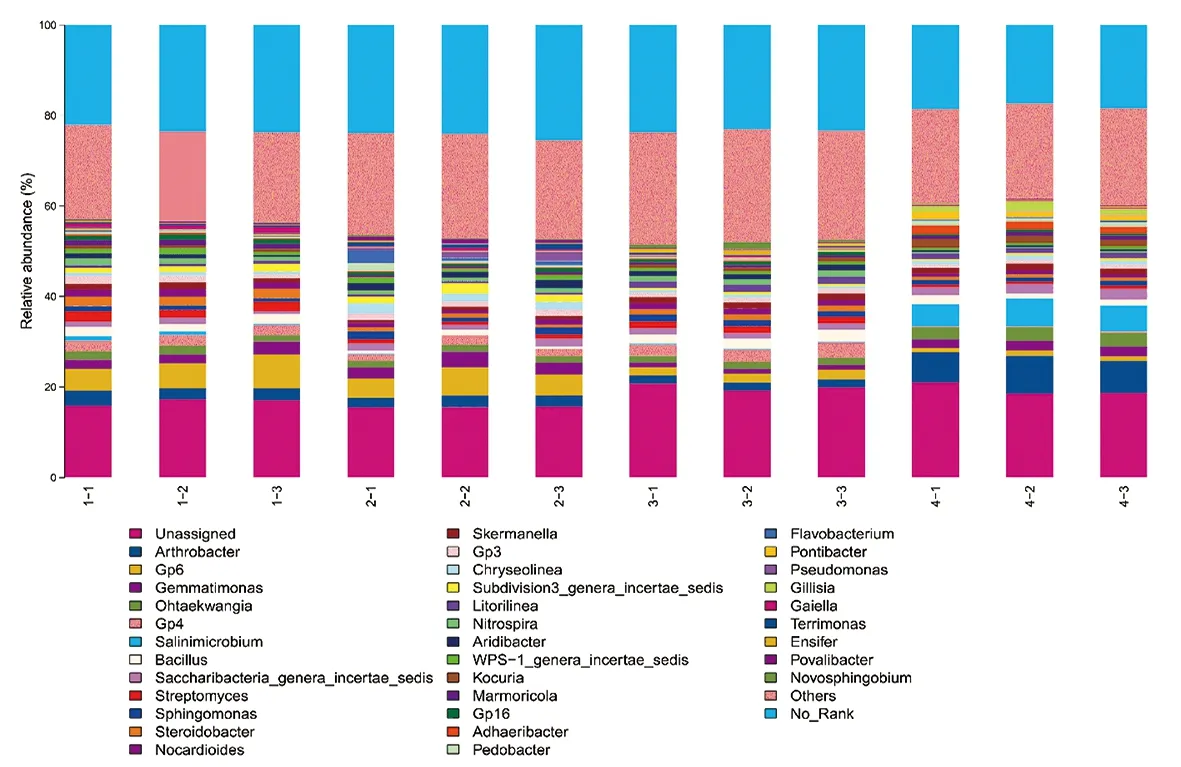
图3 细菌群落属水平相对丰度
Fig.3 Relative abundance of bacterial communities at genus level
研究表明,在12份土壤样品中未确定类群的真菌所占比例较大,其余按丰度大小排序为:耐冷酵母属(Guehomyces)、赤霉菌属(Gibberella)、刚毛四枝孢属(Tetracladium)、假裸囊菌属(Pseudogymnoascus)、被孢霉属(Mortierella)、镰刀菌属(Fusarium)、枝孢菌属(Cladosporium)、链格孢属(Alternaria)、隐球酵母属(Cryptococcus)、螺旋聚孢霉(Clonostachys)、单格孢属(Ulocladium)、绿僵菌属(Metarhizium)、Naganishia属、Mycoarthris属、丛赤壳属(Nectria)、支顶孢属(Acremonium)、球腔菌属(Mycosphaerella)、葡萄穗霉属(Stachybotrys)、金孢子菌属(Chrysosporium)、光黑壳属(Preussia)、青霉菌属(Penicillium)、曲霉属(Aspergillus)及Cystofilobasidium属;其中,吐哈盆地及天山北麓葡萄园土壤中耐冷酵母属真菌为优势菌属,伊犁河谷葡萄园土壤中刚毛四枝孢属真菌为优势菌属,焉耆盆地葡萄园土壤中赤霉菌属真菌为优势菌属。需要注意的是,Han等[28]研究发现,葡萄树白粉病对葡萄伤害非常大,使葡萄幼果易开裂腐败,该病由Erysisphe引发,而研究表明,新疆不同酿酒葡萄产区土样中均未检测到Erysisphe;Ferrari等研究[29]指出,赭曲霉素可以致人死亡,它主要由Aspergillus产生,但它存在于葡萄酒中的可能性风险却不高;Lachenmeier等[30]指出,霉菌是一种丝状真菌,能够侵染葡萄的茎、叶、花、果实等,造成果实减产,影响果实品质,它在储酒橡木桶内外、葡萄酒瓶木塞处很容易生长繁殖,产生令人不愉快的霉味。图4

图4 真菌群落属水平相对丰度
Fig.4 Relative abundance of fungi communities at genus level
2.5 微生物群落与环境因子RDA
冗余分析(RDA,redundancy analysis)是目前2种常用的约束性排序方法[31],用来解释环境因子对于样本中微生物群落组成的影响。箭头射线代表不同的环境因子,射线越长表示该环境因子影响越大;样本/菌群-虚线中心连线与箭头之间的夹角代表了样本/菌群与环境因子之间的相关关系(夹角为锐角时表示呈正相关关系,钝角时呈负相关关系,直角表示不相关)。轴一(横轴)和轴二(纵轴)的解释量分别为35.38%和25.42%。环境因子中土壤样品pH值对细菌群落属水平组成影响较大,P元素含量对细菌群落属水平组成影响最小;Gp6、Gp4、Bacillus、Streptomyces、Sphingomonas、Steroidobacter、Nocardioides、Skermanella及Gp3属细菌与土壤样品的pH值呈正相关,而Arthrobacter、Gemmatimonas、Ohtaekwangia、Salinimicrobium、Saccharibacteria_genera_incertae_sedis及Chryseolinea属细菌与土壤样品pH值呈负相关。图5
研究表明,轴一(横轴)和轴二(纵轴)的解释量分别为28.69%和25.61%。环境因子中Mn元素含量对真菌群落属水平组成影响最大,P元素含量对真菌群落属水平组成影响最小;Gibberella、Tetracladium、Mortierella、Cladosporium、Alternaria及Clonostachys属真菌与土壤样品的Mn元素含量呈正相关,而Guehomyces、Pseudogymnoascus、Fusarium、Cryptococcus、Ulocladium、Metarhizium及Naganishia属真菌与土壤样品的Mn元素含量呈负相关。图6
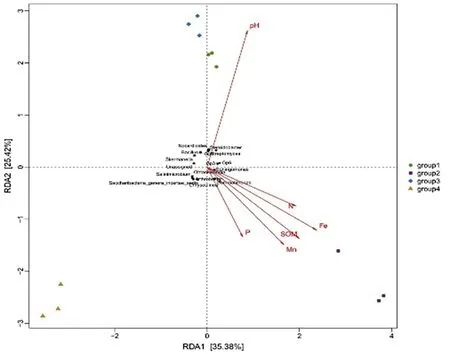
图5 细菌群落与环境因子的冗余
Fig.5 Redundancy analysis biplot between the bacterial communities and environment factor
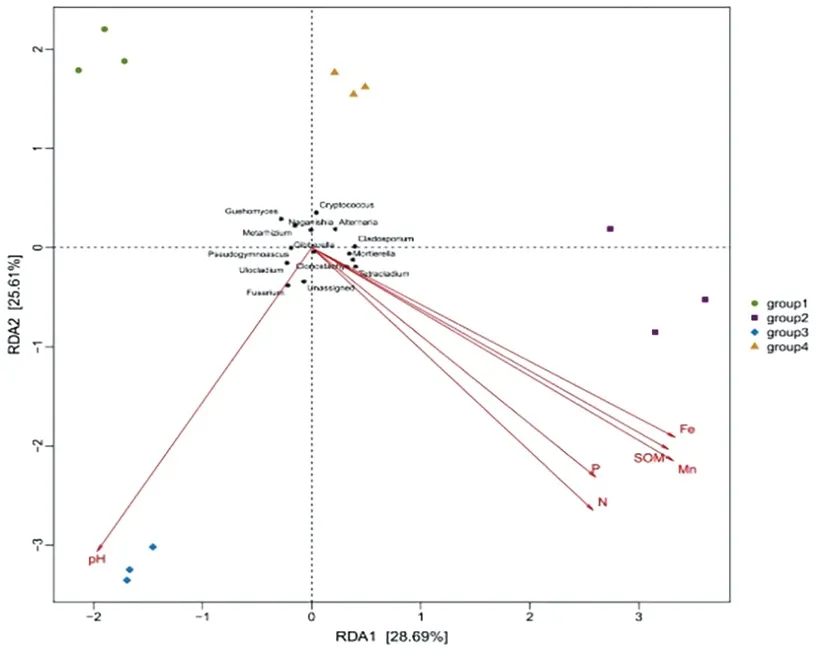
图6 真菌群落与环境因子的冗余
Fig.6 Redundancy analysis biplot between the fungi communities and environment factor
3 讨 论
3.1 新疆酿酒葡萄主产区土壤微生物多样性
土壤是一个天然的微生物资源库[32],几乎可以提供微生物生长所需要的所有营养[33]。对于果园生态系统来说,果园土壤本身的理化性质及果园果树自身的种类、覆草、施肥、农药等措施均会对其土壤微生物的群落结构和功能产生影响[34-35]。陈大勋等[36]对龙眼、香蕉、枇杷等果园土壤微生物多样性进行研究,发现不同果园土壤微生物总数量差异较大。张翔等[37]研究发现生物有机肥可提高果园土壤微生物的丰富度和多样性。Baddam等[38]的研究结果表明,细菌是土壤样品中的优势菌,真菌相对较少,研究结果也是如此。魏玉洁等[39]研究发现,新疆天山北麓葡萄园土壤中主要的细菌有放线菌、拟杆菌、泉古菌、厚壁菌、硝化螺旋菌、浮霉菌、变形菌及疣微菌8个菌门,且Kaistobacter属、节细菌属及Skermanella属细菌大量存在于土壤样品中;研究还检测到了酸杆菌门、绿弯菌门Chloroflexi、芽单胞菌门、异常球菌-栖热菌门及Candidatus_Saccharibacteria门细菌,但没有检测到泉古菌门细菌,且节杆菌属、芽单胞菌属及粪肠球菌属细菌大量存在于新疆4个主要酿酒葡萄产区土壤样品中。
魏玉洁等[39]研究还发现,新疆天山北麓葡萄园土壤主要的真菌微生物(门水平)为子囊菌门、担子菌门、壶菌门、Un-s-fungal sp CC 06_28门及Zygomycota 5个菌门,且酵母属、粪壳菌属和Tetracladium属真菌大量存在于样品中;研究还检测到了Glomeromycota门、Cercozoa门、Rozellomycota门真菌,且耐冷酵母属、赤霉菌属及刚毛四枝孢属真菌大量存在于新疆4个主要酿酒葡萄产区土壤样品中。上述研究结果表明,新疆不同酿酒葡萄产区因为气候、土壤肥力等因素有较大差异,从而影响土壤微生物群落的组成与分布,与Tan等[40]及Cordero-Bueso等[41]的研究结果一致。
3.2 新疆酿酒葡萄主产区环境因子对微生物群落多样性的影响
研究表明,影响土壤微生物群落结构组成和多样性的因素有自然因素和人为因素[42]。牛世全等[43]通过高通量测序技术研究河西走廊地区盐碱土壤中微生物多样性后发现,环境因子中土壤pH对微生物群落组成的影响最显著,这与研究结果一致。研究的RDA分析表明,环境因子中土壤样品pH值对细菌群落组成影响最显著,P元素含量对细菌群落组成的影响最小;另一方面,Mn元素含量对真菌群落组成影响最显著,P元素含量对真菌群落组成的影响最小。在通常情况下,土壤中普遍存在适应该环境特有的微生物群落[44],但由于气候、土壤肥力及发展农业生产的同时,用水的管理、调节及配套的排灌工程等都会导致土壤微生物的群落组成发生变化,应用高通量测序技术就可以更为充分地反映出土壤微生物群落的多样性和分布情况。
4 结 论
4.1 新疆伊犁河谷土壤中细菌的群落多样性最高,新疆天山北麓土壤中细菌群落多样性最低;新疆焉耆盆地中真菌的群落多样性最高,新疆吐哈盆地中真菌群落多样性最低。
4.2 节杆菌属细菌和耐冷酵母属真菌是吐哈盆地和天山北麓葡萄园土壤中的优势菌属;芽单胞菌属细菌和刚毛四枝孢属真菌是伊犁河谷葡萄园土壤中的优势菌属;节杆菌属细菌和赤霉菌属真菌是焉耆盆地葡萄园土壤中的优势菌属。
4.3 土壤样品理化指标中pH值对中国新疆吐哈盆地、伊犁河谷、焉耆盆地、天山北麓4个主要酿酒葡萄产区土壤微生物细菌群落组成影响最显著,Mn元素含量对真菌群落组成影响最显著,而P元素含量对微生物群落组成影响最小。
