缺氧诱导因子-1蛋白在犬乳腺肿瘤中的表达及其临床意义
2020-05-18伍怡佳范玉华
伍怡佳,姚 华,范玉华
(北京农学院 动物科学技术学院,北京 102206)
随着动物医疗的发展,宠物犬老年疾病的患病率和诊断需求也不断增加。乳腺肿瘤是母犬最常见的肿瘤,在9至11岁的老龄母犬群体中多发,其发病率占母犬肿瘤数量的50%,犬的恶性乳腺肿瘤较为常见[1],发病率与死亡率都非常高。因此,需要有效的检测手段。
缺氧诱导因子-1(HIF-1)在医学临床上已被公认为重要的癌症药物靶标,其最初是作为一种生物O2传感器被发现,可使机体适应缺氧状态。HIF-1是一个异二聚体转录因子,由HIF-1α和HIF-1β两个亚基组成,(或其类似物 HIF-2α和 HIF-3α)。其中,HIF-1α是氧敏感亚基,在低氧条件下诱导其发生表达[2-4]。
本试验检测缺氧诱导因子(HIF-1α)在犬乳腺肿瘤组织中的表达,分析其与犬乳腺肿瘤性质的关系,探明其在肿瘤发生发展中的作用机制。
1 材料与方法
1.1 样本收集
2017—2019年间在北京市多家宠物医院收集疑似犬乳腺肿瘤样本20例,并经兽医师和宠物主人同意后用于试验研究。
1.2 主要试剂
DAB显色试剂盒(ZLI-9018)、兔二步法检测试剂盒(PV-9001)、兔抗人缺氧诱导因子-1α单克隆抗体(ZA-0552)、免疫组化抗原修复缓冲液(EDTA抗原修复液pH 8.0)均购于北京中杉金桥生物技术有限公司。分析纯酒精、分析纯二甲苯及PBS均购自北京试剂公司。
1.3 试验方法
1.3.1 病理组织学观察 将疑似犬乳腺肿瘤样本在4%多聚甲醛中固定24 h,之后切成1 cm3的小块放入包埋盒中流水冲洗6~8 h,随后进行脱水、浸蜡及包埋处理,制成蜡块。使用病理切片机将蜡块切成4 μm的薄片后进行病理组织学鉴定和免疫组织化学实验。通过世界卫生组织的标准对其进行分类,判定其肿瘤的性质。
1.3.2 免疫组织化学方法 制作石蜡切片,载玻片使用阳离子防脱片。将4 μm的薄片进行脱蜡水化后,用PBS洗3次,每次3 min。在高压锅内进行抗原修复,冷却后用PBS洗3次,每次3 min。加入内源性过氧化物阻断酶,避光反应12 min后,用PBS洗3次,每次3 min。加入一抗,4 ℃过夜,复温后37 ℃烘箱反应1 h。用PBS单独冲洗一抗,防止污染阴性对照。加入反应增强液,37 ℃烘箱反应20 min,用PBS洗3次,每次3 min。加入增强酶标山羊抗兔IgG聚合物,37 ℃烘箱反应20 min,用PBS洗3次,每次3 min。最后DAB显色,苏木素复染,脱水透明后用中性树胶封片。PBS代替一抗作为阴性对照。HIF-1蛋白的阳性部位在细胞核和细胞质,显微镜下以清晰的有棕黄色、黄色的颗粒为有HIF-1蛋白的表达。
1.4 统计分析
采用 SPSS20 软件进行数据处理,选用 fisher’s 精确检验法、Pearson 相关性分析对 HIF-1α蛋白在良性肿瘤组与恶性肿瘤组之间的表达情况进行差异性检验。若P<0.05 表示 HIF-1α在不同性质的犬乳腺肿瘤中表达存在显著差异,并且差异性具有统计学意义;若P>0.05 表示差异不显著,没有统计学意义。
选取细胞计数比对[5-6]。HIF-1α以胞浆和胞核中出现清晰的黄色或黄褐色颗粒为阳性染色。其阳性结果判断:阳性细胞数<5%为“-”,5%~25%为“+”;阳性细胞数 26%~50%为 “++”;阳性细胞数 51%~75%为“+++”;阳性细胞数>75%为“++++”。
2 结 果
2.1 肿瘤性质的病理组织学分析
收集到疑似犬乳腺肿瘤病例20 例,经病理组织学观察得出良性乳腺肿瘤6 例,占犬乳腺肿瘤病例的30%;恶性乳腺肿瘤14例,占全部病例数的70%。可见,恶性肿瘤的发病率超过良性乳腺肿瘤,应引起临床兽医的高度关注。
本试验将所收集病例进行组织学分型,结果见表1。
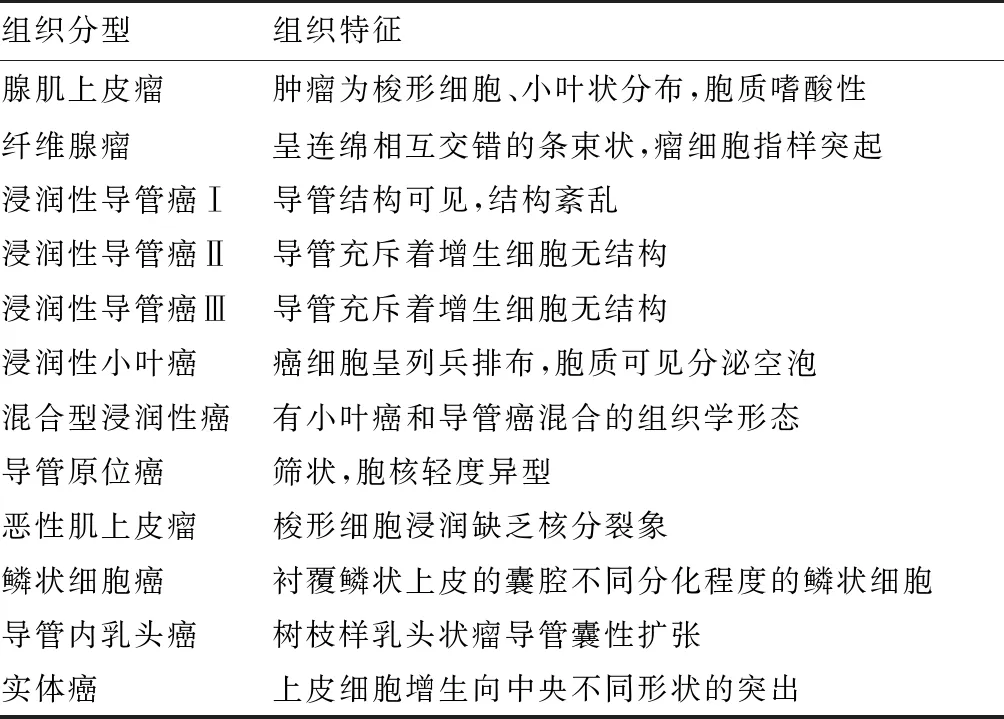
表1 不同乳腺肿瘤组织学特点Tab.1 Histological characteristics of different breast tumors
图1为犬浸润性导管癌组织切片分别为 HE 染色在 4 倍镜、40 倍镜下的图像。图 1组织结构紊乱,伴有部分出血坏死的特征,乳腺导管结构不完整,间质内存在大量同质细胞。其中可清晰地看到肿瘤细胞胞质嗜酸,胞核部分有分裂象。而良性肿瘤组织分化好、异型性小,基本无或者很少可见病理核分裂象。
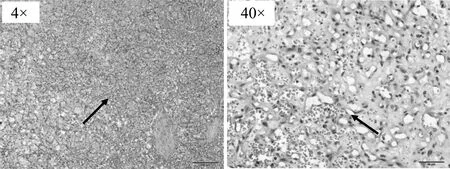
图1 浸润性导管癌病理切片Fig.1 Pathological section of invasive ductal carcinoma
2.2 HIF-1蛋白在犬乳腺肿瘤中的表达
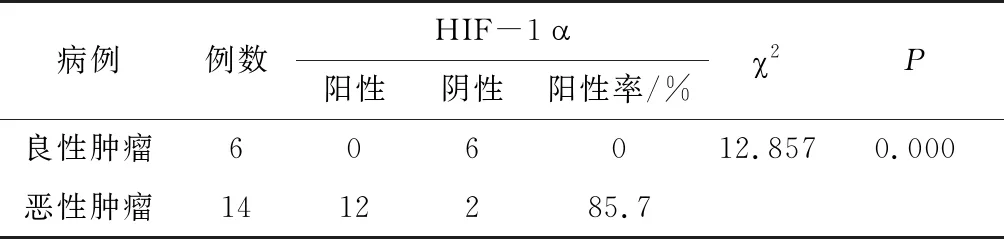
如表 2 所示,对 HIF-1α蛋白在良性肿瘤组与恶性肿瘤组之间的表达情况进行差异性检验,检验结果P<0.05,表示 HIF-1α在不同性质的犬乳腺肿瘤中表达存在显著差异,且差异性具有统计学意义。因此,犬恶性乳腺肿瘤中 HIF-1α的表达显著高于良性乳腺肿瘤,阳性表达率为85.7%。
表2 犬乳腺肿瘤组织中 HIF-1α蛋白的表达
Tab.2 Expression of HIF-1α protein in canine mammary tumor tissues
将本试验的20例犬乳腺肿瘤样本进行定量分析,结果见表3。图2分别从4倍镜、10倍镜、40倍镜下展示了 HIF-1α在浸润性导管癌组织中阴性和阳性的表达。从图中可以看出,HIF-1α的阳性表达在肿瘤细胞的胞核和胞浆中,呈现典型的黄色甚至黄褐色。
表3 HIF-1α在犬乳腺肿瘤中的定量分析统计
Tab.3 Quantitative analysis and statistics of HIF-1α in canine breast tumors
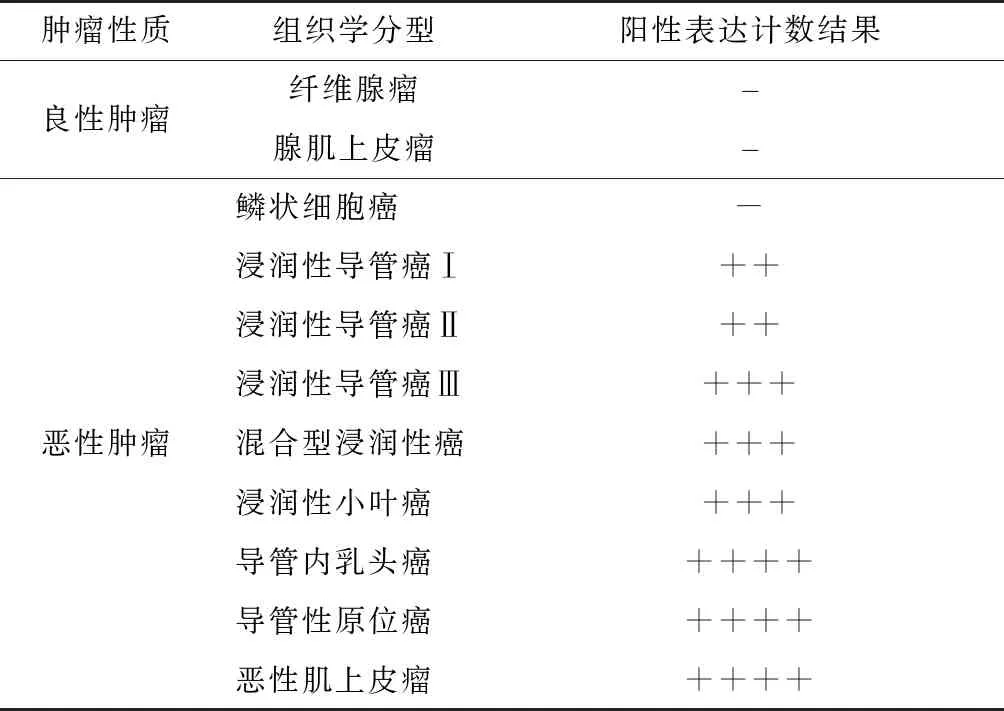

图2 不同倍镜下的浸润性犬乳腺癌免疫组织化学切片Fig.2 Immunohistochemical section of invasive canine breast cancerunder different magnifications
3 讨论和结论
3.1 HIF-1蛋白对肿瘤发生发展的影响
缺氧诱导因子-1α(HIF-1α)是缺氧条件下细胞产生的一种核转录因子,是体内维持细胞内氧平衡的主要调控因子[7]。在正常条件下,HIF 的 a 亚基被蛋白酶体快速降解,但在低氧条件下稳定下来。在低氧条件下,氧成为限制前体羟基化的速率,并且HIF-1a 的周转率相应地降低,使 HIF-1a 在细胞内积累[8]。缺氧从而引起基因上调,调节细胞适应低氧状态下的能量代谢和氧的运输[9]。
肿瘤发生过程中,实体病变首先经历一个无血管的生长阶段,细胞迅速生长增殖,直到氧气的扩散和废物和营养物质的交换成为速率限制。而肿瘤组织细胞的生长和存活依赖于它们促进血管生成和适应缺氧条件的能力。尽管微血管密度会增加,即使是大肿瘤,其血管结构和功能也会异常,导致局部缺氧[8]。
HIF-1α不仅是重要的调控氧平衡的转录因子,还可以通过激活其他因子,影响肿瘤发生发展过程,如激活血管的转录内皮生长因子(VEGF),反过来促进血管生成通过刺激内皮细胞的生长、迁移和侵袭形成新的血管,促进肿瘤进展[10]。在大多数肿瘤中 HIF-1α过量产生,并与不同目的基因缺氧反应原件中的一段共有序列结合,增加了肿瘤细胞在缺氧条件下的存活,促进肿瘤生长[11]。此外,还有研究表明中止缺氧诱导基因的转录,在体内和体外均抑制肿瘤生长。与肿瘤密切相关的原癌基因、抑癌基因和生长因子均与 HIF-1α有密切的联系[12]。因此,肿瘤的发生发展过程与 HIF-1α密不可分。
3.2 HIF-1蛋白的过表达对犬乳腺肿瘤良恶性变化的作用
本试验统计了 HIF-1α在 20 例犬乳腺肿瘤中的表达情况。其中有 6 例良性乳腺肿瘤,均未有阳性结果出现,而在恶性肿瘤组织中HIF-1α的表达率很高,14 例恶性肿瘤组织中有 12 例出现阳性结果,阳性率达到85.7%。且其中有 4 例呈现出强阳性,组织片呈现深染黄色甚至黄褐色。统计结果显示,HIF-1α在恶性乳腺肿瘤中的表达率显著高于良性组织中(P<0.05),具有统计学意义。提示,HIF-1α与犬恶性乳腺肿瘤的发生发展有密切的关系。
研究提示,HIF-1α在乳腺癌中可能扮演着重要的角色。如肿瘤微环境研究发现肿瘤缺氧是影响临床预后的重要因素,可促进肿瘤的遗传不稳定性、肿瘤细胞转移和侵袭性[13]。肿瘤启动缺氧是发生恶性转化和转移的启动子。缺氧会改变癌细胞的新陈代谢,通过诱导细胞静止增加对治疗的抵抗力[14]。因此,肿瘤组织微环境缺氧也是肿瘤治疗效果差,易产生放化疗耐受的原因之一。
据报道,在医学临床上90%的乳腺肿瘤的死亡是由于转移所致,转移常与血管生成有关[15]。HIF-1α可以激活血管的转录内皮生长因子(VEGF),促进血管生成通过刺激内皮细胞的生长、迁移和侵袭形成新的血管,促进肿瘤不断发生发展,HIF-1α还可以通过与其他因子相互作用,影响肿瘤发生发展过程[10]。有研究发现,HIF-1α与MTDH相互作用共同作用于乳腺癌转移过程,除此之外,HIF-1α也与E-cadherin 相互作用,共同促进乳腺癌的发生发展与转移作用[16-17]。因此,HIF-1α在肿瘤恶性癌变中有重要意义。
在免疫组化染色中,HIF-1α在犬恶性乳腺肿瘤组织中高表达、结果对比清晰明白(黄色和蓝色对比)易于统计分析。缺氧诱导因子-1α(HIF-1α)是缺氧条件下肿瘤细胞产生的一种核转录因子,且作为癌症指标 HIF-1α容易测量、可对肿瘤发病过程及预后进行判断,而且随着免疫组化技术的不断发展,可以便捷简单快速的测量 HIF-1α转录表达情况。因此,HIF-1α可以作为乳腺癌敏感指标来进行临床评价。
HIF-1α在犬恶性乳腺肿瘤中的表达显著高于良性乳腺肿瘤,对肿瘤诊断和预后评价有重要的临床参考价值。
